宁夏地区宠物源MRSA对四环素类药物耐药性及外排泵分子特征的分析
2021-12-23毛彦妮彭何涛张蒙蒙康馨匀王桂琴
马 靓,马 强,李 娜,毛彦妮,彭何涛,张蒙蒙,康馨匀,王 鑫,王桂琴
(宁夏大学 农学院,宁夏 银川 750021)
金黄色葡萄球菌随着抗生素的广泛使用,甚至滥用,产生了严重的耐药性[1]。其中,耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)衍生出典型的mecA耐药基因[2],其编码的青霉素结合蛋白PBP2a导致对该菌对β-内酰胺类药物的高度耐药[3]。此外,金黄色葡萄球菌还通过可移动基因元件获得耐药性[4],MRSA该种超级耐药菌株逐渐演变出的高度耐药与广泛耐药问题,已变得不容忽视[5]。
四环素类抗生素广泛用于治疗革兰阳性和阴性细菌、细胞内支原体、衣原体和立克次氏体引起的感染,也是动物使用最多的抗生素之一,但近年该类药物的耐药性已愈发突出[6]。细菌针对四环素的耐药机制主要有3个,可能单独存在,也可能多个存在并协同作用:外排泵外排机制;核糖体保护机制;酶促降解机制[7]。四环素类抗生素外排泵属于主要易化子超家族MFS[8],是一种金属-四环素/H+反转运蛋白[9]。革兰阳性菌中常见的四环素外排泵蛋白为TetK和TetL[10]。本研究针对分离获得的宠物源MASR进行药敏试验,测定其对四环素类药物的耐药情况,并检测外排泵相关基因。借助生物信息学及分子模拟技术,分析所检出外排泵的进化规律及其作用方式,并对现有抑制剂利血平进行抑制活性的理论评价。以期为宁夏地区金黄色葡萄球菌的治疗、防控提供一定有效参考。
1 材料与方法
1.1 主要试剂与仪器CHROM-agarTM金黄色葡萄球菌显色培养基购自法国科玛嘉生物公司;MH(A)琼脂培养基购自青岛高科园海博生物技术有限公司;细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;2×Taq PCR Master-Mix购自TaKaRa公司;药敏纸片购自Oxoid公司。电热恒温培养箱(DNP-9272)购自上海精宏实验设备有限公司;超净工作台(SW-CJ-2FD)购自苏州安泰空气技术有限公司;电泳仪购自北京市六一仪器厂;全自动凝胶成像系统购自Bio-Rad公司。
1.2 MRSA分离鉴定于2019-2020年从宁夏地区不同宠物医院采集样品,经CHROM-agarTM金黄色葡萄球菌显色培养基筛选、细菌基因组提取试剂盒提取DNA,再运用三重PCR方法扩增16S rRNA、nuc和mecA基因,测序后在NCBI网站中进行序列比对,以检验MRSA。参考HWANG等[11]的研究,确定三重PCR反应体系:25 μL 2×Multiplex Master Mix,1 μL模板DNA,10 μmol/L引物混合物(每种引物0.5 μmol/L),并加双蒸水将最终体积调整为50 μL,进行三重PCR反应。PCR反应条件:94℃ 15 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,30个循环;最终在72℃延伸10 min。通过在琼脂糖凝胶电泳检测PCR扩增产物。
1.3 药敏试验根据2019年美国临床实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI 2019)[12]推荐的药敏纸片琼脂扩散法(K-B法)测定30株MRSA对16种抗菌药物的敏感性,结果判定参照CLSI(2019)标准,分别以敏感(S)、中介(I)和耐药(R)3种形式记录。
1.4 四环素耐药基因检测以基因组DNA为模板扩增基因tetK、tetM、tetO和tetL,所用PCR体系为20 μL:模板1 μL,上、下游引物各0.5 μL,2×Taq PCR Mix 10 μL,用双蒸水补至20 μL。反应条件:95℃预变性5 min;95℃变形30 s,退火30 s,72℃延伸1 min,35个循环;最后72℃延伸10 min。将扩增产物送至生工生物(上海)股份有限公司测序,结果利用NCBI网站BLAST工具进行序列比对。引物序列见表1。

表1 PCR引物序列相关信息
1.5 系统进化分析将测序获得的tetK基因序列提交至NCBI网站,经BLAST同源比对,选取并下载与目的基因同源性≥90%的序列,使用CLASTAL X 1.83进行多序列比对,随后借助MEGA 7.0及在线工具iTOL(https://itol.embl.de/),基于Neighber-Joinning法构建系统发育树。
1.6 结构特征分析借助Detaibio(https://mip.statscrop.com/www/detaibio.com),Jpred4(http://www.compbio.dundee.ac.uk/jpred/)和Predict-Protein(http://www.predictprotein.org/)在线工具进行蛋白二级结构预测;利用SWISS-MODEL(ttps://swissmodel.expasy.org)和Consurf Web Server(https://consurf.tau.ac.il/faq.php)网站进行外排泵蛋白的同源模建及保守性分析;通过PyMOL、插件Carver进行位点突变及分析蛋白通道。
1.7 分子对接及粗粒化动力学模拟利用分子对接软件AutoDock 4.0、Vina及UCSF DOCK6,通过确定好的作用位点和本地区检出的外排泵蛋白进行半柔性分子对接分析,其中计算外排泵蛋白与药物分子亲合能的公式:Eblind=EvdW+EHbond+Edesolv;借助在线工具CABS-flex(http://biocomp.chem.uw.edu.pl/CABSflex2/submit)进行粗粒化动力学模拟,分析TetK蛋白的结构柔性;以均方根波动(RMSF)反映蛋白中各氨基酸运动的自由度。
1.8 外排泵抑制试验对51株MRSA分离株进行利血平对外排泵活性的抑制试验,基于外排泵基因检测结果对菌株进行分组,即携带与不携带2组;依次将培养至对数期的金黄色葡萄球菌菌液稀释至D600=0.1,在96微孔板中每孔加入100 μL稀释后菌液和100 μL不同浓度的四环素及多西环素药液,随后添加利血平使其终质量浓度达5 mg/L,置于37℃恒温培养12 h后判读MIC值。
2 结果
2.1 金黄色葡萄球菌的分离鉴定从宁夏地区不同宠物医院采集样品,使用CHRO-MagarTM金黄色葡萄球菌显色培养基筛选,运用PCR方法扩增16S rRNA、nuc和mecA基因,最终确定239株全部为金黄色葡萄球菌,其中51株为MRSA,检出率为21.34%(图1)。
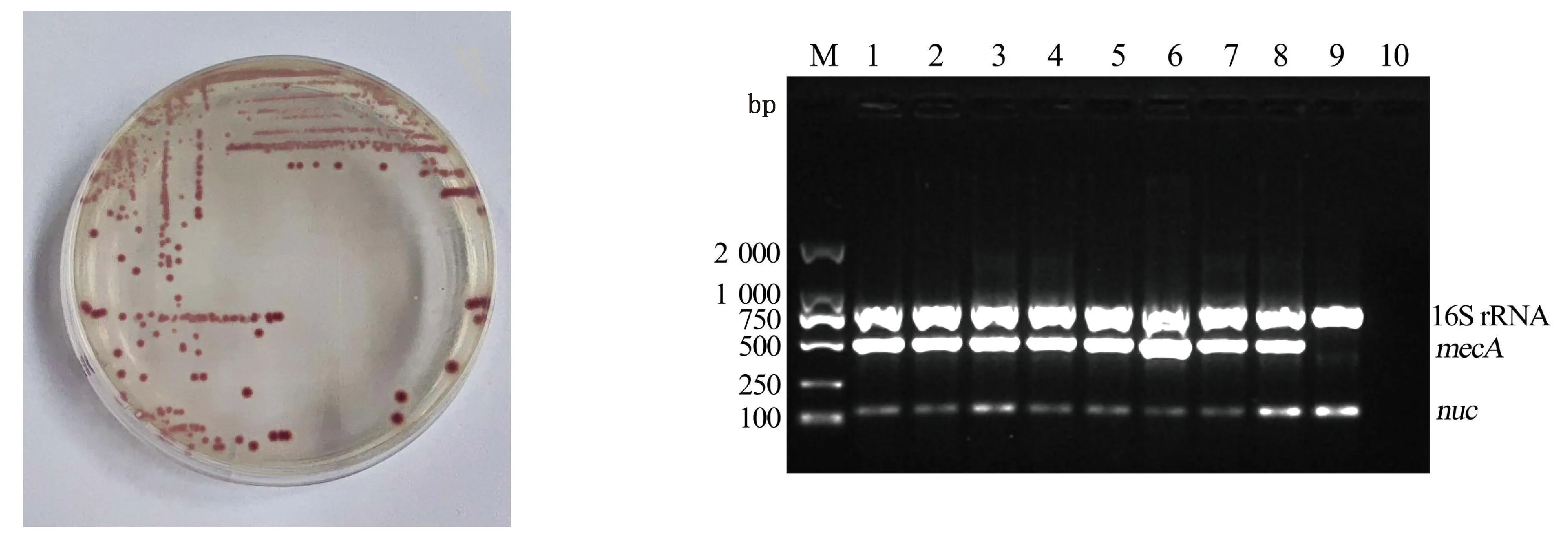
M.DL2000 DNA Marker;1~7.样品;8.阳性对照ATCC33591;9.阴性对照ATCC29213;10.空白对照图1 显色培养基上的金黄色葡萄球菌(左)及三重PCR扩增电泳图(右)
2.2 药敏试验结果51株MRSA对16种抗菌药物的耐药情况见表2。由表2可知,四环素、多西环素、青霉素和克林霉素耐药情况较为突出,耐药率分别为78.43%,70.06%,82.35%,66.66%;而氨苄西林、左氧氟沙星和杆菌肽的耐药率为45.10%~54.90%;对万古霉素和利奈唑胺全部敏感。

表2 51株MRSA对16种抗菌药物的耐药率
2.3 四环素耐药基因检测以51株宠物源MRSA的基因组为模板,PCR方法扩增四环素耐药基因tetK、tetM、tetO和tetL;结果如表3所示:tetM基因检出率最高为90.20%,其次是tetK和tetL基因,检出率分别为54.90%和49.02%,tetO基因未检出。此外,对外排泵基因的多种携带方式进行分析,发现同时携带tetK+tetM与tetK+tetM+tetL基因的比例最高(49.02%)。

表3 51株MRSA耐药基因携带情况
2.4 系统进化分析将tetK基因测序序列与NCBI数据库中序列进行同源性比对,结果显示tetK基因序列与StaphylococcusaureusUP403、JY22和Staphylococcussciuriwo19-3的相似性达100%,与StaphylococcussaprophyticusUTI-056、StaphylococcusaureusMJ015等相似性达99.69%。系统进化分析可知,本地区检出的tetK基因与StaphylococcussaprophyticusCP05447.1、StaphylococcusaureusCP053184.1和StaphylococcusepidermidisCP043801.1等菌株携带的tetK基因聚于同于一支且自展值为100%,说明本地区检出的tetK基因所在分支可信度高(图2)。
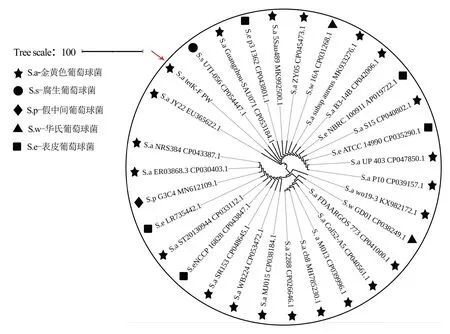
图2 基于tetK基因序列的系统进化树
2.5 结构特征分析结果见图3。TetK外排泵蛋白包含的α-螺旋为84.10%,非螺旋结构为15.9%。经跨膜域分析可知,胞内氨基酸占22.22%,胞外氨基酸占11.11%,跨膜氨基酸占66.67%。其后进行氨基酸保守性分析,并将保守程度投影至蛋白的三级结构,以研究氨基酸保守性与结构维持及功能发挥的相关性。分析发现,Met31-Pro38、Gly151-Gly160、Val382-Ser387及Ser393-Gly400等区域呈现出高度保守性。结合卷积神经网络进行溶剂可及性和功能预测,值得注意的是,高度保守的氨基酸主要分布在蛋白内部(buried)并位于胞内和跨膜螺旋区域,这将对外排泵蛋白的结构维持和功能发挥起到重要作用。蛋白通道分析可知,Ser26、Glu29、Gly145、Gly151、Glu152、Ile276、Ser277、Ser393和Glu397等氨基酸围绕形成较为宽阔的外排通道入口,Leu206-Phe218区域形成通道的出口;计算可知,蛋白通道直径大小处于2.40~3.46Å,且在蛋白通道入口处存在一段α-螺旋-无规则卷曲,可能对药物进入通道造成影响。

图3 TetK外排泵蛋白的结构特征分析
2.6 分子对接及粗粒化动力学模拟结果见图4。对接发现,利血平的结合亲和能最低(-41.00 kJ/mol),四环素次之(-36.40 kJ/mol),多西环素最高(-28.12 kJ/mol)。四环素C3位与Ser393可形成氢键作用,C10位和C11位均可与Glu152形成氢键作用。C7、C8、C9、C10位所在苯环可与Lys366、Ile276形成疏水作用,与Glu152形成π-阴离子作用。同时,多西环素C2位与Ser393、Ile276、Ser277形成氢键作用,C4位与Glu30、Glu152、Ser277形成氢键作用,C7、C8、C9、C10位所在苯环可与Por121、Met125形成疏水作用。利血平C42位与Glu30形成氢键作用,C35、C36、C37、C38、C39、C41组成的苯环与Pro121形成疏水作用,O1与Ser393形成氢键作用,O4与Ser370形成氢键作用,C40与Gly145、Ile307形成氢键作用。此外,粗粒化动力学模拟发现,药物与TetK蛋白关键结合位点Glu30、Glu152、Ile276和Ser277的均方根波动(RMSF)减小,结构柔性降低。说明药物和蛋白结合稳定,利于药物与外排口袋的结合;也存在某些位点RMSF增大的情况,推测该种变化与氨基酸残基间存在耦合关系和一定隐式构象有关。
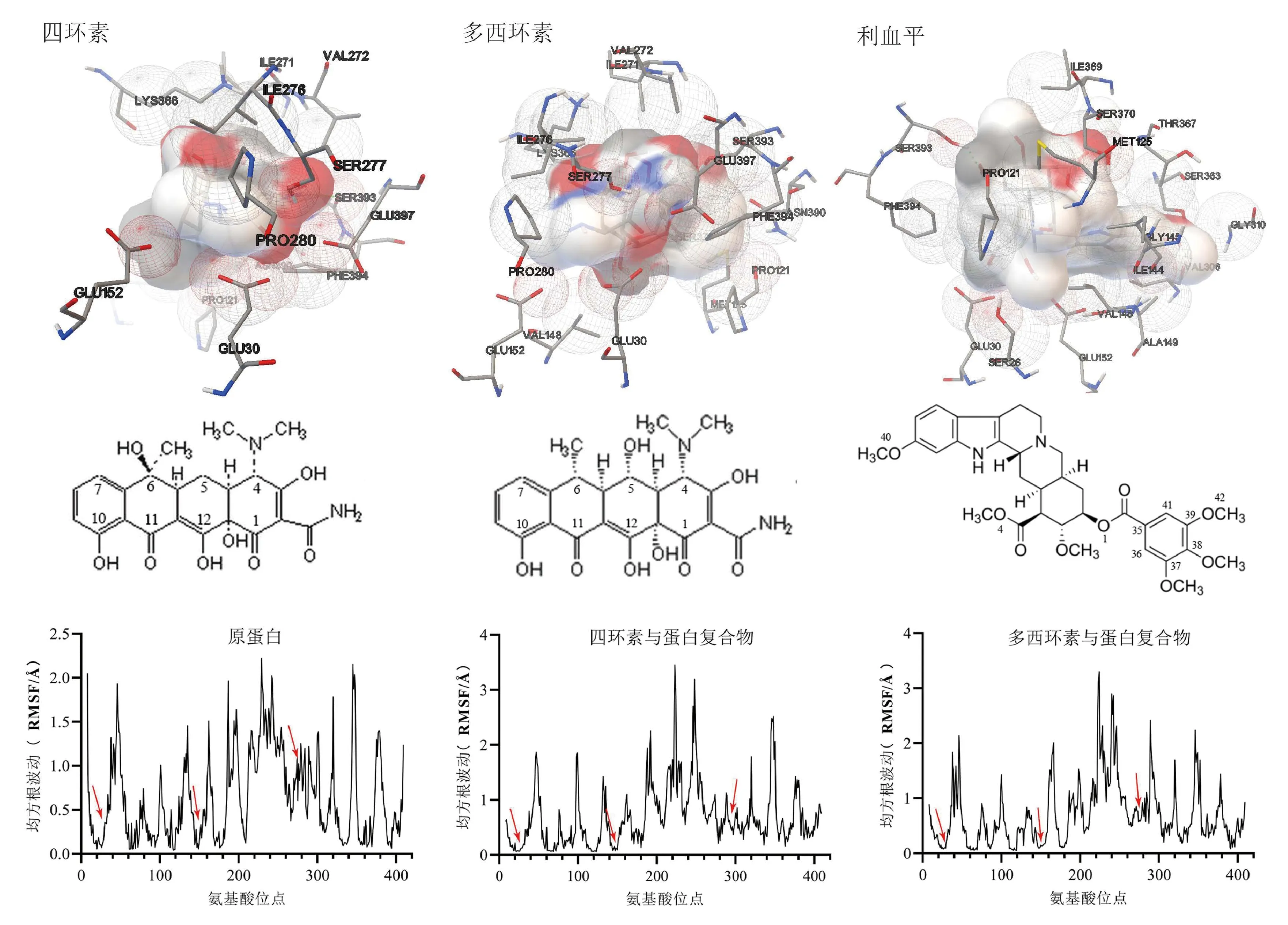
图4 四环素、多西环素和利血平与外排蛋白对接图与粗粒化动力学模拟
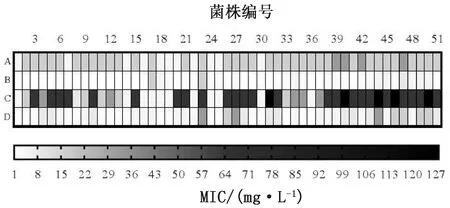
2.7 外排泵抑制试验结果见图5~7。添加利血平可明显影响四环素类药物在MRSA菌株中的最低抑菌浓度(MIC),并使其降低4~32倍。MIC的降低程度高于GIBBONS等[16]首次报道的利血平存在时的MIC值;同时,SUN等[17]报道,携带氧氟沙星外排泵的耐药结核分枝杆菌在利血平存在时MIC下降2~32倍,该结果与本研究相近。此外,四环素与利血平配伍使用后,MIC值分别降低8和16倍的菌株分别占17.64%和43.14%。对于多西环素,添加利血平后MIC值下降相同倍数的菌株与四环素接近,分别为23.53%和31.37%。随后进行的Pearson相关性分析,计算得到P≤0.05,表明四环素类药物与利血平配伍使用,可有效降低细菌对该类药物的耐药性,tetK基因的携带,也将对细菌的耐药性产生一定影响。
A.四环素;B.西环素+利血平;C.多西环素;D.多西环素+利血平图5 51株MRSA 96孔板耐药试验

A.四环素作用于携带tetK基因的菌株;B.四环素作用于不携带tetK基因的菌株;C.多西环素作用于携带tetK基因的菌株;D.多西环素作用于不携带tetK基因的菌株图6 tetK基因携带情况(左)及对MIC值的影响分析(右)

图7 利血平添加与菌株耐药性的相关性分析
3 讨论
本研究从宁夏地区多个宠物医院就诊的动物分离鉴定出MRSA菌株51株,检测其耐药情况。结果显示,除了对青霉素类药物表现出较高耐药性外,四环素和多西环素的耐药率也高达78.43%和70.06%。众所周知,MRSA菌株携带有mecA基因,因此对β-内酰胺类药物具有较高的耐药性。而tetK基因编码形成的外排泵蛋白会摄取四环素并将其泵出细胞,增强MRSA菌株对四环素的耐药性,但对米诺环素没有明显的摄取能力[9]。这与耐药试验中四环素和多西环素的耐药情况高达70%以上,而对米诺环素表现为88.24%敏感,11.76%中介的结果相一致。在外排泵基因的检测中,发现tetK外排泵基因的携带率较为突出。外排泵基因的携带在一定程度上导致了本地区MRSA耐药性的增强。
外排泵存在于原核生物和真核生物中,其本质上是蛋白质[18]。外排泵镶嵌在细菌细胞膜上,扮演运输特定底物或一组结构相似的化合物的角色[19]。在二级结构中显示保守性氨基酸大多位于胞内和跨膜螺旋上,且在后续的对接结果中,出现在药物小分子5Å范围之内,推测这些氨基酸参与胞内药物识别摄取与药物外排的过程。在对蛋白通道进行构建后发现,形成蛋白通道的主要氨基酸为Asp、Asn、Glu、Gly、Pro等,其形成较为宽阔的外排通道入口,推测该种结构与药物的摄取和结合具有紧密联系;在药物外排中发挥重要作用,同时为进一步研究该蛋白与四环素类药物的识别、结合与外排奠定基础。在结构特征分析中发现,蛋白通道入口处存在一段α-螺旋-无规则卷曲,该部分在经过粗粒化动力学模拟后显示,该区域均方根波动(RMSF)较大,说明该部位结构柔性较高,外排蛋白与药物结合时将可能产生多种构象,最终药物在最优构象下结合进入外排通道。而对这一前庭部位进行位点突变预测后发现该区域均方根波动减小,结构柔性降低,可能会增大药物进入外排通道的空间位阻,对药物进入通道造成影响。
研究表明,对接位点主要包含Gly、Glu、Pro、Ser等[20-21]。分子对接发现,Gly、Ser可与药物形成氢键作用。分子内的Gly和Ser可对蛋白质结构产生强烈影响,尤其是在α-螺旋内,甘氨酸残基具有螺旋弹性并能实现紧密的螺旋-螺旋相互作用[22]。推测在这种作用下,蛋白拥有较强的结构柔性,较低的空间位阻,导致与药物有较强的结合活性,有利于药物的外排。此外,分子对接发现,Pro可与药物分子形成疏水作用。几乎所有转运蛋白在多个α-螺旋中都有嵌入膜的脯氨酸残基,这是转运蛋白的一般特征[23]。但是没有转运功能的蛋白质跨膜片段中却不存在脯氨酸残基。因此人们普遍认为脯氨酸残基在转运蛋白中起着重要的功能性作用[24]。脯氨酸残基由于其环结构引起的位阻而在α-螺旋结构中是不利的,它们的主链氮不可用于正常的氢键结合[25],导致螺旋弹性较大,结构柔性增强;因此,可能产生较多优势水解构象以便药物小分子被外排蛋白抓取并排出,最终引起耐药性增强。在对接过程中我们发现位于跨膜区的Glu30、Glu152、Glu397均可与药物进行作用,推断谷氨酸残基在对四环素的转运中也发挥着重要作用,这与FUJIHIRA等[21]的结果相一致。
据报道,四环素中4个环的完整线性排列是其发挥抗菌活性的首要条件,而C1-C4位的取代基又是抗菌活性的必要药效基团[26];C5-C9位的取代基为非活性必需基团,对其改造有助于克服核糖体保护机制和外排机制,进而提高药物敏感性[27]。多西环素是将四环素C6位上的羟基转移到C5位上,以此增大药物进入外排通道的空间位阻,获得比四环素更强的抗菌活性。分子对接发现,四环素与TetK蛋白的结合自由能(-36.40 kJ/mol)低于多西环素(-28.12 kJ/mol),并能以较多氢键、范德华力等多种作用与TetK蛋白结合,这一发现提示,四环素可能更易于被外排泵摄取并排出菌体,与药敏试验呈现出四环素较高的耐药率相一致。添加利血平后四环素类药物的敏感性增加,表明利血平不仅对氟喹诺酮类药物外排泵具有明显抑制活性,也能在一定程度上对四环素类药物外排泵发挥作用;这将为四环素类药物耐药性问题的解决提供有效参考。
