牛呼吸道病毒多重PCR检测方法的建立及应用
2021-12-23魏硕佟熊新雪马佳睿李瑞乾缪西鹏许立华
魏硕佟,谢 婧,熊新雪,马佳睿,李瑞乾,缪西鹏,许立华
(宁夏大学 农学院,宁夏 银川 750021)
牛呼吸道综合征(bovine respiratory disease complex,BRDC)是一种多因素传染病,在奶牛与肉牛中都较为常见。其特征是具有复杂的感染病原学[1-2],严重影响奶牛及肉牛的生产性能,也严重危害了养牛行业的健康发展。病毒感染是引起呼吸道疾病的重要因素,主要病原包括牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)、牛冠状病毒(bovine coronavirus,BCoV)、牛副流感病毒 3 型(bovine parainfluenza virus type 3,BPIV-3)等。在病原体感染、环境、运输等相关因素的相互作用下[3-4],BRDC极易给养殖业造成巨大的经济损失,因此,加强对其病原的快速检测具有重大意义。
BVDV为黄病毒科、瘟病毒属的有囊膜单股RNA病毒。BVDV在全球范围均有检出[5],在中国检出率可达53%[6]。IBRV为泛嗜性病毒,属于疱疹病毒科的有囊膜DNA病毒,可引起多种疾病,包括呼吸道疾病、生殖疾病、晚期流产以及牛的神经和全身疾病等,国内综合检出率约为40%[7]。BRSV属于副黏病毒科、肺病毒属,是有囊膜的单股负链RNA。BRSV在世界上广泛分布,包括美国、意大利、伊朗、巴西、厄瓜多尔等国家均有流行[8-12]。BCoV为冠状病毒科、冠状病毒属有囊膜的单股正链RNA病毒,大小为80~160 nm,是最大的RNA病毒之一,易造成成年奶牛冬季痢疾和犊牛呼吸道及胃肠道疾病[13]。BPIV3是不分节段的单股负链RNA病毒,有囊膜,属于副黏病毒科、呼吸道病毒属,可感染人、牛、水牛、羊等多种哺乳动物[14]。
多重PCR检测方法相较于传统检测方法具有可同时检测多种病原、操作简便、灵敏度高及经济便捷等优点。本试验建立检测牛呼吸道病毒包括BVDV、IBRV、BRSV、BCoV、BPIV3的多重PCR方法,并在宁夏地区规模化养殖场采集鼻拭子样品进行检测,以期为牛呼吸道病毒病的检测、流行病学调查及综合防控提供技术支撑。
1 材料与方法
1.1 试验材料BVDV、IBRV、BRSV、BCoV、BPIV3、BRoV、M.bovis、S.aureus阳性样品均由本实验室鉴定保存。2019年9月至2020年11月,自宁夏地区各规模化牛场采集疑似病牛的186份鼻拭子样品。
1.2 主要试剂和仪器设备病毒DNA/RNA提取试剂盒SE Viral DNA/RNA Kit、胶回收试剂盒Gel Extraction Kit和质粒小提试剂盒Plasmid Mini Kit均为OMEGA公司产品;PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit为TaKaRa公司产品;Taq DNA Polymerase、pEASY-Blunt Simple载体、Trans1-T1感受态均为全式金公司产品;DL1200 DNA Marker为天根公司产品;PCR仪为BIO-RAD公司产品。
1.3 引物设计利用Primer Premier 5.0软件, 根据NCBI中已公布的BVDV的5′UTR、IBRV的gB基因、BRSV的N基因、BCoV的N基因、BPIV3的HN基因保守区域分别设计引物。引物由生工生物工程(上海)股份有限公司合成,引物信息和目的片段预计扩增大小见表1。

表1 引物信息和目的片段预计扩增大小
1.4 核酸提取所有阳性样品和待检样品参照提取试剂盒提取病毒DNA/RNA,-20℃保存病毒DNA,-80℃保存病毒RNA。参照反转录试剂盒将病毒RNA进行反转录,获得cDNA后于-20℃保存。
1.5 重组质粒标准品的制备将获得的病毒DNA和cDNA作为模板,利用设计好的引物进行PCR扩增。PCR产物用1%琼脂糖凝胶电泳检测。参照胶回收试剂盒回收并纯化PCR产物,分别与pEASY-Blunt Simple载体连接,转化至Trans1-T1感受态,最终获得重组质粒并测序鉴定。将测序结果正确的重组质粒分别命名为pEASY-BVDV、pEASY-IBRV、pEASY-BRSV、pEASY-BCoV、pEASY-BPIV3,并测定质粒浓度,计算拷贝量。
1.6 多重PCR反应条件的优化对退火温度(53~65℃)、引物浓度(0.05 ~0.4 μmol/L)、Mg2+浓度(2 ~5 mmol/L)、酶浓度(1~3 U)等反应条件进行优化。
1.7 特异性试验用优化后的多重PCR检测方法对BVDV、IBRV、BRSV、BCoV、BPIV3、BRoV、M.bovis和S.aureus进行检测,并用ddH2O作为阴性对照,以验证检测方法的特异性。
1.8 敏感性试验将5种阳性重组质粒分别按梯度稀释(101~109拷贝/μL),并作为模板,以检测多重PCR方法的最低检测限。
1.9 重复性试验用优化后的多重PCR检测方法对阳性重组质粒进行重复性试验。
1.10 多重PCR检测方法的应用利用所建立的多重PCR检测方法对实验室采集的186份鼻拭子样品进行检测,并与单重PCR检测方法进行对照。
2 结果
2.1 多重PCR最佳退火温度的确定建立50 μL反应体系:Taq酶 1 μL,10×buffer 5 μL,2.5 mmol/L dNTPs 4 μL,模板各0.5 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O补足50 μL。反应条件:94℃ 5 min;94℃ 30 s,55℃ 45 s,72℃ 90 s,30个循环;72℃ 5 min。其中退火温度设定为53,53.8,55.4,57.7,60.6,63,64.3,65℃。结果显示,各退火温度均能扩增出目的条带(图1)。最终根据设计引物的T值,选取最佳退火温度为53.8℃。
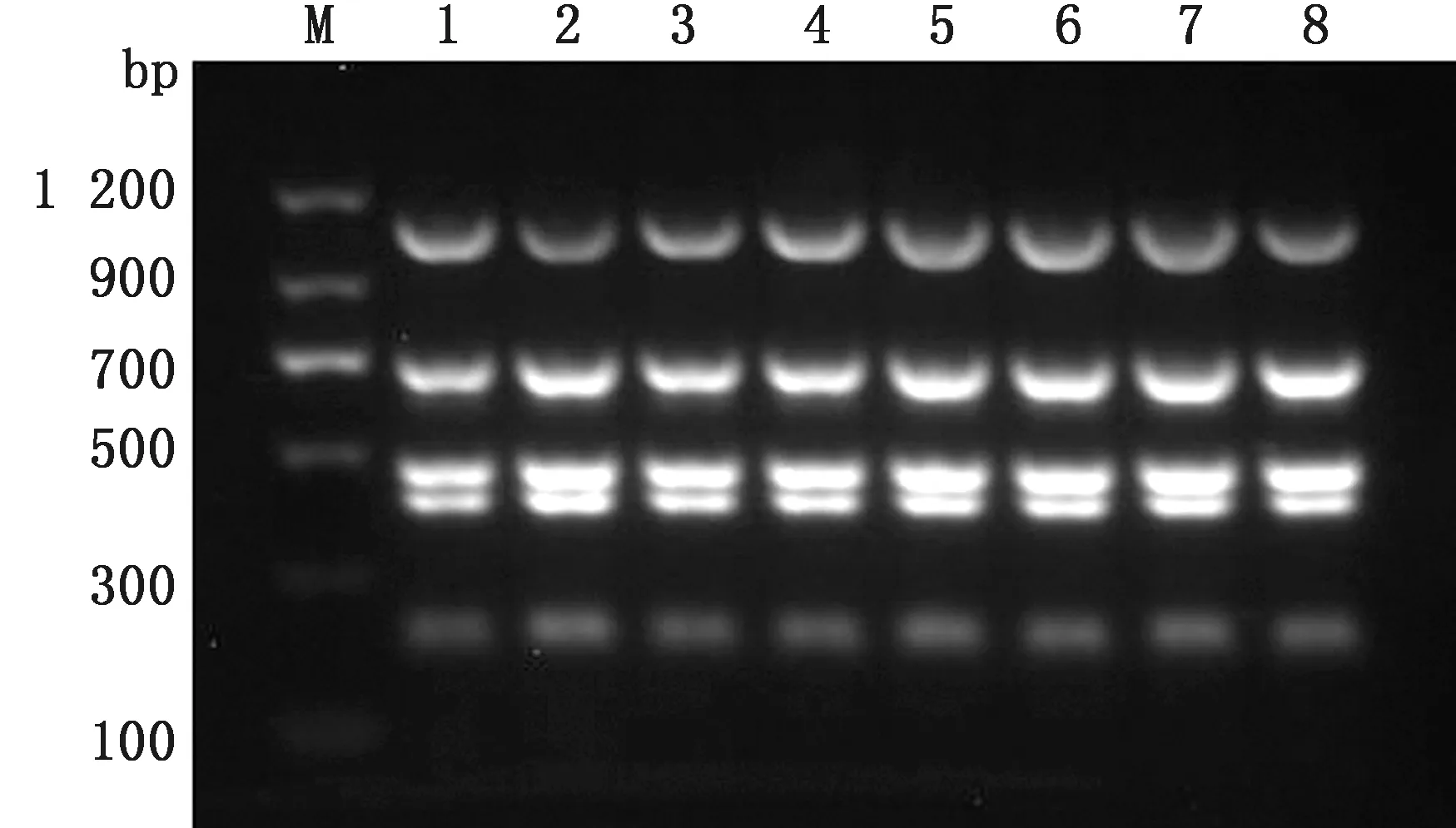
M.DL1200 DNA Marker;1~8.分别为退火温度由53~65℃每2℃依次递增的PCR产物图1 退火温度优化
2.2 多重PCR最佳引物浓度的确定将体系中各引物浓度由0.05 ~0.4 μmol/L每0.05 μmol/L依次递增,退火温度设定为53.8℃,其他条件不变,选取条带中最清晰且各引物用量最少的浓度,最终确定最佳引物浓度为0.2 μmol/L(图2)。

M.DL1200 DNA Marker;1~8.分别为引物终浓度由0.05~0.4 μmol/L每0.05 μmol/L依次递增的PCR产物图2 引物浓度优化
2.3 多重PCR最佳Mg2+浓度的确定将体系中Mg2+浓度由2~5 mmol/L每0.5 mmol/L依次递增,退火温度设定为53.8℃,引物用量为0.2 μmol/L,其他条件不变,选取条带中最清晰且Mg2+用量最少的浓度,最终确定最佳Mg2+浓度为2 mmol/L(图3)。

M.DL1200 DNA Marker;1~7.分别为Mg2+浓度由2~5 mmol/L每0.5 mmol/L依次递增的PCR产物图3 Mg2+浓度优化
2.4 多重PCR最佳酶浓度的确定将体系中酶浓度由1~3 U每0.25U依次递增,退火温度设定为53.8℃,引物用量为0.2 μmol/L,Mg2+浓度为2 mmol/L,其他条件不变,选取条带中最清晰且酶用量最少的浓度,最终确定最佳酶浓度为2.25U(图4)。

M.DL1200 DNA Marker;1~9.分别为酶浓度由1~3 U每0.25U依次递增的PCR产物图4 酶浓度优化
通过对退火温度、引物浓度、Mg2+浓度及酶浓度等条件的优化,最终确定最佳反应体系为:Taq酶 0.75 μL(终浓度为2.25 U),10×buffer 5 μL(Mg2+终浓度),2.5 mmol/L dNTPs 4 μL,模板各0.5 μL,上、下游引物各1 μL(终浓度为0.2 μmol/L),ddH2O补足50 μL。最佳反应条件:94℃ 5 min;94℃ 30 s,55℃ 45 s,72℃ 90 s,30个循环;72℃ 5 min。
2.5 特异性试验用优化后的多重PCR检测方法检测不同阳性样品。结果显示,仅BVDV、IBRV、BRSV、BCoV、BPIV3能扩增出特异性条带且与目标大小一致,其他病毒或细菌均未扩增出条带,表明该方法具有良好的特异性(图5)。

M.DL1200 DNA Marker;1~9.分别为BVDV、IBRV、BRSV、BCoV、BPIV3、BRoV、M.bovis、S.aureus的PCR产物;10.阴性对照图5 特异性试验
2.6 敏感性试验将重组质粒pEASY-BVDV、pEASY-IBRV、pEASY-BRSV、pEASY-BCoV、pEASY-BPIV3分别梯度稀释至101~109拷贝/μL,并作为多重PCR模板。结果显示,多重PCR方法对BVDV、IBRV、BRSV、BCoV、BPIV3的最低检测限分别为103,103,104,103,104拷贝/μL(图6)。

M.DL1200 DNA Marker;1~9.分别为模板浓度101 ~109 拷贝/μL的PCR产物;10.阴性对照图6 敏感性试验
2.7 重复性试验用建立的多重PCR检测方法对重组质粒模板进行检测,3次检测结果一致(图7)。表明该方法具有良好的重复性。

A~C.PCR扩增结果;M.DL1200 DNA Marker;1~6.分别为多重、BVDV、IBRV、BRSV、BCoV、BPIV3、BRoV的PCR产物;7.阴性对照图7 重复性试验
2.8 应用性试验用建立的多重PCR检测方法对186份鼻拭子样品进行检测,并与单重PCR检测结果进行对照,其中多重PCR检测结果表明,BVDV、IBRV、BRSV、BCoV、BPIV3阳性检出率分别为8.06%(15/186)、10.75%(20/186)、15.05%(28/186)、16.67%(31/186)、7.53%(14/186),并检出感染2种病原的样品4份(检出率为2.15%),感染3种病原的样品3份(检出率为1.61%),感染4种病原的样品6份(检出率为3.23%),感染5种病原的样品4份(检出率为2.15%),与单重PCR检测结果符合率为100%(表2),证明该方法能准确诊断牛呼吸道病毒混合感染。

表2 临床样品检测结果
3 讨论
BRDC病因复杂,与病原体感染、环境及饲养管理[15]等因素相互作用有关,因此,快速准确的诊断是防控BRDC的关键。多重检测方法相较于传统检测方法具有能同时检测多种病原、快速简便等优点,尤其适用于BRDC这类由于多种病原引起的疾病。国内外学者也建立了许多相关检测方法。PANSRI等[16]建立了一种多重qPCR试剂盒,可对5种引起牛呼吸道疾病的病毒同时进行检测和定量,可作为一种检测和定量相关病原体的新工具。THANTHRIGE-DON等[17]将基因芯片和多重PCR反应结合,建立了一种多重PCR-电子微阵列分析方法,能够检测和区分BRDC相关的4种细菌(溶血曼海姆菌、组织希氏菌、多杀性巴氏杆菌和牛支原体)和5种病毒(BVDV、IBRV、BRSV、BPIV3和BCoV),是单一样品中检测和区分多种病原体的有力工具。
本试验建立的多重PCR检测方法对BVDV、IBRV、BRSV、BCoV、BPIV3的最低检测限分别为103,103,104,103,104拷贝/μL,具有良好的敏感性。该方法能从临床样品中检测出5种病毒,与单重PCR检测结果一直,表明该方法可用于临床中的诊断。同时,对于2~5种病原混合感染检出率分别为2.15%,1.61%,3.23%,2.15%,表明宁夏地区牛群中存在多种病原混合感染情况。
本试验通过优化退火温度、引物浓度、Mg2+浓度、酶浓度等反应条件,建立了一种同时检测BVDV、IBRV、BRSV、BCoV、BPIV3 这5种牛呼吸道病毒的多重PCR检测方法。该方法具有灵敏度高、特异性强、重复性好等特点,可以成功从采集的疑似感染牛鼻拭子中检测到5种病原,为牛呼吸道病毒的单一诊断及混合感染诊断提供技术支持,也为相关流行病学研究提供参考。
