检测鸡传染性支气管炎病毒GVI-1基因型毒株的实时荧光定量PCR方法建立
2021-12-23陈淑琴杜旭彬张成成郭梦娇吴艳涛张小荣
陈淑琴,杜旭彬,鄢 坤,廖 凯,张成成,郭梦娇,吴艳涛,张小荣
(扬州大学 兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
传染性支气管炎(infectious bronchitis,IB)是鸡的一种急性、病毒性疾病,主要侵害呼吸和泌尿生殖系统。该病在世界范围内广泛流行,给养鸡业带来了严重的经济损失[1]。传染性支气管炎病毒(infectious bronchitis virus,IBV)属于冠状病毒科冠状病毒属中的γ冠状病毒,极易发生遗传变异,导致新的基因型和血清型不断出现,使得病毒检测和免疫预防日益复杂化[2-3]。
2016年,VALASTRO等[4]基于对全球不同地区报道的1 518个IBV分离株S1基因序列系统发育分析的结果,提出了一种统一的IBV基因分型系统,将目前已知的IBV毒株分为6个基因型(GI~GVI)和32个进化谱系,其中GI基因型包括GI-1~GI-27等27个谱系,而GII~GVI每个基因型均只有1个谱系。研究表明,我国IBV流行情况较为复杂,且不同时期流行的优势基因型存在较大的差异,如GI-19型(也称QX型)即为当前流行的最优势的基因型(约占70%),此外还存在GI-7型(也称TWI型)和GVI-1(也称TC07-2型)等其他一些常见基因型[5]。其中GVI-1基因型(又称TC07-2型)IBV是最新出现的1种基因型,于2007年在广东首次分离鉴定,随后在亚洲其他一些国家相继出现[6-7]。流行病学监测结果显示近年来GVI-1基因型IBV毒株分离率呈持续上升趋势,尤其在我国南方地区的流行更为普遍,应当引起足够重视[8-9]。目前对分离株进行基因分型需要首先克隆S1基因并进行测序,然后通过基因序列比对和遗传进化分析确定对应的基因型,操作繁琐且周期较长。本研究的目的是建立1种可特异性检测GVI-1基因型IBV的实时荧光定量PCR(qPCR)检测方法,为GVI-1基因型IBV流行病学监测和临床分离株的快速分型提供有效的工具。
1 材料与方法
1.1 毒株本研究所用GI-1、GI-7、GI-13、GI-19、GI-28和GVI-1等不同基因型IBV分离株和疫苗株,具体信息见表1。其中分离株CK/CH/JX/2018/1株和CK/CH/AH/2011/3株由扬州大学农业部畜禽传染病学重点开放实验室保存[10];QXL87疫苗株由扬州大学农业部畜禽传染病学重点开放实验室研制、保藏和提供[11];H120株、Ma5株、LDT3-A株和4/91株均为从商品化疫苗中分离获得。

表1 不同基因型IBV毒株信息
1.2 试剂超纯RNA提取试剂盒购自江苏康为世纪生物科技有限公司;AxyPrep DNA凝胶回收试剂盒及AxyPrep质粒DNA小量提取试剂盒均购自康宁生命科学(吴江)有限公司;pEASY®-T3克隆载体质粒、Trans1-T1感受态细胞、反转录试剂盒、EasyTaq®DNA Polymerase、琼脂糖等均购自北京全式金生物技术有限公司;AceQ qPCR Probe Master Mix购自南京诺唯赞生物科技股份有限公司。
1.3 引物探针的设计与合成从GenBank中下载目前在中国流行的IBV主要基因型代表毒株和疫苗毒株S1基因序列,采用Lasergene 7.0软件包中的Megalign软件对其S1基因序列进行比对分析,选取在不同基因型间序列差异较大且在基因型内不同毒株间较为保守的区域进行引物和探针的设计,并通过在线Blast程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)验证其特异性。为分析建立的检测方法对GVI-1基因型IBV毒株的通用性,将从GenBank中下载已发表的GVI-1基因型IBV毒株基因序列与本研究设计的引物探针通过SnapGene软件进行序列比对,毒株信息见表2。引物和探针委托南京金斯瑞生物科技公司合成。
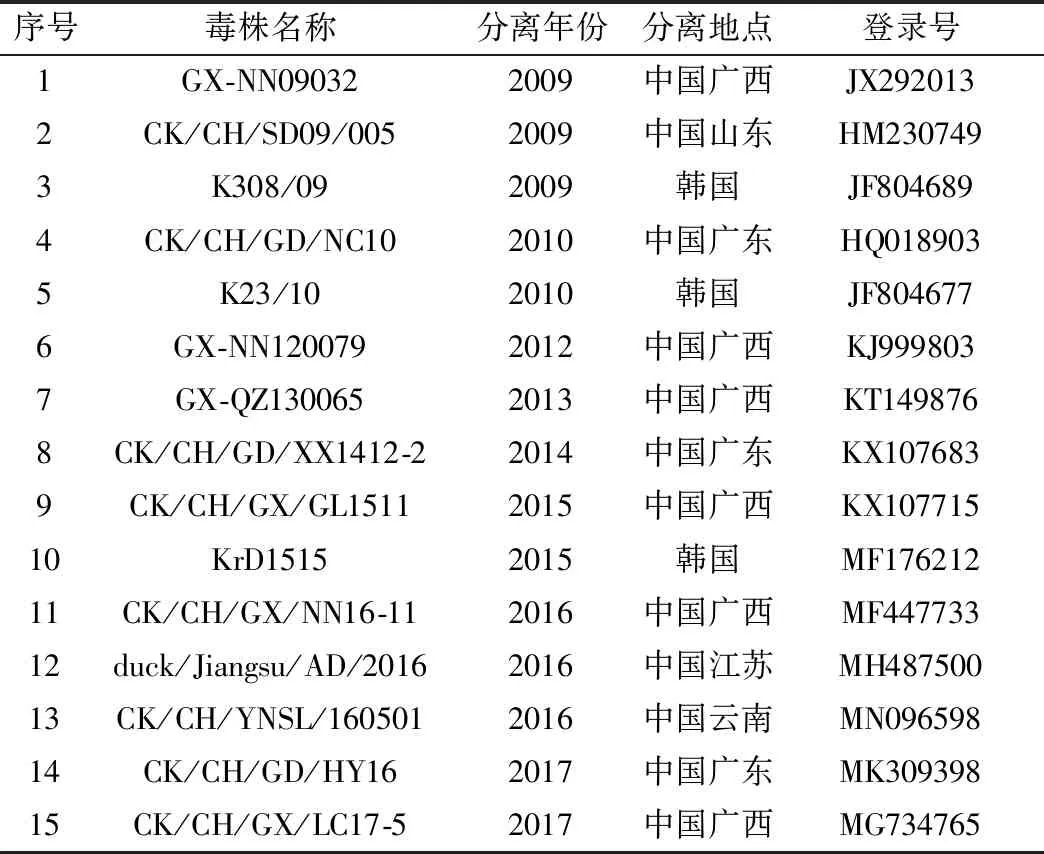
表2 GVI-1基因型IBV毒株信息
1.4 质粒标准品的制备使用超纯RNA提取试剂盒提取GVI-1基因型IBV JX-2018-1株的尿囊液总RNA,并参照TransScript®Reverse Transcriptase [M-MLV,RNaseH-]操作步骤将其反转录为cDNA。对获得的cDNA用设计的上、下游引物进行PCR扩增,产物经琼脂糖凝胶电泳鉴定后胶回收目的片段,克隆到pEasy®-T3载体后将PCR鉴定为阳性的重组质粒送至通用生物系统(安徽)有限公司测序。测序正确的菌液提质粒,用紫外分光光度计进行质粒浓度测定,并根据公式N=(C×10-9)/(M×660)×6.02×1023(C为质粒浓度,M为构建质粒的碱基数)计算质粒拷贝数[12]。
1.5 标准曲线的建立将质粒标准品10倍梯度稀释为1.0×101~ 1.0×1010拷贝/μL,每个稀释度分别取2 μL作为qPCR的模板进行扩增。反应体系为20 μL,包括以下组分:0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)、0.2 μL荧光探针(10 μmol/L)、10 μL 2×qPCR Probe Master Mix、2 μL cDNA模板和7 μL ddH2O。反应条件为95℃ 5 min;95℃ 10 s、60℃ 30 s,40个循环。由仪器自动生成标准曲线及扩增方程式。
1.6 敏感性试验将10倍梯度稀释的质粒标准品分别进行qPCR检测,并以无菌水作阴性对照,以确定该方法可检测到的最低拷贝数,同时用与qPCR试验一致的上、下游引物进行普通PCR扩增,比较2种方法的敏感性差异。
1.7 特异性试验分别从含有JX/2018/1、AH/2011/3、QXL87、H120、Ma5、LDT3-A和4/91株的鸡胚尿囊液中提取病毒总RNA,反转录获得cDNA模板后进行qPCR反应,每个样品做3个重复,以验证该检测方法的特异性。
1.8 重复性试验取浓度为1.0×105~1.0×107拷贝/μL的3个梯度的标准质粒为模板,通过qPCR方法进行组内重复试验,每个梯度设3个重复;将3个梯度的标准质粒分成3个批次,在相同反应条件下做3次独立反应。计算Ct值的平均值和变异系数(CV),分析试验的可重复性。
1.9 样品检测将本实验室采集的60份JX/2018/1毒株人工感染雏鸡的咽拭子和30份SPF鸡咽拭子提取RNA,经反转录获得cDNA模板后分别通过本研究建立的qPCR方法和常规PCR方法进行检测,比较2种方法的检测结果。
2 结果
2.1 引物和探针的设计根据S1基因序列比对分析结果设计的引物、探针及其结合位置如图1和表3所示,探针5′端标记荧光报告基团为FAM,3′端标记荧光淬灭基团为MGB。序列比对结果显示,探针引物可与所有GVI-1基因型IBV毒株基因序列特异性结合,说明建立的检测方法适用于该型病毒的鉴别检测。

表3 本研究所用探针及引物

图1 不同基因型IBV毒株S1基因比对结果和引物、探针结合位置
2.2 质粒标准品的制备以GVI-1基因型IBV JX/2018/1株基因组cDNA为模板进行PCR扩增,琼脂糖凝胶电泳图显示,扩增产物约为91 bp,与预期结果相符(图2)。将扩增的目的片段克隆到pEASY®-T3载体后测序结果与GenBank中GVI-1基因型IBV S1基因相应片段的碱基序列完全一致。用紫外分光光度计对抽提的质粒进行浓度测定,配制终浓度为1.0×1010拷贝/μL的质粒备用。

M.DL500 DNA Marker;1.PCR扩增产物;2.阴性对照图2 目的基因片段PCR扩增结果
2.3 荧光定量PCR标准曲线的建立将质粒标准品10倍梯度稀释为1.0×101~ 1.0×1010拷贝/μL,分别取每个稀释度的标准质粒为模板进行qPCR扩增,反应结束后系统自动生成标准曲线如图3所示。方程为y=-3.42x+37.36,相关系数(R2)为0.999。

图3 实时荧光定量PCR标准曲线
2.4 敏感性试验qPCR结果显示,该方法最低检测限可达1.0×101拷贝/μL,在1.0×101~1.0×1010拷贝/μL范围内可得到良好的动力学曲线(图4),而常规PCR检测极限为1.0×103拷贝/μL(图5)。表明本研究建立的qPCR方法比普通PCR方法敏感性提高了约100倍。

1010~101.质粒标准品浓度分别为1.0×101 ~1.0×1010 拷贝/μL图4 实时荧光定量PCR敏感性试验扩增曲线

M.DL500 DNA Marker;1~10.1.0×101 ~1.0×1010拷贝/μL质粒模板图5 普通PCR敏感性试验
2.5 特异性试验提取不同基因型IBV毒株鸡胚尿囊液中的RNA,以其反转录获得的cDNA为模板进行qPCR。结果显示,仅GVI-1基因型IBV毒株出现特异性扩增曲线,而阴性对照和其他基因型毒株未出现扩增信号(图6)。
2.6 重复性试验重复性试验结果(表4)显示,该qPCR检测方法组内重复性试验的CV为1.06%~2.44%,组间重复性试验的CV为0.45%~2.29%,均小于2.5%,说明该方法具有良好的重复性与稳定性。
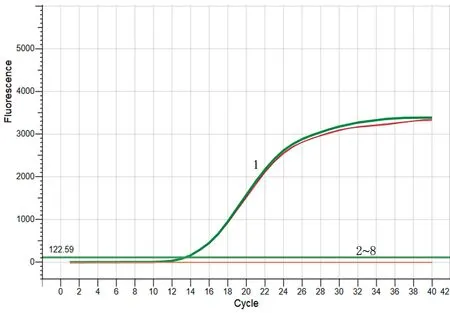
1.GVI-1基因型IBV毒株;2~8.分别为阴性对照和其他基因型毒株图6 实时荧光定量PCR特异性试验扩增曲线

表4 重复性试验结果
2.7 样品检测利用建立的qPCR方法对采集的60份JX/2018/1毒株人工感染雏鸡的口腔和泄殖腔棉拭子进行检测,同时与常规PCR方法的检测结果进行比较,结果显示,对30份采集自SPF鸡的咽拭子样品两种方法检测均为阴性;在60份采集自攻毒鸡的咽拭子样品中,qPCR方法检测出56份阳性,阳性检出率为93.3%,常规PCR检测出45份阳性,阳性检出率为75%,两者的符合率为96.7%。
3 讨论
我国IB发病情况复杂,目前常用的IBV检测方法包括病毒的分离与鉴定、血清学和分子生物学等检测方法[13],但这些方法普遍无法区分不同基因型IBV的感染。基因分型是IBV毒株最常用的分类方法,确定野毒株的基因型对IBV的流行病学监测至关重要,同时可以为选择合适的疫苗提供信息。IBV基因型的鉴定通常依赖于S1基因的系统发育分析,但该方法耗时长且工作量大,无法满足快速分型的需求;而qPCR技术敏感度高,特异性强、反应迅速,并能够进行定量分析,目前已应用于GI-1、GI-9、GI-11和GI-16等基因型IBV的鉴别检测[14-15]。
本研究采用TaqMan MGB荧光探针法,选取在不同基因型毒株间S1基因序列差异较大的区域设计特异性引物和探针,建立GVI-1基因型IBV实时荧光定量PCR检测方法。敏感性试验结果表明,所建立的检测方法对质粒标准品的检测下限可达1.0×101拷贝/μL,灵敏度高于普通PCR方法100倍。特异性试验结果表明,该方法能够特异性检测出GVI-1基因型IBV毒株,并且不与GI-1、GI-7、GI-13、GI-19和GI-28等其他基因型毒株和疫苗株发生交叉反应,对GVI-1基因型IBV临床分离株的快速筛查具有重要意义。重复性试验结果显示,该方法组内和组间重复试验的CV均小于2.5%,稳定性良好。以本研究建立的荧光定量PCR方法和常规PCR方法对人工感染雏鸡的口腔和泄殖腔棉拭子进行检测,结果显示,2种方法的符合率高达96.7%,且qPCR敏感性更高,同时可缩短检测时间、提高检测效率。本研究建立的GVI-1基因型IBV实时荧光定量PCR检测方法对GVI-1基因型IBV的监测以及病毒早期感染的诊断分析方面提供了可靠的技术手段。
