植物促生菌群体感应系统对根际环境胁迫响应机制的研究进展*
2021-12-23易盛炜
易盛炜, 李 峰
(湘潭大学 环境与资源学院,湖南 湘潭 411105)
0 引言
近年来,随着全球气候变化的加剧,干旱、洪涝、沙尘暴、高低温极端天气等自然灾害频发,直接迅速地冲击农业领域,造成世界众多国家和地区的粮食生产、粮食供应、粮食安全受到不同程度的影响.我国是全球第一产粮大国、第一粮食消费大国,用占世界7%的耕地养活着世界22%的人口,确保国家粮食安全对维护世界粮食安全具有重要意义.目前我国正努力实现从“吃得饱”向“吃得好”转变,因此保证水稻、小麦和玉米等主要粮食作物的安全生产显得极为迫切.然而我国耕地土壤重金属污染严重,点位超标率达19.4%,以镉为首的重金属污染频致“镉大米”等粮食安全事件的发生,对我国粮食安全造成了巨大危害[1].
为使耕地达到安全利用,我国急需发展绿色高效的耕地修复技术控制重金属污染,以此保障我国的粮食安全.然而,我国多数耕地土壤重金属污染以轻微污染为主,占比为13.7%,采用物理修复(客土、深耕)、化学修复(钝化剂、调整pH值)等修复技术因成本高或造成潜在污染等原因难以大面积推广使用[2-3],而土壤微生物-植物联合修复的原位修复技术因其廉价安全有效,有望用于轻微污染耕地的修复[4].植物根际是根系和微生物之间代谢活动和信息交流极为重要的区域,引起了国内外学者的广泛关注,特别是植物促生菌(Plant Growth-Promoting Rhizobacteria,PGPR)在植物根际定殖后对植物-微生物修复效率的影响及信号调控作用的研究[5-7].群体感应(Quorum Sensing,QS)系统是根际环境中植物根系-微生物间信息交流的重要方式之一,也是微生物种内、种间信息传递的有效机制[8].通常荧光假单胞菌、芽孢杆菌等PGPR的QS系统调控机制能直接或间接促进植物的生长,提高抵御病害的能力,但由于复杂的根际土壤环境因子对该系统产生不可忽视的影响,导致PGPR的有益影响在田间难以重现,而且国内外对该根际环境的信号传递研究仍处于起步阶段[9-10],认识环境因素中非生物/生物胁迫对QS系统的影响是提高PGPR利用水平和可靠性的关键.为此,本文着重论述了土壤根际环境胁迫下PGPR的QS系统的响应与调控机制,即了解QS系统的信号传导在调控根际细菌PGPR功能、保持植物根系活性和土壤污染物消减之间的作用,以期为发展基于PGPR群体感应促进微生物-植物联合修复土壤污染的效果提供新的理论认识,实现中低污染农田的安全利用.
1 植物促生菌群体感应系统概述
QS系统调控主要通过种群密度影响基因的表达.随着PGPR种群密度逐渐增大,分泌的自诱导信号分子(Autoinducer,AI)在外膜或细胞质中积累达到阈值,然后AI与受体蛋白结合,作为转录调节因子启动特定基因的表达,以实现某些重要的生理功能或保持协调一致的生理行为.这些功能及行为包括生物发光[11]、毒力因子分泌[12]、生物膜形成[13]、基因水平转移[14]、铁载体形成[15]、质粒接合转移[16]、抗生素产生[17]、孢子产生[18]等.这些行为对于微生物提高细菌群体摄取营养、抵御外敌,提升其环境适应性起着至关重要的作用.尤其近年来,随着微生物-植物跨界QS系统逐渐发现,发现PGPR与根际植物系统信号调控过程密切相关,这对于探索根际微生物-植物间精细互作机制提供了新的途径.
1.1 种内群体感应系统
N-酰基-高丝氨酸内酯(N-acylated-homoserine lactones,AHLs)是革兰氏阴性菌QS系统中常见的信号分子.AHLs以保守的高丝氨酸内酯环为核心,连接一个C4-C18(多为偶数)的酰基侧链,侧链第三个碳上的氢经常被羟基或氧取代,并存在双键改变[19],结构如图1所示.亲水性的高丝氨酸内酯及疏水性的脂肪酸侧链使得AHLs分子具有水溶性、膜透过性,可以自由进出细胞,以便进行信号的传递[20].AHLs的合成及作用过程主要由LuxI/LuxR型系统调控,其类似的系统有LasI/LasR、RhlI/RhlR及PcoI/PcoR[21]等,模型如图2所示.LuxR蛋白是细胞质内自诱导物感受因子,同时也是一种激活DNA结合转录的元件,负责特异性结合AHLs,AHLs-LuxR复合物与下游的靶基因启动子相结合,从而激活下游基因的转录翻译过程[22].
寡肽类(Auto-inducing peptides,AIPs)物质主要被革兰氏阳性菌作为信号分子,AIPs是由双组分磷酸激酶蛋白经过修饰产生的,其化学结构有小寡肽、环内酯/硫内酯肽、类细菌肽等多种类型,氨基酸数量多数为5~17个.寡肽类QS信号分子结合的受体可以分为三大类:天冬氨酰磷酸酶(Rap)、中性蛋白酶调控因子及其同源物(NprR)、磷脂酶调控因子(PlcR),根据调控下游基因方式及信号分子受体的不同,可以将芽孢杆菌中利用寡肽信号分子的QS系统分为PlcR-PapR、Rap-Phr及NprR-NprX三大类[23].除了小寡肽以完整形式内在化进入细胞质并直接或间接调节基因表达外,大多数AIPs信号是通过两组分调节系统传输的,该系统由整合到膜中的组氨酸激酶受体和控制靶基因表达的胞质应答调节剂组成[24].各QS系统之间还存在等级、平行及竞争型等调控方式,共同构成了复杂的群体感应调控网络[25].
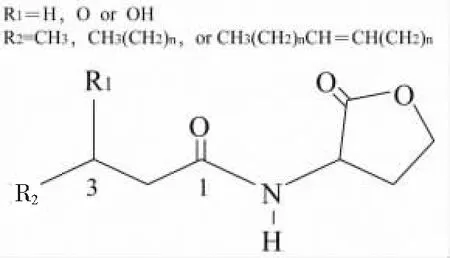
图1 AHLs信号分子结构[19]Fig.1 Chemical structure of AHLs signaling molecules
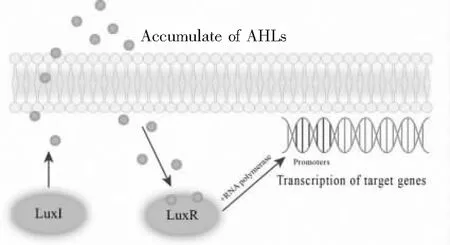
图2 LuxI/R系统调控图Fig.2 LuxI/R system regulation diagram
1.2 种间群体感应系统
根际微生物群落的多样性决定了微生物种间必然存在信息传递,呋喃硼酸酯类(Autoinducer-2,AI-2)被认为是微生物种间通信的通用信号分子,AI-2信号分子合成主要依赖于LuxS编码的LuxS蛋白酶,因此LuxS被认为是AI-2信号分子合成的标志性基因[26].基于luxS/AI-2的同源基因可以在数百种微生物中找到,并且若干具有luxS同源基因的其他种类细菌可以诱导指示菌哈维氏弧菌产生荧光[27].目前促生菌AI-2信号分子调控参与生物被膜形成并加强植物定殖成为了研究的热点[28].
1.3 群体感应系统的跨界通信
群体感应系统不仅被微生物用于种内种间通信,同时也能通过跨界通信调控植物行为变化.目前研究最深入的AHLs信号分子被证明能影响植物的根系发育、诱导植物防御、应激反应、激素平衡和代谢调节[29-30].不同酰基链长度的AHLs对植物的影响不同,短酰基链(C4-C6)主要促进植物主根伸长,酰基链(C10)促进侧根生长并使根尖区附近根毛增多,主要由信号分子调控植物生长激素、分生区的细胞分裂实现上述过程.AHLs酰基链越长,对植物的促生作用越小[31].长酰基链(C12-C16)则主要诱导植物对病原菌的系统抗性,酰基链(C4-C10)还能诱导产生超氧化物歧化酶和脱氢抗坏血酸还原酶等抗氧化酶[32].外加C6-HSL能促进冬小麦的生长并显著提高产量,减少对杀菌剂和化肥的依赖以对抗病原体的胁迫,初步证明AHLs类信号分子能影响谷物的萌发、植株发育和产量[33].植物自身也会释放类似AHLs信号模拟物如迷迭香酸、核黄素衍生物等,或者降解AHLs的酶以适应多变的根际环境,迷迭香酸、核黄素衍生物能分别刺激铜绿假单胞菌RhlR、LuxR依赖的转录,刺激生物膜的形成以及绿脓素的产生[34].铜绿假单胞菌产生的扩散性信号分子(DSF)及二酮哌嗪类化合物(DKPs)调控植物水杨酸、脱落酸和生长素的分泌基因表达,DSF调控若干致病因子,同时诱发植物的先天免疫[35].另外,真核生物也可感知和响应细菌QS信号分子,在AHLs作用下微藻产生芳香蛋白来刺激自身叶绿素聚集[36].尽管目前已知细菌QS信号分子广泛存在于根际并对植物生长产生调控作用,但暂不知AHLs是在被病原菌侵染的植物组织局部上发挥作用,还是在根部感知后被吸收并转移到茎叶上系统地起作用,即AHLs在植物间的信号传输通路未来还需进一步研究[37].
2 植物促生菌的促生机制
PGPR作为对植物生长有益的一类细菌,在有机质分解、土壤结构稳定、固氮解磷和调节作物生长等过程中发挥着重要的作用,其菌剂作为农药、化肥的替代品具有广阔的应用前景.植物根系分泌物如酶、初级代谢物(有机酸、碳水化合物)及次级代谢物(生物碱、酚类物质)等作为微生物食物来源,大量微生物附着在根系表皮细胞连接处、根毛和新生侧根等根系表面并形成微菌落而定殖[38].目前,少数细菌(1%~2%)具有植物促生作用,芽孢杆菌属和假单胞菌属在植物促生菌中占主导地位[39].
PGPR对植物的促生机制主要分为三种:(1) PGPR分泌的表面活性剂、离子转运蛋白及有机酸等物质能够增强植物的环境适应能力, 提高土壤中氮磷等营养元素的生物利用度,并促进根部对重金属离子的吸收、积累或固定;(2) PGPR产生抗生素、诱导系统抗病性、分泌细胞酵素及与病原物竞争寄主植物上的定殖位点等来拮抗病原菌及抑制植物病原菌的生长[40];(3) PGPR可增强植物抵抗外界不良环境的非生物胁迫.如在盐胁迫下,PGPR接种于植物根系后能降低环境中脯氨酸和丙二醛的水平,提高超氧化物歧化酶、过氧化氢酶和过氧化物酶等抗氧化酶的活性[41],并通过引起植物激素分泌维持有毒离子的稳态,改善植物的营养,从而提高植物的耐盐碱能力[42].植物促生菌对植物的促生作用及主要信号分子的生成见表1.
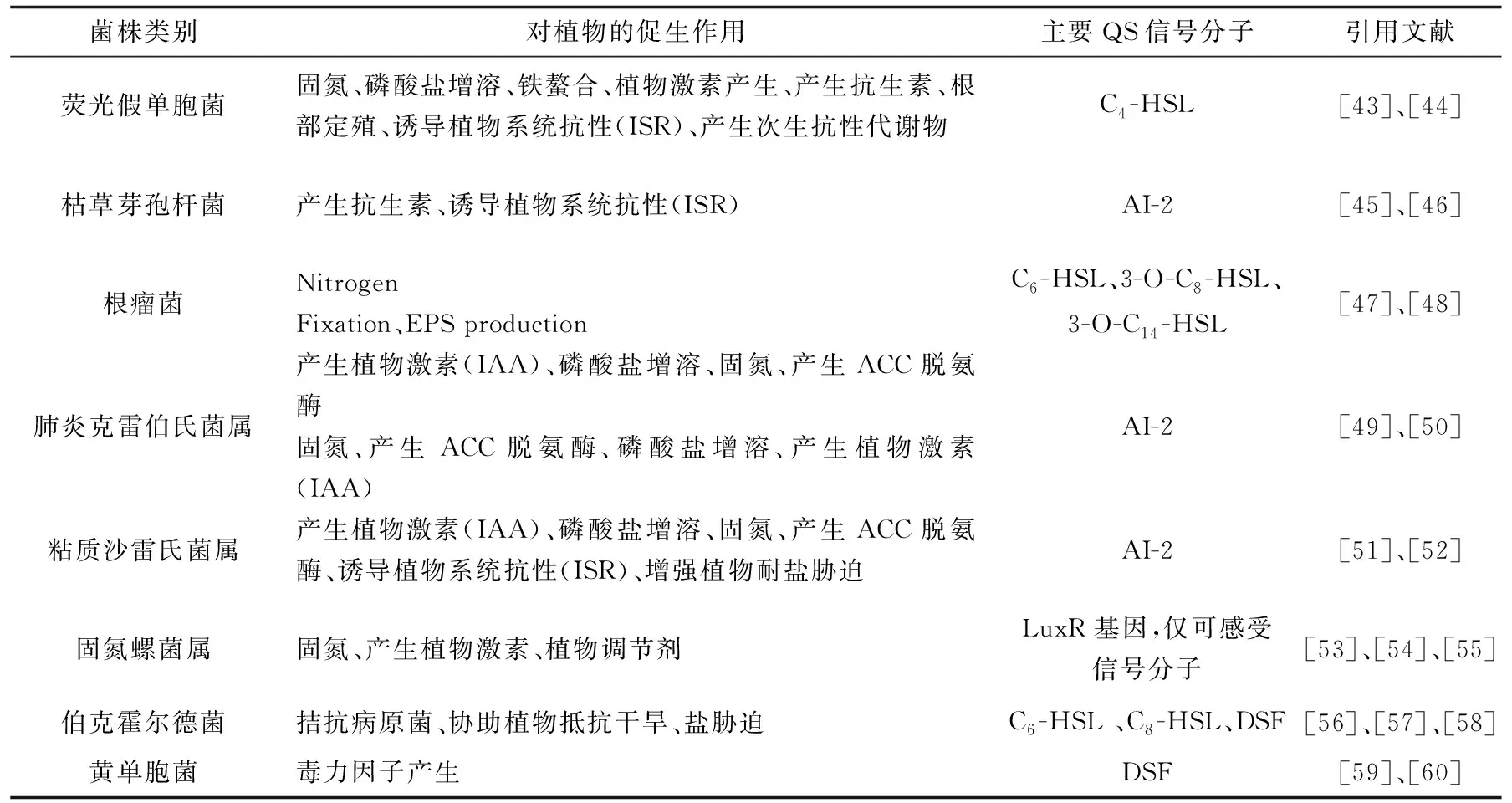
表1 植物促生菌的作用及主要信号分子的生成
3 植物促生菌群体感应系统对根际环境胁迫的响应
植物促生菌QS系统是微生物-植物沟通交流的桥梁,并高效地促进植物的生长及抵御根际不良环境.QS系统运行中往往受外界多因素环境胁迫,包括缺氧、盐碱、酸铝、重金属/有机物污染、生物炭等非生物胁迫及病原菌等生物胁迫,分析QS系统对这些因素的响应及调控机制,有助于理解QS系统在植物促生菌-植物间互作和土壤污染物消减过程中的作用.植物促生菌QS系统与植物根际互作的关系如图3所示.
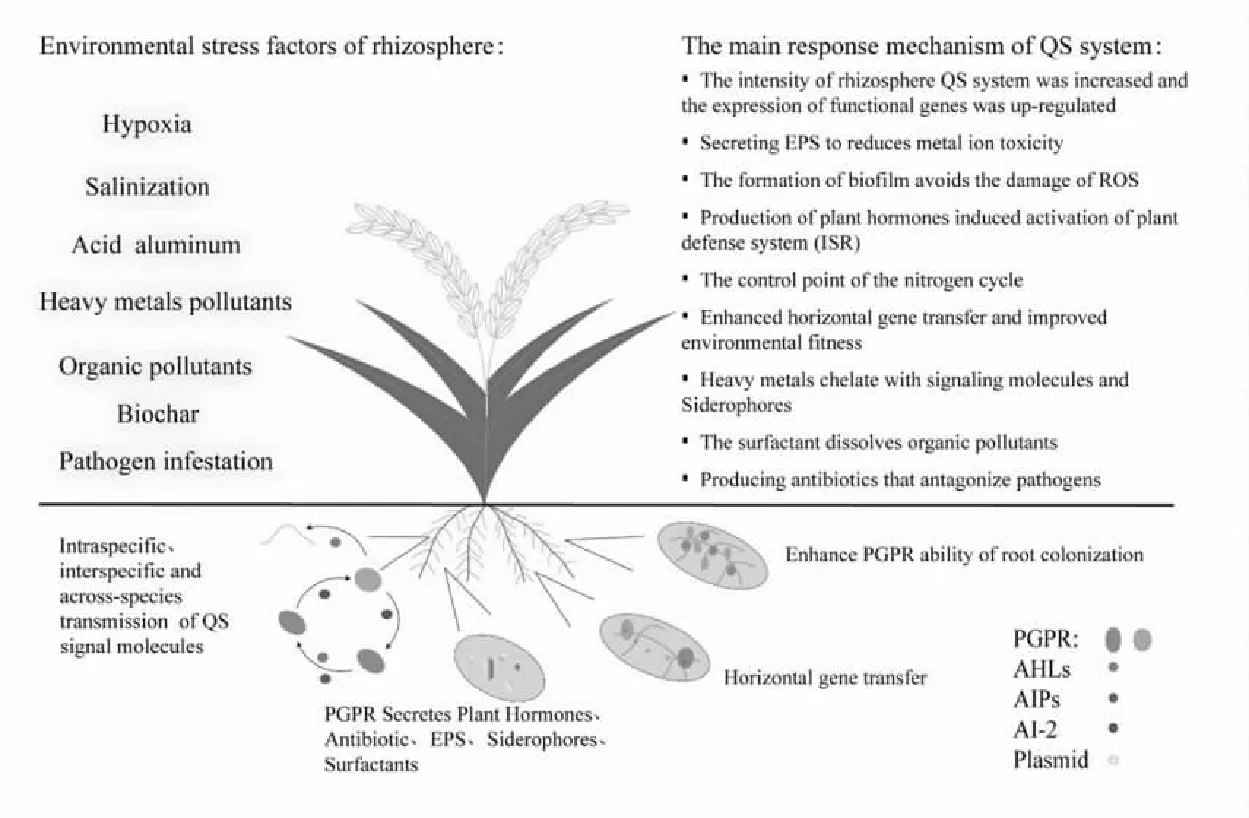
图3 植物促生菌QS系统与植物根际作用关系图Fig.3 Relationship between QS system and rhizosphere of plants
3.1 根际土壤非生物胁迫
3.1.1 缺氧环境氧气(O2)作为最有效的呼吸链末端电子受体,为微生物生命活动提供能量,不同的O2供给水平导致PGPR生理活动及其代谢产物种类产生变化.由于根部周围生物对土壤中O2的过度消耗或者O2供给不足导致根际PGPR常介于好氧与厌氧之间的缺氧区域.
目前研究大多关注缺氧条件下PGPR功能基因的表达差异.研究发现缺氧环境下脂单胞菌及根瘤菌等代表性菌株的AHLs合成酶基因NovI、EnsI1及EnsI2的表达显著性上调,且质粒上的AHLs合成酶基因响应缺氧环境比染色体上的更加敏感[61].缺氧条件下QS系统会调控许多下游基因的表达,如假单胞菌趋化性甲基转移酶基因、乙酰辅酶A合成酶基因、周质硝酸盐还原酶蛋白NapE及氰化氢合成酶HcaABC等124个基因在缺氧实验条件下表现出了显著差异性[62-63].脱氮副球菌也能通过QS系统调控反硝化过程中亚硝酸还原酶、一氧化氮还原酶以及氧化亚氮还原酶的活性,最终影响亚硝酸向一氧化氮到氧化亚氮还原释放过程,初步证明AHLs信号分子在缺氧环境中能对氮循环微生物产生调控作用[64].为了避免氧自由基和活性氧导致氧化应激损伤细胞,PGPR通过AHLs介导的生物膜形成基因的高水平表达,形成生物膜及胞外聚合物等阻止氧自由基进入细胞,在过氧化氢酶和铁氧化酶作用下降解,以保证菌群的核心代谢基因丰度的稳定[65].
可见,细菌QS系统对土壤环境的供氧量变化的响应调控有着重要影响,缺氧胁迫能提高群体感应强度,促使根际植物促生菌代谢加剧、根际定殖能力增强,从根部获取更多的营养物质,弥补氧气供应不足带来的能量损失,进而维持正常的生命过程.
3.1.2 盐碱及酸铝环境我国西北地区耕地土壤盐碱化是限制当地农业生产的一个重要因素,其中高渗透压条件、离子毒性(Na+和Cl-)及高水平的乙烯量是限制作物产量的主要非生物胁迫.PGPR通过调节植物激素状态、基因表达、蛋白质功能和代谢物合成来调节渗透平衡和离子稳态.QS系统调控产生的吲哚乙酸(IAA)和胞外分泌物(EPS)引起应激反应通路,IAA能降低植物乙烯的水平增强抗逆性,而EPS通常形成一个封闭的基质微菌落提供水分和营养,保护促生菌免受环境波动[66].在盐(NaCl)胁迫下,嗜麦芽寡养单胞菌接种于小麦根部后能显著降低芽、根中Na+的积累并增加对K+的吸收,同时增强超氧化物歧化酶等抗氧化酶及苯丙氨酸解氨酶等防御酶的活性[67].环境DNA(eDNA)是EPS的共同组成部分,假单胞菌的AHLs和喹诺酮信号(PQS)等QS分子调控细胞裂解因子,诱导细胞裂解使eDNA释放,微生物在恶劣条件下细胞对eDNA的摄取增加,以增强群落的基因组适应性[68].盐碱地常伴随着高温干旱,荧光假单胞菌一般在高于37℃时活菌含量急速下降,研究表明氧化胁迫使荧光假单胞菌SN15-2的150种蛋白质差异性表达,提高了一系列抗氧化物质及甜菜碱和海藻糖等蛋白保护剂含量,可使菌体免受高温损伤,另外,菌体的生防能力也免受高温的影响[69-70].证明QS系统介导产生的IAA及EPS通过诱导植物抗性及提高PGPR胁迫耐受性,进一步稳定QS系统操纵信号通路和调节功能,从而对植物的防御和发育产生积极的影响.
我国南方地区酸雨常导致耕地呈现弱酸性,酸性土壤使矿物质中铝离子渗出即形成酸铝胁迫,一般植物根尖及其微生物在酸铝胁迫下会在几小时内死亡.研究发现投加Ca2+、P能显著增加根际土壤中AHLs的含量,QS调控增强植物根部对K+吸收[71],同时发现根瘤菌数量与QS强度呈正相关,原因是QS系统介导质粒基因水平转移的增强能保证根瘤菌的整体结瘤能力,提高了其种群结瘤固氮、耐酸铝的能力[72],而芽孢杆菌属、假单胞菌属等PGPR将能土壤中难溶的络合磷酸盐转化成易溶的无机磷酸盐离子,为可利用磷酸盐提供了保证,以维持较高的群体感应强度[73].向土壤环境中投加氮肥形成的高氮浓度,在其压力下细菌为保证自身活性会分泌大量的C8-HSL,导致排放过量的胞外聚合物,抵抗强氮浓度的冲击,而在水稻土根际中,溶解性有机氮的含量与AHLs的产生成正比,N循环酶对高分子量N向低分子量N的转化依赖于QS系统及其在根际土壤中的行为,QS系统可能是根际氮矿化过程中的控制点[74].从QS系统调控角度证明Ca2+、N、P、K等微量营养元素对于抵抗外界酸铝胁迫以维持根际稳定的重要作用.
3.1.3 生物炭施加生物炭由于其对土壤改良的作用而引起了人们极大的关注.它们增强了碳储量、土壤肥力质量以及污染物(有机和重金属)的固定和转化[75].生物炭的投加会引起的土壤pH升高并驱动AHLs信号的水解,从而减少了生物可利用的AHLs的数量,使细菌细胞间的通信失活[76].此外,不同制备温度的生物炭对AHLs介导的细胞通信抑制能力不同,如在700 ℃条件下制备的生物炭(表面积为301 m2/g)对细胞通信的抑制作用是300 ℃条件下同等质量生物炭(表面积为3 m2/g)的10倍以上[77].研究发现利用500 ℃条件下制备的水稻生物炭,较低的施用量能提高细菌群落稳定性,增加对K+和Mg2+的吸收,显著提高水稻产量[78].因而可利用不同生物炭制备方法或者改变添加量调节土壤细菌细胞间信号的基因表达,以改变土壤有机物的分解速率和改变植物生物量的生产,未来应考虑如何实现生物炭的各种环境效应之间的权衡,以及研究生物炭-微生物群相互作用对土壤修复和改良的作用机理[79].
3.1.4 重金属污染土壤中镉、铅等重金属通过氧化应激产生超氧化物(O2-)、过氧化氢(H2O2)等破坏氧化还原的稳态,导致植物细胞死亡,降低农产品的产量和品质[80].PGPR一般通过细胞膜转运作用、螯合吸附作用、氧化还原作用来固定、移除或转化金属,降低其毒性,最终提高其耐受性[81-82].其中QS系统调控产生的铁载体除了螯合Fe3+外,还具有螯合其它重金属如Al3+、Zn2+、Cu2+、Pb2+和Cd2+的能力,从而维持微生物的稳态和重金属耐受性[83].近来研究发现Ag+、Cu2+等重金属离子可与QS信号分子N-乙基-L-高丝氨酸内酯(HHL)发生络合反应,Ag+与HHL产生的金属配合物相比Ag+生物毒性明显降低[84].QS介导产生的EPS中的羧基、羟基、酚基、磷酸基和巯基与带正电荷的重金属发生反应进而固定,减少氧化自由基的形成.可溶性EPS对重金属的吸附能力高于结合态EPS,且EPS与二价阳离子(Ca2+和Mg2+)的结合在维持生物膜结构中起重要作用,同时QS介导形成的生物膜也能有效地阻止各种氧自由基进入细胞内[85].除了PGPR自身的代谢活动,在重金属胁迫下QS系统还间接调控超富集植物修复重金属离子,如产生ACC脱氨酶降低植物中乙烯的含量,并产生植物激素促进超富集植物生长,提高对重金属离子的转运吸收[86].
3.1.5 有机物污染有机污染物如多环芳烃(PAHs)等具有较高的疏水性且理化性质稳定,进入土壤环境后在植物、动物体内逐级富集,最后通过食物链对人体造成危害[87].QS基因调控多环芳烃(PAHs)生物降解的各种关键是EPS的形成、生物表面活性剂的产生、水平基因的转移.EPS中含生物表面活性剂对多环芳烃的增溶起着至关重要的作用,多环芳烃的溶解使其很容易被细菌细胞降解.编码长链AHLs的LasI基因和编码短链AHLs的RhlI基因对铜绿假单胞菌N6P6生物膜的形成和EPS的产生具有调节作用,这些因素与细胞内信号分子一起,显著地提高了菲、苯酚、苯甲酸的降解率[88-89].QS系统的调控活动在加强天然污染场所的生物修复方面可能发挥着关键作用,目前已报道芽孢杆菌及假单胞菌属通过儿茶酚、双加氧酶等对菲、芘等多环芳烃具有较好的降解效果[90-91],但是对于QS系统参与有机物污染降解相关基因的调控作用研究相对较少,未来值得关注.QS系统调控对重金属和有机污染物的影响如图4所示.
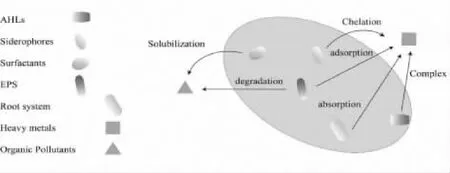
图4 QS系统调控对重金属和有机污染物的影响Fig.4 The effect of QS system regulation on heavy metals and organic pollutants
3.2 根际土壤生物胁迫
在根际环境存在着大量的病原菌对植物根系及PGPR产生影响.假单胞菌的QS系统能调控分泌2,4-二乙酰基间苯三酚(2,4-DAPG)等抗生素有效控制植物病原菌,AHLs及DKPs参与诱导植物系统抗性(Induced Systemic Resistance, ISR),ISR与根际区域微生物拮抗的生理耐受以及防御反应导致的植物抗毒素的产生直接相关[92].同时QS系统通过产生铁载体螯合环境中的Fe3+进而还原成Fe2+被自身利用, 假单胞菌形成的铁离子络合物难被本属以外的其它细菌利用,因此能够抑制并减少植物根部病原菌的数量,同时螯合的铁离子被植物利用促进生长[93].QS系统容易受到外界环境的干扰发生群体感应淬灭(Quorum quenching, QQ),通常QQ的发生主要通过以下途径:(1) 限制LuxI等信号分子合成基因的表达;(2)对已产生的AHLs等信号分子的降解;(3)阻止QS信号分子向靶向信号受体的结合.基于QS系统调控抑制病原菌致病因子的表达, 使病原菌不能侵染寄主或降低致病力, 且不易使病原菌产生抗性.利用相关QS降解基因及降解酶等制成信号分子类似物、信号分子降解酶剂、信号受体激活剂/抑制剂等抑制群体感应阻隔植物病原菌的侵扰将成为一种绿色环保型病害防治策略[94].目前已知有农杆菌AttM芽孢杆菌AiiA内酯酶、乳糖酶和脂肪酸酰胺水解酶等具有破坏AHLs分子内酯环键的能力,对AHLs类信号分子具有降解作用,常作为AHLs分子的抑制剂[95].通过外加群体抑制剂抑制土壤中AHLs(C4-C8)的信号分子浓度,能显著降低土壤中抗生素抗性基因的丰度,以此降低病原菌在高抗生素环境中产生耐药性的风险[96].未来可通过基因工程,可以在不同植物促生菌中转移一些编码QQ酶的细菌基因,以抑制病原菌的生长以增加作物产量并促进可持续农业实践的需要[97].
4 结论与展望
由上述可知,在面对根际环境中缺氧、盐碱、酸铝等非生物胁迫及病原菌等生物胁迫时,PGPR的QS系统能响应并调控自身行为降低胁迫的不良影响,并协调微生物-植物互作共同发挥生防功能抵御病原菌,最重要的是QS系统能促进重金属及有机物污染的消减.QS系统在面对根际环境胁迫时通过提高QS强度,产生AHLs等信号分子诱导功能基因的表达,如分泌大量的胞外聚合物抵御外界不良环境的干扰,形成生物膜加强根部定殖以保证正常的生防功能,调控产生IAA、抗生素等植物激素诱导启动植物的ISR系统抵御外界不良环境.与此同时,QS系统能介导PGPR产生铁载体螯合、信号分子自身的螯合降低重金属的生物毒性,并利用产生的表面活性剂增溶土壤有机污染物.值得注意的是外界施加生物炭会抑制QS系统产生信号分子,这对未来应用材料修复土壤污染时应充分考虑其对于土壤植物、微生物活性的影响.PGPR菌群复杂的QS系统在维持根际环境稳态发挥重要的调控作用,但也易受到干扰发生QS淬灭.可见,发展以植物根际QS系统调控为基础的土壤原位修复技术,实现中轻度土壤重金属/有机污染修复和安全利用,充满了机遇与挑战.为此,可从以下几方面加强研究,以发展更有效的土壤微生物-植物联合修复技术:
(1) 在我国耕地土壤复合污染导致的粮食安全问题加剧的背景下,未来应关注根际环境中PGPR的QS系统对于重金属/有机复合污染等胁迫下的信号调控作用.植物根系细胞中是否存在QS信号分子的受体及其如何感知QS信号分子的传导机制目前还不清楚,PGPR的信号分子在保持植物根系活性和土壤复合污染物消减之间的作用关系也有待深入研究.加强微生物组等新兴组学技术的研究必然会进一步揭示QS系统的根际环境调控机制.
(2) 源头抑制微生物的信号传递途径的群体感应淬灭研究需要加强,从根际环境中找出信号分子降解相关的酶、菌群及外源物质,对于保护根际群落的稳定性具有重要意义.
(3) 利用转基因技术改造PGPR,加强信号分子与植物根系、污染物的互作研究,充分发挥QS系统在根际信号传递中的作用,以此推动土壤微生物-植物联合原位修复技术的发展.