冻干粉针用溴化丁基胶塞中溴化物的迁移及安全性评价
2021-12-23何小玲黄武平余秋玲
马 艳,何小玲,黄武平,余秋玲,牟 琼
(重庆市计量质量检测研究院,重庆 401123)
冷冻干燥技术是在适当的低温、真空环境下将药液冻结除水,最终得到疏松多孔的的干燥药品,从而使得易氧化物质和热敏物质不受破坏,其成分得到有效保存[1].有别于其他常压包装的药品,冻干粉本身含水率极低,且包装内部具有一定真空度.药用溴化丁基胶塞助剂众多,成分复杂,药物在这种状态下长期储存,胶塞中的水分、有毒有害物质很有可能进入药品.目前溴化丁基胶塞迁移物研究主要涉及抗氧剂[2]、金属元素[3]、脂肪酸类[4]、游离硫[5]等.2018年4月16日,《化学药品与弹性体密封件相容性研究技术指导原则(试行)》[6]正式发布.指导原则中明确规定密封件中可提取物溴化物的分析方法为离子色谱法,但提取介质和提取方式则建议研究者自行选择,详尽的分析方法更无从获取.有文献报道采用氧瓶(弹)燃烧-离子色谱法、氧瓶燃烧-化学滴定法测定胶塞中的溴[7-9].此类方法需要充氧燃烧、操作繁琐,燃烧不完全或者吸收液吸收不完全均影响测定结果.也有采用炽灼残渣法[10]将胶塞炭化、灰化、溶解、过滤、调节pH后测定其溴化物含量,但方法步骤繁多,试液多次转移容易造成目标物的损失.以上方法都是将有机溴转变为无机溴,测定结果为胶塞中溴的总量,无法反映胶塞中溴化物的迁移水平.对于定性鉴定来说,提取试验只需要释放量满足检测和鉴定的需要即可,并不需要试样组成物全部释放[11].方旻等[12]考察了45 ℃时,水、65%乙醇、异丙醇对胶塞中溴化物的提取效率,结果异丙醇最为显著.但是淋洗液与纯有机试剂相遇后有盐析出的可能进而堵塞进样阀和色谱柱.因此,选择适宜的提取溶媒、寻找更优的提取条件、实现对目标物最大程度的提取尤为重要.
本文优化了提取溶剂、提取温度、提取时间等试验条件,建立了冻干粉针用溴化丁基胶塞中溴化物的提取方法,考察了胶塞中溴化物在实际药物冻干粉中的浸出水平并进行了安全性评价,为后续药品与包装相容性研究提供理论依据和方法.
1 试验部分
1.1 仪器与试剂
Dionex Aquion离子色谱仪(美国赛默飞世尔公司),配有RFIC自动淋洗液发生器(KOH)、CR-TC连续再生捕获柱、AS-DV自动进样器、AERS 500(4mm)阴离子抑制器及电导检测器;超纯水仪(美国Millipore公司);万分之一电子天平(德国赛多利斯公司);电热恒温干燥箱(重庆四达试验设备有限公司).
溴化物对照品(1 000 mg/L,美国Inorganic Ventures公司);异丙醇(色谱纯,美国Honeywell公司);甲醇(色谱纯,德国CNW科技公司);乙腈(色谱级,成都诺尔施);奥美拉唑钠冻干粉(规格40 mg/瓶,每日最大用量4瓶);0.22 μm一次性水系过滤头.
1.2 色谱条件
IonPac AS 11-HC色谱柱(4.0 mm×250 mm),IonPac AS 11-HC保护柱(4.0 mm×50 mm);KOH淋洗液等度洗脱:24 mmol/L(19 min);流速1.0 mL/min;抑制器电流60 mA;柱温30 ℃;电导池温度35 ℃;进样量25 μL.
1.3 标准溶液制备
取溴化物对照品2.00 mL至100 mL容量瓶中,使用去离子水稀释至刻度,摇匀,制成20 mg/L的标准工作使用液.准确移取标准工作使用液适量,以去离子水稀释成每1 mL含溴化物0.2、0.5、1.0、2.0、5.0、10.0 μg的标准工作溶液.
1.4 样品制备
1.4.1 胶塞提取溶液的制备
将溴化丁基胶塞剪碎成细小颗粒(粒径小于2 mm).称取0.3 g(精确至0.1 mg)置于20 mL螺纹样品瓶中,加入10 mL 30%异丙醇水溶液,在80 ℃电热干燥箱中放置7 h,冷却至室温,经0.22 μm水系滤膜过滤后待离子色谱分析.
1.4.2 药品迁移溶液的制备
取10瓶空白注射用冻干粉末,使用超纯水复溶并全部转移至50 mL容量瓶中后定容,得药品复溶液.用0.22 μm水系滤膜过滤,弃去2~3 mL初始滤液,待离子色谱分析.
2 结果与讨论
2.1 胶塞提取条件的优化
根据色谱柱对有机溶剂的耐受情况,考察水、甲醇水溶液、乙腈水溶液、异丙醇水溶液对胶塞中溴化物的提取效果.研究发现相比其他几种溶液,异丙醇对胶塞中溴化物的提取效率最高.虽然色谱柱耐受100%的异丙醇,但是淋洗液与纯有机试剂相遇后有可能会有盐析出,进而堵塞进样阀和色谱柱.因此,我们考察了不同浓度异丙醇水溶液的提取效率,同时结合目标物峰面积和峰形,最终选定30%异丙醇水溶液作为本次试验的提取溶剂.常压下异丙醇和水在80.3 ℃会形成共沸物[13],因此电热恒温干燥箱提取温度设定为80 ℃.胶塞颗粒越小,提取效果越显著,溴化丁基胶塞颗粒剪碎后过筛,选择粒径小于2 mm的试样进行提取试验.随着提取时间的延长,溶剂中溴化物的浓度逐渐累积,当提取时间达到7 h后,迁移量基本保持稳定,故最终提取时间确定为7 h.在1.2节色谱条件下,氟化物、氯化物、亚硝酸根、硫酸根、溴化物、硝酸根能实现良好分离,目标峰与相邻峰分离度大于1.5(如图1所示).

图1 6种阴离子标准溶液色谱图
2.2 线性关系、检出限和定量限
按1.2节的色谱条件,分别对6个浓度梯度的标准工作溶液进行测定,以峰面积(A)对浓度(C,mg/L)进行线性拟合,回归方程与线性范围结果如表1所列.将标准工作溶液逐级稀释,以信噪比S/N=3时确定检出限, S/N=10时确定定量限,结果如表1所列.

表1 线性范围、线性方程、相关系数、检出限和定量限
2.3 回收率及精密度试验
按照1.4.2节对0月注射用冻干粉末分别进行3个浓度水平的加标试验,每个浓度平行测定6次,计算精密度,结果如表2所列.由表2可见,溴化物的加标回收率范围为98.1%~104.3%,相对标准偏差为2.9%~4.3%,该方法准确度和精密度良好.
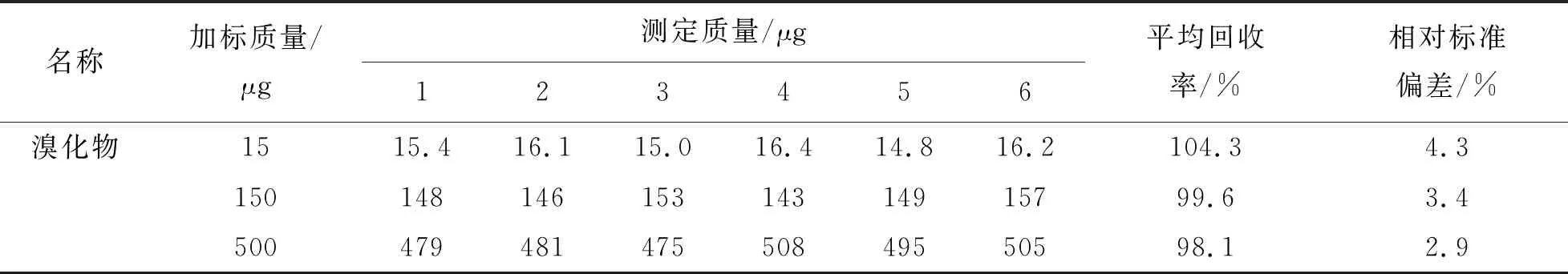
表2 加标回收率和精密度结果(n=6)
2.4 样品分析
2.4.1 胶塞提取试验
按照1.4.1节对3个厂家的溴化丁基胶塞进行提取,再按1.2节色谱条件测定,记录溴化物峰面积并计算其含量,每个样品平行测定3次.结果3种胶塞提取液中均有溴化物检出,测定结果如表3所列.另在称取的胶塞颗粒中加入适量的溴化物标准工作溶液后按照1.4.1节进行,提取试验的平均回收率为108.5%,胶塞提取液离子色谱图如图2所示.

表3 溴化丁基胶塞提取试验结果(n=3)

图2 胶塞提取液离子色谱图
2.4.2 药品迁移试验
根据试验中注射用冻干粉药品的物理化学性质结合《化学药品与弹性体密封件相容性研究技术指导原则(试行)》,加速试验在温度(40±2) ℃、相对湿度(75±5) %下进行.药品放置方式为倒置,考察时间点为0月、加速3月、加速6月.按照1.4.2节制备迁移样品溶液,溴化物测定结果如表4所列,典型色谱图如图3所示.
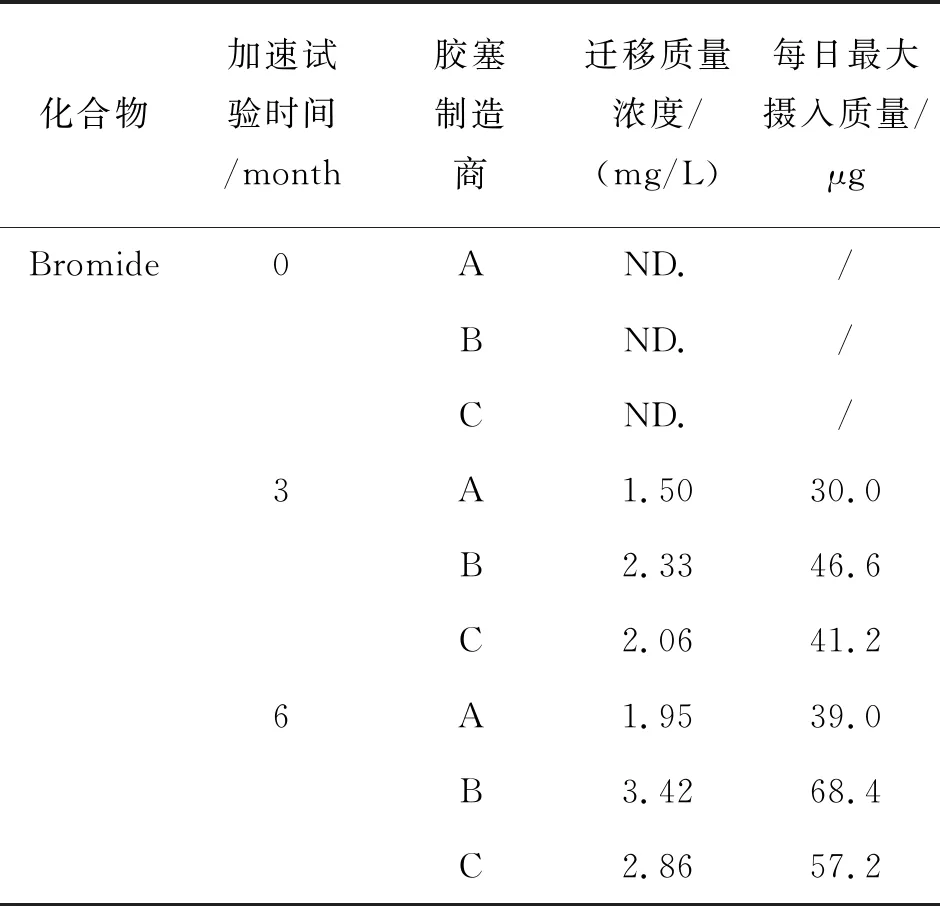
表4 药品迁移试验结果

图3 药品迁移液离子色谱图IonPac AS 11-HC色谱柱(4.0 mm×250 mm),IonPac AS 11-HC保护柱(4.0 mm×50 mm),KOH淋洗液:24 mmol/L(19 min),流速:1.0 mL/min,抑制器电流:60 mA,柱温:30 ℃
2.4.3 安全性评价
查询美国TOXNET数据库(https://www.nlm.nih.gov/toxnet/index.html),溴化物大鼠皮下注射LD50为2 900 mg/kg,无可见影响水平NOEL见式(1).
NOEL=LD50/2000=1.45 mg/kg
(1)
体重Body Weight(BW)按成人60 kg参与计算,从大鼠剂量推断人用剂量系数F1为5,人个体间差异系数F2为10,时间系数F3为10.由于溴化物为非严重毒性,因此产生严重毒性系数F4为1.NOEL已经确定,故可变系数F5为1.那么允许日暴露值[14]PDE见式(2).
PDE=NOEL×BW/(F1×F2×F3×F4×F5)
=1.45 mg/kg×60 kg/(5×10×10×1×1)
=174 μg
(2)
由表4可知,注射用冻干粉药品(规格40 mg/瓶,每日最大用量4瓶)中溴化物实际每日最大摄入质量为30.0~68.4 μg,低于其理论PDE值,溴化丁基胶塞在拟定的接触方式及接触条件下与冻干粉相容性良好,符合指导原则的要求.
3 结论
建立了离子色谱法测定冻干粉针用溴化丁基胶塞中溴化物的提取量和浸出水平.该方法具有样品处理简单、色谱分离效果良好、定性定量准确等优点,可用于溴化丁基胶塞的鉴别,为药厂选择溴化丁基胶塞提供理论依据.
