新型机械敏感离子通道Piezo1和TRPV4蛋白siRNA双沉默模式对骨关节炎大鼠模型的修复作用研究
2021-12-22周勇伟章才华李晓飞蔡迅梓
周勇伟,章才华,李晓飞,蔡迅梓
1.浙江大学医学院附属第二医院骨科,杭州 浙江 310000;2.浙江大学医学院附属金华医院骨一科,金华 浙江 321000
骨关节炎(Osteoarthritis,OA)是临床上的常见病、多发病,尤其是随着我国老龄化社会结构的不断深入,越来越多的老年患者长期受到OA的困扰,从而影响生活质量,甚至降低患者的寿命[1,2]。据流行病学统计分析结果显示,至2019年底,我国新增的OA患者高达100多万,其中女性患者多于男性[3]。目前,针对OA的治疗主要采用“阶梯疗法”,而最有效的治疗方案主要是人工全膝关节置换术。但是,人工膝关节假体有一定的使用寿命,过早的手术置换,会增加术后二次翻修的机会,从而加重患者家庭的经济负担,增加患者本身的痛苦[4,5]。随着基因治疗技术的不断进步,利用siRNA技术靶向沉默疾病的关键基因已经越来越引起人们的关注。其中,经过美国FDA批准应用的siRNA药物Onpattro已经应用于临床,充分证明了基因治疗在临床治疗上的巨大潜力[6]。机械牵张力学信号在骨科相关疾病的作用已经越来越引起人们的关注,其中新型机械通道蛋白Piezo1是最近发现的,与生物力学信号密切相关的跨膜蛋白分子[7,8]。有研究证明,Piezo1蛋白参与OA软骨细胞的凋亡以及成骨细胞增殖和分化过程[9]。TRPV4蛋白也是瞬时受体电位通道家族(TRP)的重要成员之一,有研究表明,TRPV4可以介导机械力学信号,并且可以在软骨细胞中广泛表达[10]。本研究在此基础上,利用siRNA干扰技术构建新型机械敏感离子通道Piezo1和TRPV4蛋白siRNA双沉默载体,并且通过慢病毒转染软骨细胞,通过局部注射的方法干预OA动物模型,从而在实验动物层面上观察双基因沉默模式对OA的治疗作用,以期为临床上OA的治疗提供新的思路和方法。
1 材料与方法
1.1 实验材料
胎牛血清购自以色列BI公司;DMEM及0.25%胰酶Trypsin购自美国Invitrogen公司;TRIZOL购自美国Invitrogen公司;氯仿、酒精及逆转录试剂盒购自日本TaKaRa公司;电泳仪,Real-time荧光定量PCR仪购自美国Bio-rad公司,手术器械购自北京源德医疗器械有限公司;SPF级SD大鼠购自济南齐鲁实验动物中心(SCXK(鲁)2018-2892)。月龄6~7个月,体重398~412 g。
1.2 实验方法
1.2.1 大鼠来源软骨细胞的培养 无菌条件下获取SD大鼠的膝关节软骨组织,利用眼科剪对关节镜下获得的软骨组织块修剪成1 mm×1 mm×1 mm的组织,利用5%胶原酶处理4 h,2.5%胰蛋白酶处理30 min,经细胞筛分离后,加入混有20%胎牛血清(FBS)的DMEM培养基,置入37℃,5%CO2培养箱中进行培养,3 d换液1次,细胞融合率达80%以上时,进行细胞换代。
1.2.2 大鼠来源软骨细胞的鉴定 本研究采用免疫组织化学染色的方法进行鉴定,检测靶细胞中Aggrecan蛋白和Collagen II蛋白的表达。靶细胞经4%多聚甲醛固定后,PBST溶液清洗3次,每次5 min,1%HCL孵育30 min,PBST溶液清洗3次,每次5 min,3%双氧水孵育20 min,PBST溶液清洗后4℃避光过夜孵育Aggrecan蛋白和Collagen II蛋白一抗,孵育时间>12 h,PBST溶液清洗3次,每次5 min,二抗孵育30 min,避光。PBST溶液清洗后HRP-亲和素孵育30 min,PBST溶液清洗3次,每次5 min,DAB染色10 min后光学显微镜下观察。
1.2.3 siRNA-Piezo1干扰载体和siRNA-TRPV4干扰载体的构建 siRNA-Piezo1和siRNA-TRPV4干扰载体的构建和筛选由上海吉凯公司完成。首先通过Pubmed Genebank查询Piezo1蛋白和TRPV4的基因序列以及ORF序列和3’-UTR序列。根据siRNA靶点设计原理,构建siRNA-Piezo1和siRNA-TRPV4的干扰序列。选取上海吉凯公司提供的hU6-MCSCMV-EGFP慢病毒载体作为酶切对象,加入siRNA干扰序列后,转染大鼠来源软骨细胞,进行克隆测定,然后进行质粒的抽提,慢病毒的包装以备用。
1.2.4 慢病毒介导siRNA干扰载体转染软骨细胞以P2代软骨细胞为靶细胞,待细胞融合率为80%以上时,利用2.5%胰蛋白酶处理2 min后提取细胞制备细胞悬液,然后接种于六孔板中,细胞密度为2×105个/ml,置于37℃,5%CO2细胞培养箱中进行培养,3 d换液1次,细胞融合率达60%以上时,加入含有siRNA-Piezo1和siRNA-TRPV4干扰载体的慢病毒质粒,根据MOI=50来确定慢病毒的滴度和加载量。利用倒置荧光显微镜对慢病毒的转染效率进行检测,计算转染率。根据公式:转染率(100%)=绿色荧光细胞/白光细胞×100%。
1.2.5 SD大鼠骨关节炎模型的构建 本研究利用手术处理的方案构建骨关节炎的动物模型。以SD大鼠作为研究对象,麻醉方式为腹腔注射10%水合氯醛,然后进行常规去毛和备皮,以SD大鼠后腿膝关节为中心点,切开膝关节腔,然后利用眼科剪剪断SD大鼠的前交叉韧带和内侧半月板,然后逐层缝合膝关节。术后连续3 d每天肌肉注射青霉素2×105U,2次/d。造模1周后以X射线片显示关节内侧间隙明显变窄、关节面粗糙变形、边缘有明显骨赘、软骨下骨骨密度增高鉴定模型成功[11]。
1.3 实验分组
根据对SD大鼠模型的处理方案的不同,将SD大鼠分成6组,每组的实验动物有3只。即空白对照组,SD大鼠不做处理;假手术组,SD大鼠单纯打开膝关节后,不切断交叉韧带;模型组,SD大鼠切除交叉韧带后,构建OA动物模型;siRNA-Piezo1组,SD大鼠OA模型构建成功后,加入转染siRNA-Piezo1质粒的软骨细胞,细胞量为5×105个/ml,加载量为2 ml;siRNA-TRPV4组,SD大鼠OA模型构建成功后,加入转染siRNA-TRPV4质粒的软骨细胞,细胞量为5×105个/ml,加载量为2 ml;双基因沉默组:SD大鼠OA模型构建成功后,加入转染siRNA-TRPV4质粒和siRNA-Piezo1的软骨细胞,细胞量为5×105个/ml,加载量为2 ml。
1.4 动物模型的检测
1.4.1 免疫组织化学染色 处理2周后,无痛苦处死SD大鼠,无菌条件下获得膝关节软骨组织,经4%多聚甲醛固定后,-80℃超低温冰箱保存,冰冻切片机切片,厚度为20μm,PBST溶液清洗3次,每次5 min,1%HCL孵育30 min,PBST溶液清洗3次,每次5 min,3%双氧水孵育20 min,PBST溶液清洗后4℃避光过夜孵育Aggrecan蛋白和Collagen II蛋白一抗,孵育时间>12 h,PBST溶液清洗3次,每次5 min,二抗孵育30 min,避光。PBST溶液清洗后HRP-亲和素孵育30 min,PBST溶液清洗3次,每次5 min,DAB染色10 min后光学显微镜下观察。
1.4.2 HE染色 处理2周后,无痛苦处死SD大鼠,无菌条件下获得膝关节软骨组织,4%多聚甲醛固定24 h,50%-70%-80%-90%-100%梯度酒精脱水,二甲苯处理后制备石腊块。切片机制备厚度4μm的切片,制备石腊切片,然后进行脱蜡处理,1%过碘酸水溶液氧化10 min,Schiff试剂染色30 min,苏木精复染5 min,95%无水乙醇脱水后中性树胶封片,光镜下观察。
1.4.3 番红-固绿染色 处理2周后,无痛苦处死SD大鼠,无菌条件下获得膝关节软骨组织,4%多聚甲醛固定24 h,50%-70%-80%-90%-100%梯度酒精脱水,切片加入固绿染液,处理10 min,自来水进行漂洗,然后加入番红染液,处理10 min,自来水进行漂洗。利用二甲苯进行处理后,中性树胶封片,光镜下观察。
1.4.4 荧光定量聚合酶链反应(RT-PCR)检测Piezo1,TRPV4,Aggrecan和Collagen IImRNA相对表达水平
利用胰蛋白酶收集上述各组细胞,经PBS溶液清洗3次,常温离心机1500 rpm离心5 min,取沉淀,加入1 ml Trizol溶剂,提取细胞总RNA,保证RNA纯度范围为1.8-2.1,然后利用TaKaRa逆转录试剂盒的要求,采用20μl反应体系逆转录为cDNA,-80℃保存,采用TaKaRa荧光定量PCR试剂盒的要求,采用FTC-2000 RT-PCR系统和50μg反应体系对样本DNA进行分析,溶解曲线确定Tm值为53.7℃,统计并记录各组样 本 的CT值,采 用2-△△CT法 对Piezo1,TRPV4,Aggrecan和Collagen II的mRNA相对表达水平。
1.5 统计学分析
应用统计学软件(SPSS 21.0美国)进行数据学统计,定量资料采用均数±标准差()表示,空白对照组,假手术组,模型组;siRNA-Piezo1组,siRNATRPV4和双基因沉默组的HE染色,番红固绿染色和Piezo1,TRPV4,Aggrecan和Collagen IImRNA相对表达量比较采用方差分析(F检验),组间比较采用q检验,认为P<0.05具有统计学差异。
2 结果

表1 靶基因的序列Tab.1 The oligo sequence of the target gene
2.1 大鼠来源软骨细胞的培养和鉴定
结果显示,原代大鼠来源软骨细胞呈不规则形(见图1 A),P2代软骨细胞呈碎石路样排列(见图1B),甲苯胺蓝染色和HE染色见图1 C-D,免疫组织化学染色结果显示,软骨细胞标志蛋白Aggrecan蛋白和Collagen II蛋白染色阳性(见图1 E-F)。

图1 软骨细胞的培养和鉴定 A:P0软骨细胞 B:P2代软骨细胞 C-D:软骨细胞的甲苯胺蓝染色和HE染色 E-F:软骨细胞标志蛋白Aggrecan蛋白和Collagen II蛋白染色Fig.1 Culture and identification of chondrocytes A:The P0 chondrocytes;B:The P2 chondrocytes;C-D:Toluidine blue staining and HE staining of chondrocytes;E-F:Thestaining of Aggrecan protein and Collagen IIprotein
2.2 慢病毒介导siRNA质粒转染软骨细胞
结果显示,慢病毒介导siRNA质粒(siRNAPiezo1,siRNA-TRPV4和双基因siRNA沉默质粒)均可以转染软骨细胞,转染效率均>90%以上。RT-PCR检测结果显示,双基因siRNA沉默质粒均可以沉默Piezo1和TRPV4的mRNA表达量(P<0.05)。见图2。

图2 慢病毒介导siRNA质粒转染软骨细胞和Piezo1、TRPV4 mRNA的相对表达量A:慢病毒转染结果B:Piezo1,TRPV4 mRNA相对表达量 注:*P<0.05Fig.2 TherelativemRNAexpression of TRPV4 and Piezo1 in chondrocytestransfected with lentivirusmediated siRNAplasmidA:Result of lentiviral transfection;B:TherelativemRNA expression of Piezo1 and TRPV4;Note:*P<0.05
2.3 HE染色结果
结果显示,空白对照组和假手术组膝关节HE染色结果显示,膝关节结构存在,软骨面光滑。模型组膝关节结构已经完全破坏,siRNA-Piezo1组膝关节软骨下骨成分存在,siRNA-TRPV4组膝关节软骨结构欠清晰。双基因沉默组修复效果明显优于siRNAPiezo1组和siRNA-TRPV4组。膝关节HE染色的改良Minkin’s评分结果显示,双基因沉默组修复效果明显优于siRNA-Piezo1组和siRNA-TRPV4组(P<0.05)。见图3和表2。

表2 膝关节HE染色的改良Minkin’s评分结果Tab.2 The modified Minkin's score of HE staining of knee joint

图3 HE染色结果 A:空白对照组B:假手术组 C:模型组D:siRNA-Piezo1组E:siRNA-TRPV4组F:双基因沉默组Fig.3 Results of the HE staining A:The blank control group;B:The sham operation group;C:The model group;D:The siRNAPiezo1 group;E:ThesiRNA-TRPV4 group;F:Thedoublegene silencing group
2.4 番红-固绿染色结果
结果显示,空白对照组和假手术组膝关节番红-固绿染色结果显示,膝关节结构存在,软骨面较厚,软骨下骨结构存在。模型组膝关节结构紊乱,失去了正常结构。siRNA-Piezo1组膝关节软骨下骨成分存在,siRNA-TRPV4组膝关节软骨结构欠清晰。双基因沉默组修复效果明显优于siRNA-Piezo1组和siRNATRPV4组,见图4和表3。
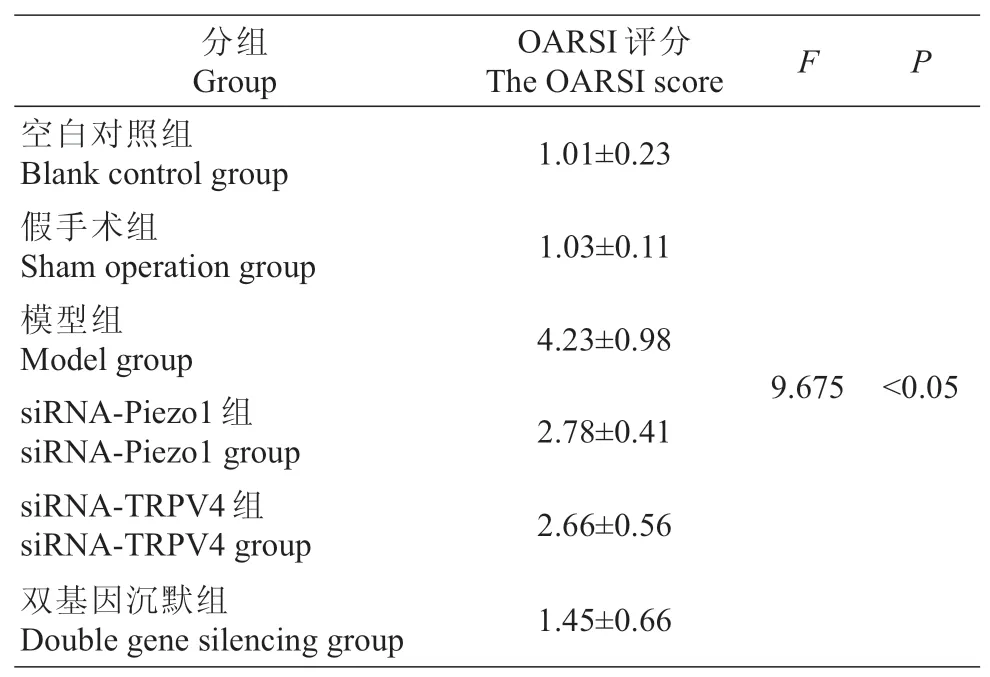
表3 膝关节番红-固绿染色的OARSI评分结果Tab.3 The OARSI scores of knee joint stained with safranin and solid green
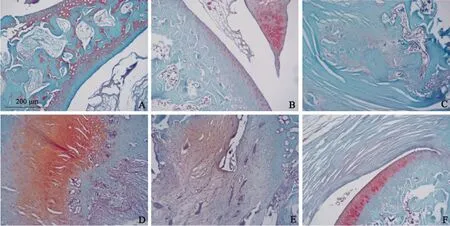
图4 番红-固绿染色结果A:空白对照组 B:假手术组 C:模型组 D:siRNA-Piezo1组 E:siRNA-TRPV4组 F:双基因沉默组Fig.4 Results of safranine green stainingA:The blank control group;B:The sham operation group;C:The model group;D:The siRNA-Piezo1 group;E:The siRNATRPV4 group;F:Thedoublegenesilencing group
2.5 免疫组织化学染色结果
结果显示,模型组膝关节组织中Aggrecan蛋白和Collagen II蛋白的含量要明显低于空白对照组和假手术组(P<0.05)。siRNA-Piezo1组和siRNA-TRPV4组膝关节组织中Aggrecan蛋白和Collagen II蛋白的含量要明显高于模型组(P<0.05)。双基因沉默组膝关节组织中Aggrecan蛋白和Collagen II蛋白的含量要明显高于siRNA-Piezo1组和siRNA-TRPV4组(P<0.05),见图5、图6和表4。

表4 免疫组织化学染色结果Tab.4 Theresultsof theimmunohistochemical staining

图5 各组大鼠膝关节膝关节组织中Aggrecan蛋白表达结果A:空白对照组B:假手术组C:模型组D:siRNA-Piezo1组E:siRNA-TRPV4组F:双基因沉默组Fig.5 The Aggrecan protein expression in the knee tissues of rats in each groupA:The blank control group;B:The sham operation group;C:The model group;D:The siRNA-Piezo1 group;E:The siRNA-TRPV4 group;F:The double genesilencing group

图6 各组大鼠膝关节组织中Collagen II蛋白表达结果A:空白对照组B:假手术组C:模型组D:siRNA-Piezo1组E:siRNA-TRPV4组F:双基因沉默组Fig.6 The Collagen IIprotein expression in the knee tissues of rats in each groupA:The blank control group;B:The sham operation group;C:The model group;D:The siRNA-Piezo1 group;E:The siRNA-TRPV4 group;F:The doublegenesilencing group
2.6 RT-PCR结果显示Piezo1,TRPV4,Aggrecan和Collagen II mRNA相对表达水平
结果表明,siRNA-Piezo1组可以沉默Piezo1的mRNA表达量,增加Aggrecan和Collagen IImRNA相对表达量。siRNA-TRPV4组可以沉默TRPV4的mRNA表达量,增加Aggrecan和Collagen IImRNA相对表达量。并且,双基因沉默组中Aggrecan和Collagen IImRNA相对表达量明显高于siRNA-Piezo1组和siRNA-TRPV4组(P<0.05)。见图7。
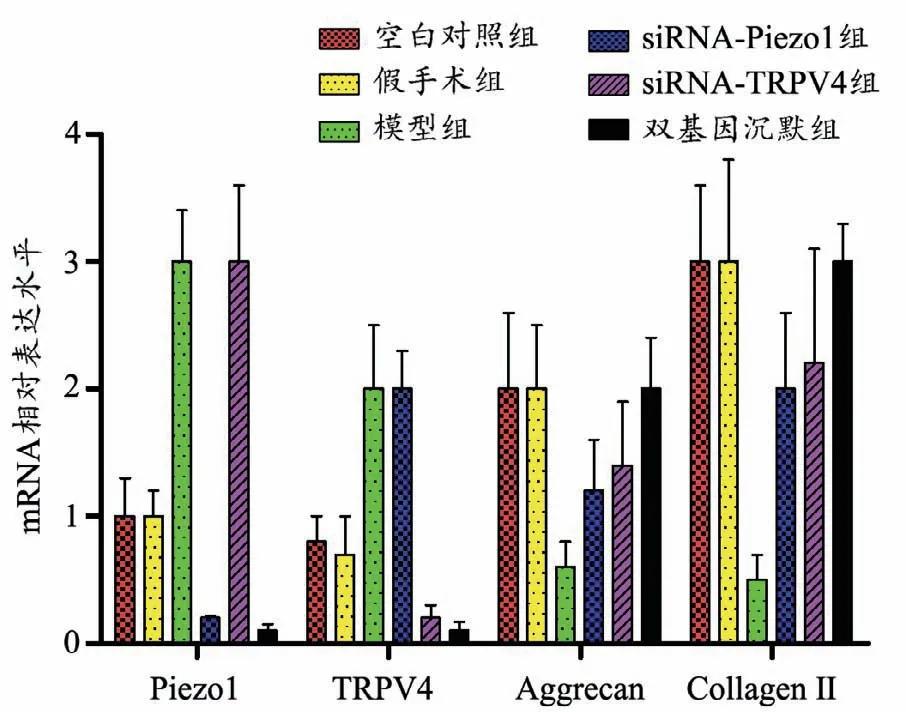
图7 RT-PCR结果显示Piezo1、TRPV4、Aggrecan和Collagen IImRNA相对表达水平Fig.7 The results of the RT-PCR showed the relative mRNA expression levels of Piezo1,TRPV4,Aggrecan and Collagen II
3 讨论
骨关节炎是临床上的常见病、多发病。随着我国老龄化社会的不断深入,OA患者的发病率也越来越高。目前针对OA的治疗尚缺乏安全有效的治疗方案,因此,亟需对OA的发病机制进行研究,对OA治疗方案进行革新。机械激活离子通道是一种与生物力学密切相关的通道蛋白,我们的前期研究表明,新型机械激活离子通道Piezo1与OA进展过程中软骨细胞的过度凋亡密切相关,并且,利用siRNA-Piezo1质粒可以阻断Piezo1的表达,通过ERK1/2信号通路介导软骨细胞的凋亡[12]。但是,我们之前的研究仅局限于细胞层面,对于动物层面的研究尚未涉及,在本次研究中,我们通过手术干预的方法构建SD大鼠的OA动物模型,通过siRNA技术构建Piezo1和TRPV4的干扰质粒,通过慢病毒转染软骨细胞后,注射入膝关节内,观察其对OA动物模型的干预效果,是否可以对OA的进展起到一定的阻滞作用。以期为临床上OA的治疗提供新的思路和方法。
既往研究表明,Piezo1蛋白的表达与骨关节炎(OA)患者膝关节软骨细胞的凋亡密切相关,在牵张应力作用下,OA软骨细胞中Piezo1蛋白的表达量明显增加,而且可以通过ERK5信号通路介导软骨细胞的过度凋亡,进而促进OA的进展[11]。也有研究表明,Piezo1蛋白的激活可以促进骨肉瘤细胞的侵袭和增殖,利用Piezo1蛋白抑制剂GsMTx4抑制Piezo1蛋白的表达后,可以抑制骨肉瘤细胞的增殖,抑制细胞的侵袭[13]。TRPV4蛋白离子通道也是近年来比较热门的离子通道,可以介导流体力学和机械应力信号等,进而参与成骨细胞的分化,软骨细胞的凋亡等[14]。在本研究中,我们利用siRNA技术构建Piezo1和TRPV4的干扰质粒,利用软骨细胞作为载体,通过慢病毒转染后,干预OA动物模型。通过HE染色和番红-固绿染色等方法,利用改良Minkin’s评分和OARSI评分进行评估,结果提示,siRNA-Piezo1组和siRNATRPV4组膝关节软骨组织的评分要明显优于模型组,并且,双基因沉默组修复效果明显优于siRNAPiezo1组和siRNA-TRPV4组(P<0.05)。结果说明,将机械激活离子通道Piezo1和TRPV4蛋白阻断后,可以在一定程度上阻滞OA的进展,并且可能在一定程度上对软骨组织起到一定的修复效果。另外,利用双基因沉默模式,相较于单基因模式更具有优势。是一种值得参考的方向。
多聚蛋白多糖(Aggrecan)和II型胶原蛋白(Collagen II)是软骨细胞的特征性蛋白,有研究表明,可以通过检测Aggrecan和Collagen II蛋白的表达来反应软骨细胞的增殖和软骨组织的修复情况[15]。在本研究中,我们利用免疫组织化学染色的方法,检测原代软骨细胞中Aggrecan和Collagen II蛋白的表达,从而对软骨细胞进行鉴定。另外,我们还通过免疫组织化学染色的方法对OA动物模型膝关节的软骨组织情况进行评估,结果表明,siRNA-Piezo1组和siRNA-TRPV4组中Aggrecan和Collagen II蛋白的表达量要明显高于模型组,并且,双基因沉默组中Aggrecan和Collagen II蛋白的表达量明显高于siRNA-Piezo1组和siRNA-TRPV4组。同时,我们还利用RT-PCR技术检测Aggrecan和Collagen IImRNA的表达量,结果与免疫组织化学染色结果相同,siRNAPiezo1组和siRNA-TRPV4组中Aggrecan和Collagen II的mRNA的表达量要明显高于模型组,并且,双基因沉默组中Aggrecan和Collagen II的mRNA表达量明显高于siRNA-Piezo1组和siRNA-TRPV4组。结果说明,将机械激活离子通道Piezo1和TRPV4蛋白阻断后,可以促进OA软骨组织的修复,并且是通过增加Aggrecan和Collagen II表达量的方法来实现的。另外,利用双基因沉默模式,相较于单基因模式对Aggrecan和Collagen II的表达更具有促进作用。
综上所述,Piezo1和TRPV4蛋白siRNA双沉默模式可以促进Aggrecan和Collagen II的表达,进而对骨关节炎大鼠模型起到一定的修复作用。