生物医用镁合金耐腐蚀性能研究进展
2021-12-22汪荣香洪立鑫章晓波
汪荣香,洪立鑫,章晓波
(1 南京工程学院 材料科学与工程学院,南京 211167;2 江苏省先进结构材料与应用技术重点实验室,南京 211167)
镁合金密度低、比强度高,具有可降解性、良好的生物相容性及生物力学相容性、骨传导性等优点。作为骨科植入材料,与钛合金、不锈钢等传统临床应用的金属材料相比,可降解镁合金能有效缓解“应力遮挡”效应,可避免二次手术取出给患者带来的经济、生理及心理负担[1-2];作为血管支架材料,可避免内膜增生及再狭窄发生[3]。因此,生物医用镁合金被誉为“革命性的金属生物材料”,有望替代不锈钢、钛合金等不可降解医用金属材料,具有广阔的临床应用前景。2013年,德国SYNTELLIX AG公司研发的镁合金空心加压螺钉取得欧盟CE认证,正式应用于手部、脚部骨折等临床治疗[4]。2015年,韩国U&I公司开发的镁合金螺钉取得了韩国药监局认证,用于人体临床[5]。国内东莞宜安科技可降解纯镁骨内固定螺钉于2019年正式获批,成为我国首款获批临床实验的生物可降解镁螺钉。
然而,镁合金存在腐蚀(降解)速率过高及局部腐蚀等问题[6],易导致其过早丧失力学完整性和支撑性,从而制约了其在临床治疗,尤其是在骨科承重部位的应用。因此,镁合金腐蚀问题仍然是当前研究的重点。近二十年来,材料与医学工作者在生物医用镁合金成分设计、制备加工、表面改性等方面开展了卓有成效的研究。本文主要从镁合金腐蚀类型、影响因素以及提高医用镁合金自身耐蚀性和表面改性等方面综述了其研究进展,并对未来发展方向进行了展望。
1 镁合金腐蚀类型
镁的金属活性很高,在空气中易氧化,表面形成的氧化膜层P-B比小于1(0.84),无法为镁合金提供有效保护[7]。镁的标准电极电位(-2.37 V)比一般金属元素低,在人体生理环境中,镁合金自身即可形成原电池,发生电化学腐蚀。镁合金的腐蚀主要分为两大类,一是均匀腐蚀,二是局部腐蚀。
1.1 均匀腐蚀
均匀腐蚀,也被称为全面腐蚀,是发生在金属表面或绝大部分表面的一种腐蚀现象。绝大部分镁合金腐蚀类型为非均匀腐蚀。一般可以通过高纯化、细晶化、均匀化等方式来实现合金的均匀腐蚀[8],以达到均匀降解的目的,为植入材料服役过程提供完整的力学支撑。
1.2 局部腐蚀
局部腐蚀是指发生在金属表面局部位置的腐蚀现象。常见的局部腐蚀有电偶腐蚀、点蚀、丝状腐蚀、晶间腐蚀、应力腐蚀等。镁合金不同结构/相之间的电位差、腐蚀液中的强腐蚀离子(如Cl-)的侵蚀以及氧浓度差的驱动等原因造成了镁合金的局部腐蚀。同种合金在不同状态下可表现出不同的腐蚀类型,Zhang等[9]对GZ51K镁合金进行不同工艺处理,发现铸态合金为均匀腐蚀,而时效态合金为局部腐蚀,腐蚀形貌如图1所示。相对于均匀腐蚀,局部腐蚀具有突发性和不可预测性,易导致植入材料过早丧失力学完整性和支撑性。

图1 GZ51K在模拟体液中浸泡120 h后的腐蚀形貌[9](a)铸态,均匀腐蚀;(b)T6态,局部腐蚀Fig.1 Corrosion morphologies of GZ51K after immersion in simulated body fluids for 120 h[9] (a)as cast,uniform corrosion;(b)T6 state,local corrosion
2 影响生物医用镁合金腐蚀行为的主要因素
医用镁合金服役环境复杂,其腐蚀降解行为主要取决于合金成分和显微组织等内在因素,以及环境介质、流场、应力等外在因素。
2.1 内部因素
2.1.1 合金成分
杂质元素Fe,Cu,Ni,Co等是影响镁合金耐腐蚀性能的重要因素。纯镁的耐腐蚀性与杂质容限量有关,超过容限量会明显加速镁合金的腐蚀。纯镁中Fe,Cu和Ni的容限量分别为1.7×10-4,1×10-3和5×10-6[10]。
合金成分可改变镁合金的显微组织、各相之间的电位差和表面电势,由此影响耐腐蚀性能。合金成分的变化还会影响合金表面的氧化膜层或腐蚀产物膜层,表面膜层P-B比值在1~2之间可对合金起到保护作用[7],大多医用镁合金的表面膜并未起到保护作用。但也有研究发现,加入Li和Ca的Mg-9.29Li-0.88Ca[11]以及添加Mn的Mg-4Zn-0.5Ca[12]在模拟体液中可生成具有保护性的膜层,提高了合金的耐蚀性能。
2.1.2 显微组织

孪晶对镁合金腐蚀也有一定影响。Liu等[15]对EW75合金进行了固溶后挤压(T3)和固溶(T4)处理,研究发现有孪晶组织的T3合金耐蚀性更好。孪晶对镁合金耐蚀性的影响机制是双重的,初期与基体之间的微电偶腐蚀加速基体溶解,而后促进致密表面膜的形成,且表面膜的形成占主导地位,提高了合金耐蚀性。然而,也有研究表明孪晶加剧了合金的穿晶腐蚀,降低了合金的耐腐蚀性[16]。
第二相是镁合金耐腐蚀性的重要影响因素,添加不同种类和含量的合金化元素,进行不同工艺处理均会产生不同结构类型、形态及分布的第二相。被提及最多的影响机制通常是基体的腐蚀电位低于第二相腐蚀电位,两者形成微电池,基体作为阳极率先腐蚀。然而,第二相电极电位低于基体并不代表其腐蚀速率就一定会更好[17]。Gong等[18]研究了Mg-Gd-Zn-Ca合金的腐蚀行为,发现第二相Mg2Ca最开始是作为阳极优先于镁基体腐蚀的,但是在Mg2Ca快速腐蚀完之后,在基体周围留下了很多腐蚀坑,造成了严重的点蚀,加剧了合金的腐蚀。镁合金腐蚀还与第二相的形态及分布有关,Joensson等[19]发现AZ91D中的电势差达到了220 mV,但是其腐蚀速率却比高纯镁还低,这是因为合金晶界处大量的连续的网状第二相包覆了基体,作为腐蚀屏障阻碍了腐蚀向基体扩展,从而降低了腐蚀速率。
Mg-RE-Zn(RE,稀土元素)合金中常形成层片状堆垛层错(stacking faults,SF)或长周期堆垛有序(long period stacking ordered,LPSO)结构,该结构在同一晶粒内部取向相同,不同晶粒内取向不同,力学及腐蚀性能优异[20]。Zhang等[21]利用准原位扫描透射电子显微镜直接观察到铸态GZ31K合金SF附近的α-Mg基体率先腐蚀(图2),且铸态、T4态和挤压态三种状态的合金中,含SF的铸态合金腐蚀速率最低,表现出优异的耐蚀性能[22]。Zhang等[9]在铸态GZ51K合金中发现,当LPSO分布于基体晶粒边缘时,将基体与共晶相隔离,降低了相邻相的腐蚀电位差,抑制电偶腐蚀。且LPSO结构富含Gd,Zn溶质原子,具有较强的表面保护膜形成能力;而无LPSO结构的固溶后人工时效(T6)态合金则因富Zr析出相与基体电位差较大,腐蚀加快且不均匀,其腐蚀机理模型如图3所示[9]。但并非含LPSO结构的镁合金就一定具有优异的耐蚀性能,Mg-Y-Zn合金中的LPSO结构就加速了合金基体的腐蚀,LPSO结构分布在晶界上,基体与LPSO结构界面处存在较大的电位差,LPSO结构充当微阴极并促进周围基体的腐蚀,且腐蚀不均匀[23]。

图2 GZ31K合金中SF结构的扫描透射照片及该微区准原位腐蚀前后的元素分布图[21](a)腐蚀前;(b)腐蚀后;(1)STEM图;(2)O;(3)Mg;(4)Zn;(5)Gd;(6)ZrFig.2 Scanning transmission electron micrograph (STEM) of SF structure in GZ31K alloy and elements distribution before and after quasi-in-situ corrosion element[21] (a)before corrosion;(b)after corrosion;(1)STEM images;(2)O;(3)Mg;(4)Zn;(5)Gd;(6)Zr

图3 GZ51K合金腐蚀过程示意图[9](a)~(d)铸态;(e)~(h)T6态Fig.3 Schematic diagrams of corrosion process for the GZ51K alloy state[9](a)-(d) as-cast;(e)-(h) T6 state
2.2 外部因素
2.2.1 腐蚀环境
目前,研究生物医用镁合金腐蚀行为的介质主要是不同浓度的生理盐水以及包含各类无机盐组分的平衡盐溶液,如模拟体液(simulated body fluid,SBF)、Hank’s溶液、磷酸盐溶液(phosphate buffered solution,PBS)等。随着对医用镁合金体内腐蚀环境的进一步了解,研究者们也开始向腐蚀液中添加适量的有机物或利用细胞培养基等方式使腐蚀液体系更加接近体内降解环境[24]。

实际人体血浆中还存在蛋白质、氨基酸、葡萄糖等有机物。蛋白质可以吸附在镁合金表面,延缓腐蚀[26];也有研究表明蛋白质吸附只是短暂性延缓腐蚀,后期长时间浸泡后,蛋白质会和腐蚀产物形成螯合物,破坏保护膜而加速腐蚀[27]。氨基酸在血浆中含量和蛋白质差很多,普遍认为氨基酸的存在会加速镁合金腐蚀[28]。葡萄糖有助于镁合金表面葡萄糖与镁合金表面磷酸盐的沉积从而降低腐蚀速率[29]。
腐蚀环境的pH值变化会明显影响镁合金腐蚀,不同器官组织的体液环境pH值有所不同,一般在1.5~9.5之间。低pH值加速镁合金溶解,高pH值通过稳定腐蚀层来抑制或减缓腐蚀,并且腐蚀形貌相对均匀。Sun等[30]将ZK60镁合金浸泡在不同pH值的PBS溶液中,3D腐蚀形貌如图4所示。pH值为5.2时,表面存在明显的局部腐蚀,pH值升高,局部腐蚀程度减弱,pH值为9.0时,呈均匀腐蚀形貌,且腐蚀深度降低。
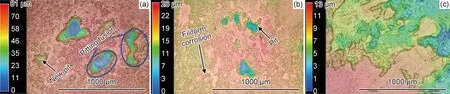
图4 ZK60在pH值为5.2(a),7.4(b)和9.0(c)的PBS腐蚀液中浸泡6 h后的3D腐蚀形貌[30]Fig.4 3D corrosion morphologies of ZK60 immersed in PBS corrosion solution with pH value of 5.2(a),7.4(b) and 9.0(c) for 6 h [30]
2.2.2 流场与应力
人体体液处于流动状态,且不同部位流速也会不同,动态腐蚀环境显著影响镁合金降解速率[31]。研究者对纯镁多孔支架研究发现,因流场作用,流体将降解产物从镁表面带走,且流体对金属表面存在不同程度的剪切应力,提高了降解速率;不同流速影响程度存在差异,多孔镁支架在流场作用下腐蚀速率是静态腐蚀环境下的7倍[32]。Koo等[33]研究了AZ31镁基支架在静态和动态环境中的降解行为,降解形貌如图5所示。静态浸泡支架表面光滑,降解速率较低,动态测试的支架表面有更多的降解产物层覆盖,表明降解率更高。静态浸泡降解速度最慢,而动态生物反应器中螺旋支架(0%膨胀)降解速度最快。

图5 支架降解前(2D截面图)(a)和静态、动态浸泡3天后的micro-CT图像(b)[33]Fig.5 Micro-CT images of scaffolds before degradation (2D cross-section)(a) and after static and dynamic soaking for 3 days(b)[33]
镁合金作为生物医用植入材料在人体服役过程中除了接触具有腐蚀性的人体组织液之外,同时还承受力的作用。在外加应力作用下,腐蚀产生的产物膜发生破裂,新的基体裸露于腐蚀液中,形成“大阴极-小阳极”,且应力集中于裂纹尖端,裂纹尖端处无法再次钝化,加速了阳极溶解,原理如图6所示[34]。镁合金的腐蚀对应力敏感,尤其含Al镁合金,应力会加速镁合金的应力腐蚀开裂,导致植入体过早丧失力学完整性,可能突然断裂,隐患巨大,中途取出过程繁琐,还会造成周边组织炎症等后果。
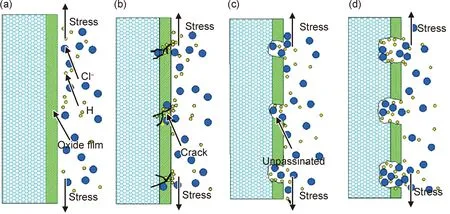
图6 膜破裂理论示意图[34](a)氧化膜形成;(b)氧化膜破裂(Cl-或拉力导致);(c) 基体溶解(加速H进入);(d) 加速基体溶解Fig.6 Schematic diagram of membrane rupture theory[34](a)oxide film formation;(b)oxide film rupture (caused by Cl- or tension);(c)matrix dissolution (accelerated H entry);(d)accelerated matrix dissolution
3 提高生物医用镁合金自身耐蚀性能的方法
3.1 高纯化
镁合金的腐蚀与杂质元素及其容限量有关,杂质越多,腐蚀越剧烈[35]。Fe与Mg之间的电位差较大,Fe会在结晶时于晶界析出,与镁基体形成微电池,牺牲Mg阳极,加快腐蚀。Ni,Cu与Mg形成分布在晶界的高电位Mg2Ni/MgCu2化合物,增大了镁的自腐蚀倾向,加剧镁合金的腐蚀。高纯化是提高合金耐蚀性能的重要手段,主要途径有选择高纯度原材料,加入精炼剂除渣,添加Mn,Zr等元素减少杂质等。Prasad等[36]在镁合金中加入0.4%(质量分数,下同)Zr,Zr与Fe,Ni等杂质元素形成难熔沉淀物,将杂质Fe在镁合金中的溶解度降至1×10-6,大幅度提高了镁合金的纯净度,改善了镁金属的耐蚀性。
3.2 合金化
合金化是改善镁合金耐蚀性的主要方法之一。加入合适的合金元素,可以细化晶粒,改善第二相的种类、形态、大小和分布,降低合金在腐蚀介质中的腐蚀倾向;部分合金元素在腐蚀介质中还会形成钝化膜或形成可以提供有效保护的腐蚀产物层,抑制腐蚀的进一步扩展[37]。
早期主要研究的是Mg-Al-Zn系列,如AZ91,AZ91D,AZ31以及WE43等商用镁合金。Song[38]比较了AZ91和商业纯镁在Hank’s溶液中的腐蚀降解速率,AZ91腐蚀速率约为商业纯镁的1%。但因为过高的铝浓度对神经元和成骨细胞有害,以及WE系列合金中的重稀土元素对人体具有潜在的危害[39]。医用镁合金在合金化元素选择上更倾向于人体本身含有的微量元素或必需元素,也包括一些生物安全范围内的其他元素。Mg-Zn,Mg-Ca,Mg-Mn,Mg-Sr以及Mg-RE等低合金含量的生物相容性良好的医用镁合金系列逐渐被开发。
Mn,Zn是人体必需微量元素,可细化晶粒,且可将Fe,Ni等杂质元素转变为金属间化合物沉淀析出,Mn的加入还可能形成含Mn氧化物膜,充当了防止Cl-渗透的屏障,在生物医用镁合金中广泛使用[12,40-43]。Liu等[40]研究了Mn对挤压态Mg-0.5Bi-0.5Sn镁合金显微组织和腐蚀行为的影响。Mn的添加导致平均晶粒尺寸减小,在模拟体液中,仅添加0.5% Mn时,合金腐蚀速率由0.59 mm/a降低到0.22 mm/a,相对未添加Mn元素的合金,合金呈现更均匀的腐蚀形貌,相对均匀的腐蚀形貌也为腐蚀产物膜的形成和破坏之间发生动态平衡提供了有利条件,阻碍了腐蚀离子对镁基体的进一步腐蚀,后期腐蚀速率明显下降并趋于稳定。Cai等[41]比较了不同Zn含量的Mg-Zn二元合金耐蚀性的差异。加入1%的Zn即可显著细化合金晶粒,晶粒尺寸仅为纯镁的28%,加入超过5%时,细化作用就不再增加,晶界处的MgZn析出相逐渐增加。在1%~5%范围内,随着Zn含量的增加,腐蚀速率降低。但Zn过量添加超过7%时导致作为阴极的网状MgZn金属间化合物加速了基体镁的微电偶腐蚀。Wei等[42]研究了不同Zn含量对Mg-xZn-0.2Ca-0.1Mn(0.25%,0.5%,1.0%,2.0%)镁合金显微结构、力学及耐腐蚀性能的影响,随着Zn含量的增加,合金晶粒得到细化,第二相增多,腐蚀速率先降低后升高。在Zn含量为1%时,合金均匀腐蚀,且腐蚀速率最低。
Ca,Sr均为人体所需功能元素,可促进骨骼生长。适量的Ca,Sr可细化晶粒,抑制晶界化合物,降低第二相和基体的电位差,增加氧化膜层致密性,起到阻碍腐蚀的作用,提高镁合金的耐蚀性[1,11,43-46]。Zhang等[43]在Mg-2Zn-0.2Mn合金中加入不同含量(0%,0.38%,0.76%,1.10%)的Ca,随着Ca含量的增加,晶粒尺寸显著减小,含量为0%和1.10%Ca时,平均晶粒尺寸为200 μm和35 μm,减小约一个数量级,同时,金属间化合物的体积分数也显著增加。在模拟体液中浸泡发现腐蚀速率随Ca含量的增加先下降后上升。添加0.38%的Ca时,由于合金晶粒得到一定程度细化,且第二相体积分数较小,表面钝化膜致密,表现出最好的耐腐蚀性。然而,0.76%和1.10%含量的镁合金因过多的Ca导致了镁钙的第二相体积分数的增加,形成了微电偶腐蚀,局部腐蚀加剧,腐蚀速率增高。去除腐蚀产物前后形貌如图7所示[43]。类似的结果也发生在纯镁和Mg-0.8Ca的腐蚀比较中[44],将铸态Mg-0.8Ca合金与纯镁在Hank’s平衡盐溶液中进行腐蚀实验,结果显示,Mg-0.8Ca腐蚀速率为1.08 mm/a,约为纯镁同等情况下的腐蚀速率的3倍,Ca的加入导致合金中阴极相Mg2Ca在晶界处析出,加剧了合金的腐蚀。

图7 铸态Mg-Zn-Mn-xCa合金去除腐蚀产物后的3D形貌[43](a)0Ca;(b)0.38Ca;(c)0.76Ca;(d)1.10CaFig.7 3D morphology of as-cast Mg-Zn-Mn-xCa alloy after removal of corrosion products[43](a)0Ca;(b)0.38Ca;(c)0.76Ca;(d)1.10Ca
Bornapour等[45]将不同Sr含量(0.3%,0.5%,0.7%,1%,1.2%,1.5%,2%,2.5%)的Mg-Sr合金浸泡在模拟体液中,相对商业纯镁来说,Mg-Sr合金腐蚀速率随着Sr含量的增加先下降后上升,Mg-0.5Sr合金的腐蚀速率最低。Mg-0.5Sr合金在SBF中降解3天后,在Mg-0.5Sr合金与腐蚀产物的界面上可能形成一薄层的羟基磷灰石的Sr取代层,该界面层稳定了合金的表面,并随着时间的推移降低了其降解速率。Wen等[46]向Mg-1Zn-1Sn合金中添加了不同含量的Sr(x=0%,0.2%,0.4%和0.6%),研究在Hank’s溶液中的降解情况。少量Sr对铸态合金显微组织有明显的细化作用,随着Sr的增加,分布在基体中的第二相增加。电化学测得的腐蚀速率分别是0.24,0.18,0.31 mm/a和0.39 mm/a,0.6Sr显示出最快的H2释放和最大的pH值变化,与浸泡失重得出的规律一致,Sr的过量(>0.2%)恶化了合金耐腐蚀性。所有含Sr的Mg-1Zn-1Sn基合金都表现出良好的细胞相容性,甚至促进了细胞增殖。其中,0.2Sr合金促进细胞增殖的能力也最强。
稀土镁合金因其少量加入即可对镁合金的微观组织及性能起到明显影响而受到研究者的重视,常用于生物医用镁合金研究的稀土元素有Nd[47-48],Y[23,49],Gd[21,50]等。JDBM(Mg-Nd-Zn-Zr)是上海交通大学开发的一系列合金总量较低的不含Al的轻稀土镁合金[47-48],该系列镁合金中的部分合金具有与商用的AZ系列及WE系列相当甚至更优的力学性能(均在200 MPa以上),同时其耐蚀性也比AZ31及WE43更好,腐蚀速率约为0.125 mm/a[47],也具有更好的体外及体内生物相容性。Ren等[49]研究了铸态Mg-2Zn-0.5Ca-xY(0%,0.5%,1%,1.5%,2%)系列合金的显微组织和生物腐蚀行为,合金腐蚀形貌表明,浸泡实验后腐蚀不均匀,腐蚀层表面形成大量裂纹。由于稀土元素Y的加入,合金的耐蚀性提高,其中Mg-2Zn-0.5Ca-1.0Y合金的耐蚀性最好。当Y含量小于1%时,合金耐蚀性随Y含量的增加而提高,这是因为Y含量的增加使合金的晶粒细化。Y在合金中添加越多,会导致第二相MgY的形成,形成许多腐蚀微电池,加速了合金的腐蚀。在铸态Mg-2Zn-0.5Zr合金中添加了不同含量的稀土Gd[50],低Gd含量(0%~1%)时,合金第二相分布均匀,Gd的加入稳定了降解层,降低了合金降解速率。然而,当Gd添加到2%时,沿着晶界形成了大而厚的第二相,因电化学腐蚀而提高了合金腐蚀速率。
随着合金化研究的深入,通过合金化改善镁合金腐蚀性能的规律逐渐显现,但它不是单纯的单向变化,它是受到多种情况共同影响。加入合金含量并非越多越好,甚至从众多研究结果来看,生物医用镁合金合金化只需少量,合金化含量过高反倒会恶化腐蚀性能。综合考虑包括腐蚀降解、力学以及生物安全性等生物医用镁合金的综合性能,加入的元素越多,医用镁合金性能判定的不确定因素就越多,生物安全性评估也面临更大的挑战。研究者们仍在不断探索安全合适且高效改善镁合金性能的合金元素种类及其最优含量组合。
3.3 制备加工
3.3.1 快速凝固
快速凝固过程中,镁合金的各种传输现象减弱,晶粒组织的长大受到限制,易形成超细的晶粒度,无偏析或少偏析的微晶组织和亚稳相,从而提高镁合金的耐蚀性,并将有害元素限制在危害性较小的区域。同时,快速凝固能提高镁合金的微观组织和成分均匀性,避免局部微电池作用。Shuai等[51]采用激光快速凝固法制备了ZK60,在组织中发现簇状细化的枝晶及均匀的等轴晶。激光快速凝固使合金晶粒细化,组织均匀化,耐蚀性增强。Liao等[52]通过旋转水流气体雾化法制备了Mg-Al-Mn-Ca合金,发现快速凝固制备的合金晶粒得到了细化,第二相分布均匀,因此具有优异的耐腐蚀性。
3.3.2 粉末冶金
相对于传统的铸造加工方法,粉末冶金法制备镁合金也是一种制作医用金属植入体的优异工艺。粉末冶金制得的镁合金具有细小的晶粒,均匀的第二相,往往其性能也比铸造法制得的更加优异。Aboudzadeh等[53]通过粉末冶金方法制备Mg-5Zn-0.3Ca/nHA生物复合材料,结果显示,生物活性nHA促进稳定的磷酸盐和碳酸盐表面沉积层的形成,从而提高材料的耐蚀性。Yan等[54]通过粉末冶金制备了可生物降解镁合金Mg-5Zn,发现制得的合金组织晶粒细小,尺寸数百纳米的第二相均匀分布,促进了浸泡初期均匀光滑的腐蚀产物层的形成。腐蚀产物层在含氯水溶液中更稳定,可直接形成并快速修复,有效保护基体不受进一步腐蚀。
3.3.3 热处理
热处理对镁合金性能影响显著,不同热处理方式及工艺参数对合金的影响结果也可能不同。常见镁合金热处理工艺有固溶处理(T4)、时效处理(T5)、固溶+时效处理(T6),其目的是改善合金组织结构,从而提高合金的耐蚀性,见表1[55-60]。表1为不同合金经T4,T5或T6处理后镁合金的耐蚀性能变化,处理后,合金自腐蚀电位升高,电流密度降低,合金的耐蚀性能有效提高。
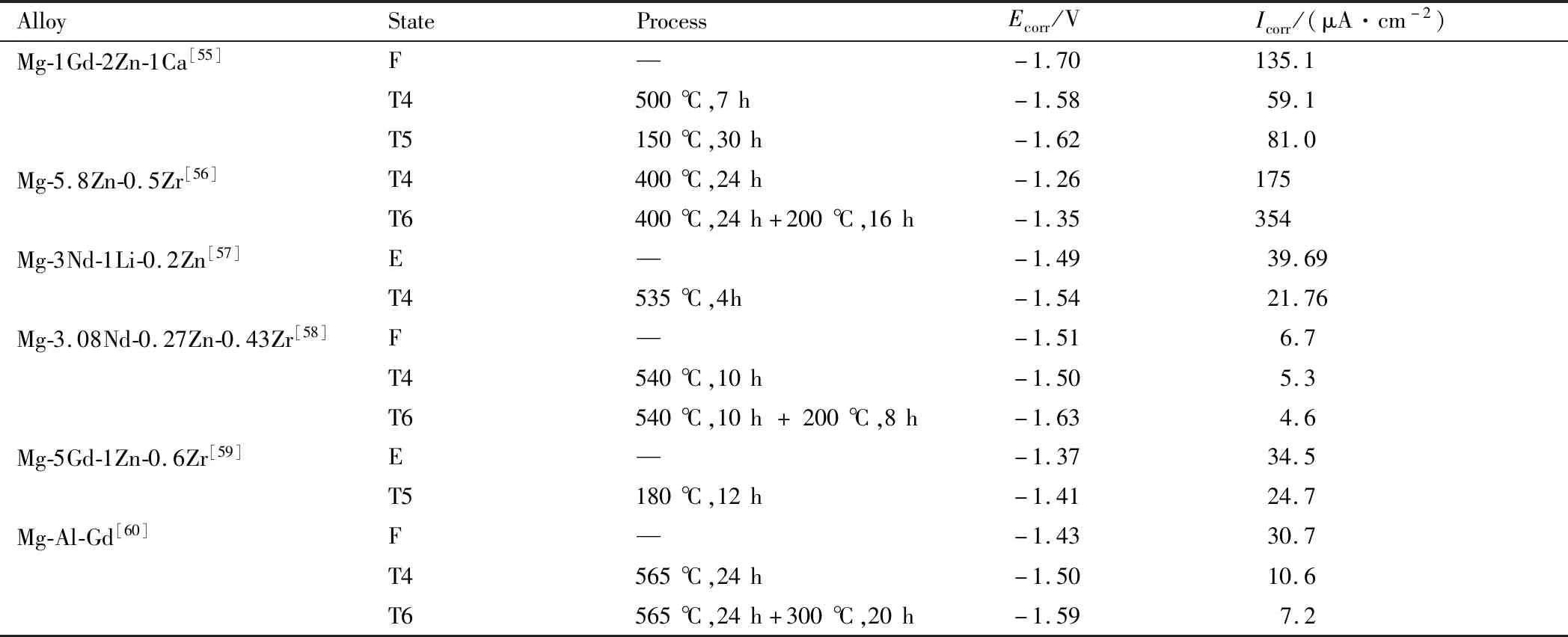
表1 经过不同热处理工艺的镁合金的自腐蚀电位和自腐蚀电流密度[55-60]Table 1 Corrosion potential and corrosion current density of magnesium alloys with different heat treatment processes[55-60]
3.3.4 变形加工
挤压、轧制、拉拔等变形加工是改善镁合金组织,提高合金耐蚀性能的重要方法。变形加工能够使镁合金的晶粒尺寸明显减小,第二相减少或消失,基体中存在部分细小的析出相,并且组织均匀,其合金的耐蚀性能也会明显提升。Zhang等[61]对Mg-Nd-Zn-Zr合金进行了一次挤压和二次挤压,发现经过二次挤压的合金发生了完全动态再结晶,组织细小均匀,第二相分布更为均匀,二次挤压的合金耐蚀性优于一次挤压。为进一步细化晶粒,等通道角挤压(ECAP)、高压扭转(HPT)、多轴变形(MAD)等变形加工也被应用到镁合金的加工中。Chen等[62]研究了ECAP对Mg-2Zn-xGd-0.5Zr(x=0%,0.5%,1,2%)合金组织生物降解性能的影响,结果表明,ECAP改变了合金的第二相分布和晶粒细化,一定程度上改善了合金的耐腐蚀性能,但进一步增加挤压孔型会增加晶界,加剧合金的电偶腐蚀,合金的耐蚀性能降低。Martynenko等[63]用ECAP和MAD分别对WE43镁合金进行处理,将晶粒细化在0.6~1 μm的范围内,ECAP和MAD处理后的合金腐蚀速率均明显降低并且呈现均匀腐蚀,改善了WE43合金体外耐腐蚀性。此外,Gao等[64]研究发现,采用HPT法制得的Mg-Zn-Ca合金的第二相成为纳米级颗粒,均匀分布在晶粒内部,并且HPT处理后的试样由于第二相的均匀分布而呈现均匀腐蚀。
4 表面改性
除了改变合金自身耐蚀性外,合金表面改性也是提高医用镁合金耐蚀性能的重要手段。适当的表面改性方式可以不同程度改善镁合金的耐腐蚀性能,同时,还可以起到提高合金的生物相容性和生物活性、载药、抗菌、自修复、自洁等功能性作用[65-66]。目前医用镁合金领域已经发展了多种表面改性技术,根据表面改性手段的不同,可将表面改性涂层分为机械改性涂层和非机械改性涂层。
4.1 机械涂层
机械涂层是对表面进行特定的塑性变形处理而形成与原始表面不同的结构层,并不引入其他物质。机械涂层主要是经过喷丸或机械研磨处理得到。与化学涂层相比,机械层与基材的结合力更好。
Wu等[67]对Mg-4Y-3.3RE(Nd,Gd)-0.5Zr镁合金骨板进行了高能喷丸处理,在合金表面制备了原位表面纳米晶微结构,提高了表面钝化膜Mg(OH)2的致密性,合金腐蚀速率降低了约30%,改善了合金的耐蚀性。也有研究与此相反,Peral等[68]对AZ31镁合金表面进行了喷丸处理,结果显示经喷丸处理后的合金的腐蚀速率却远高于未喷丸处理的合金,进一步研究发现是由于表面粗糙度及高密度晶格缺陷造成。Mhaede等[69]对AZ31进行了低强度喷丸处理后,又利用电沉积磷酸盐涂层改善了合金表面粗糙度,合金耐腐蚀性能提高。
表面机械研磨处理(SMAT)被认为是一种有效的表面纳米结晶技术,它可以在不改变材料化学成分的情况下将表面晶粒细化至纳米级,并形成梯度纳米结构。研磨处理对镁合金耐蚀性能的提高有显著作用,处理后的合金组织细小均匀,表面相对更为平滑,腐蚀速率明显降低,且可以改变涂层与基材之间的结合力和附着力。Laleh等[70]采用不同直径的钢球对AZ91D镁合金进行SMAT工艺,用2 mm钢球处理的合金腐蚀速率仅为未处理合金的6.2%,腐蚀速率显著降低。
4.2 非机械涂层
非机械涂层又可根据涂层形成方式差异分为转化涂层和沉积涂层两类。考虑到生物安全性,增加的表面涂层还需具备足够的生物相容性和无细胞毒性。
转化涂层是镁基材与涂层溶液之间的化学反应形成的原位涂层。常见的转化涂层有稀土转化涂层、氟化涂层、磷酸盐转化涂层、微弧氧化涂层、水热处理等。
稀土转化膜主要使用Y,Gd,Nd,Sm,Pr等稀土化合物。转化膜通过电化学作用产生钝化,且致密膜层增强了屏蔽效果,阻碍了阳极基体的溶解。表2列举了一些稀土转化膜对镁合金耐腐蚀性能的影响[71-77]。

表2 稀土转化膜对镁合金耐腐蚀性能影响[71-77]Table 2 Effect of rare earth conversion film on corrosion resistance of magnesium alloys [71-77]
氟化涂层和磷酸盐涂层是通过与镁及镁合金表面进行化学反应生成,这类涂层具有良好的生物相容性和化学稳定性,一定程度阻碍了腐蚀向基体发展。Barajas等[78]使用体积分数为4%和10%的氢氟酸对AZ31合金进行化学转化处理,在合金上形成了羟基氟化镁层,氟化处理试样的腐蚀电流密度降低约3个数量级,提高了合金耐蚀性,且生物相容性良好。Zeng等[79]在AZ31合金表面上制备了两种磷酸盐转换涂层,Zn涂层和Zn-Ca涂层均比基体合金具有更高的耐腐蚀性,花状Zn-Ca涂层比棒状Zn涂层更致密,显著降低了腐蚀电流密度。微弧氧化(MAO)形成的致密涂层对基材起到保护作用,具有合适的孔径、密度及表面粗糙度的涂层会阻挡腐蚀离子接触基体表面,还可充当中间层以改善复合涂层的结合力[80]。Lin等[81]在纯镁上制备了添加Li的MAO涂层,结果表明,带有涂层的合金耐蚀性明显高于纯镁,添加Li减少了MAO涂层上的微孔和裂纹数量从而具有更好的耐蚀性。
沉积涂层是基于附着力、静电相互作用的异位涂层。主要有电沉积、共沉淀、物理气相沉积、电泳沉积、离子注入等。Wu等[82]通过物理气相沉积在AZ31镁合金上制备铝涂层,具有Al涂层的合金显示出比未表面改性的合金更高的耐腐蚀性。Zheng等[83]采用电沉积法在镁合金表面上构建超疏水涂层,样品具有较好的耐腐蚀性,其腐蚀电流密度远低于镁合金基体的腐蚀电流密度。Alaei等[84]采用电泳沉积法制备了壳聚糖生物活性玻璃纳米复合涂层,提高了合金的耐蚀性。Tayyaba等[85]通过共沉淀制备了具有HA涂层的ZK60镁合金,HA涂层改变了合金自由腐蚀电位,同时为电子和离子在界面处的流动提供了物理屏障。腐蚀前72 h内,有涂层的腐蚀速率仅为无涂层的20%左右,后期腐蚀速率也明显低于无沉积涂层的合金。Wang等[86]在Mg-Gd-Zn-Zr合金上注入Nd离子,在注入层中形成了由Nd2O3,Gd2O3和金属Nd组成的混合结构层。改性层中的Nd2O3和Gd2O3在水性介质中相对稳定,阻止Cl-向内传输,适当的剂量下,提高合金的耐腐蚀性,图8为合金注入前后腐蚀产物层截面图,可以发现离子注入后腐蚀产物层厚度变小,且注入前基体均匀腐蚀,离子注入后样品仍为均匀腐蚀。
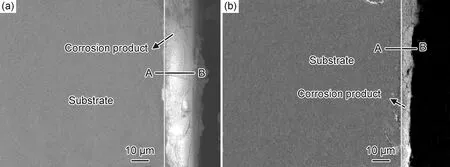
图8 Nd离子注入前(a)后(b)Mg-Gd-Zn-Zr合金的腐蚀截面图[86]Fig.8 Cross-section images of Mg-Gd-Zn-Zr alloy before(a) and after(b) Nd ion implantation[86]
然而,表面处理并不能从根本上解决局部腐蚀的问题,如图9(b),(c),经过了表面碱化及氟化处理后,因合金本身呈现局部腐蚀,表面改性后的骨板仍为局部腐蚀,在服役过程中无法保证力学完整性[87]。因此,提高镁合金植入材料耐腐蚀性需要选择自身具有均匀腐蚀行为的镁合金,进而加上表面改性来进一步提高镁合金总体耐蚀性,达到标本兼治的效果。

图9 LAE442镁合金骨板腐蚀前以及在SBF中浸泡2周后的μCT 3D图片[87](a)腐蚀前;(b)未经表面处理;(c)在NaOH溶液中预制Mg(OH)2层处理;(d)MgF2涂层处理Fig.8 μCT 3D images of magnesium alloy bone plates before corrosion and soaked in SBF for 2 weeks[87](a)before corrosion;(b)without surface treatment;(c)prefabricated Mg(OH)2-layer treatment in NaOH solution;(d)MgF2 coating
5 未来发展趋势
镁合金因其可降解性、良好的生物相容性、生物力学相容性等优势而被认为是一种很有前途的生物可降解植入材料,成为医用金属材料研究热点之一。然而,镁合金降解过快和局部腐蚀等问题限制了其在承重部位的临床应用。因此,需要阐明镁合金在体内复杂介质及应力作用下的降解规律与机理,从镁合金自身腐蚀性能角度出发,在保证生物相容性、安全性的基础上实现镁合金降解速率与降解方式的可控性,并结合表面改性技术,进一步提高耐蚀性能。主要发展趋势如下:
(1)基于生物安全性和自身耐蚀性,通过低合金化、高纯化、细晶化等手段研发出具有优良耐蚀性能和均匀腐蚀行为的高性能生物医用镁合金。
(2)以具有均匀腐蚀的生物医用镁合金为基体,开发具有耐蚀性、抗菌性、载药性等多功能表面涂层技术,确保表面改性后合金仍呈现均匀降解性,从而实现其服役期间力学完整性和功能性。
(3)结合体内服役环境,综合考虑腐蚀介质、流场、应力等因素,研究镁合金在多种因素共同作用下的降解行为与机理,作为承重骨固定及心血管支架材料,需考虑应力腐蚀等问题,从而拓宽其应用范围。
