青蒿琥酯诱导ABC型弥漫大B细胞淋巴瘤ROS促进细胞凋亡
2021-12-22谭洁文南方医科大学顺德医院佛山市顺德区第一人民医院广东佛山528300
熊 丹,谭洁文,吴 亮,刘 香,杨 辉(南方医科大学顺德医院,佛山市顺德区第一人民医院,广东佛山 528300)
弥漫性大B 细胞性淋巴瘤(DLBCL)是一类最常见的非霍奇金淋巴瘤(NHL)类型,具有不同生物学、临床表现和治疗反应的异质性疾病[1],同时其高发病率和死亡率在临床上引起广泛的关注。肿瘤患者常表现为单个或多个淋巴结或结外部位快速生长的肿瘤,接受化疗可显著提高患者生存率。然而有1/5~1/4患者出现复发[2]。基于基因表达谱(GEP)的差异,DLBCL 主要分为生发中心B 细胞样DLBCL(GCBDLBCL)和活化B细胞样DLBCL(ABC-DLBCL)两种不同的亚型。尽管近年来利妥昔单抗的出现一定程度上改善DLBCL 患者的生存状况,但是ABC-DLBCL对现有经典的CHOP方案化疗效果仍然较差,且利妥昔单抗并不能克服这种不良预后,更多的患者表现为原发耐药。因此,寻找一种更有效的抗DLBCL 的治疗方法或药物至关重要。
青蒿琥酯(ART)是青蒿素的半合成类似物,从甜艾草植物中提取出用来治疗疟疾的一线药物,在传统中医药领域中的应用有多年的历史。现在青蒿琥酯作为抗肿瘤药物,其主要的作用是通过诱导肿瘤细胞产生活性氧(ROS)导致细胞发生死亡[3-4]。最新的研究表明青蒿琥酯能够影响肿瘤生长、增殖,使肿瘤细胞发生凋亡和坏死影响细胞的代谢过程[1]。本研究将结合现有的研究结果,及当前抗弥漫大B 细胞淋巴瘤细胞研究的新热点,探讨青蒿琥酯是否具有诱导人ABC 型弥漫大B 细胞淋巴瘤细胞株OCI-LY3 细胞凋亡的作用及其潜在的分子机制,为弥漫大B 细胞淋巴瘤治疗提供新靶点、新思路,同时也为青蒿琥酯相关药物开发及广泛应用提供理论支撑。
1 材料和方法
1.1 实验主要材料
人ABC 型弥漫大B 细胞淋巴瘤细胞株(OCILY3)(中国科学院上海细胞库),青蒿琥酯(ART),青霉素和链霉素(sigam公司);IMDM、PBS 和FBS(Gib‐co 公 司);Cell Counting Kit-8 试 剂 盒(APEXBIO 公司);Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);总RNA 抽提试剂TransStart® Tip Green qPCR SuperMix 试 剂 盒 和TransScript®First-Strand cDNA Synthesis SuperMix试剂盒(北京全式金生物技术有限公司);活性氧检测试剂盒(碧云天);Bcl-2单克隆抗体、Caspase-3单克隆抗体和GAPDH单克隆抗体(CST 公司)。高速冷冻离心机、全光谱分析酶标仪、细胞培养箱均购自美国公司;生物安全柜购自新加坡ESCO 公司;实时荧光定量PCR 仪、全自动成像仪购自美国BIO-RAD;流式细胞仪购自美国BD;倒置显微镜购自德国徕卡斯公司。
1.2 方法
1.2.1 细胞培养 用含10%(体积分数)胎牛血清的IMDM培养基,包含有双抗溶液(青霉素G 100 IU/mL、链霉素100 IU/mL)于37 ℃、5% CO2条件下培养至对数生长期。
1.2.2 ART 对OCI-LY3 细胞活力的影响 取对数生长期OCI-LY3细胞并调整细胞密度至1×104个/mL,每孔100 μL 接种于96孔板,接种24 h后,设置空白对照组,分别用含1、5、10、15、20、25 μmol/L 青蒿琥酯培养基替换原有培养基,每个浓度做3 个复孔。在37 ℃、5%CO2的培养箱中培养24 h后,每孔加入CCK-8溶液10 μL,于培养箱中反应2 h,酶标仪检测各组细胞在450 nm波长处的光密度(OD)值,并计算细胞活力。
1.2.3 倒置显微镜观察OCI-LY3 细胞形态的变化取对数生长期的OCI-LY3 细胞株接种于6 孔细胞培养板中,每孔细胞数调整为5×105个,每孔加入1 mL相应的含有不同浓度青蒿琥酯的培养基,使青蒿琥酯终浓度分别为10 μmol/L 和20 μmol/L,并设立未加药的空白对照组,每种浓度设3 个复孔。置于37 ℃5% CO2培养箱中继续培养24 h 后,倒置显微镜下观察细胞生长状态及形态学改变。
1.2.4 OCI-LY3 细胞ROS 含量的测定 按试剂盒说明书进行操作,取对数生长期的OCI-LY3 细胞株接种于6 孔板中,培养24 h 后,根据组别设置分别加入青蒿琥酯终浓度分别为10、20 μmol/L的培养基,并设立未加药的空白对照组;经过药物作用24 h 后,按照1:1 000 用无血清培养液稀释DCFH-DA,加入收集细胞中使终浓度为10 μmol/L,37 ℃细胞培养箱内孵育20 min,用流式细胞仪检测ROS表达情况,采用flowjor软件分析实验数据。
1.2.5 Annexin-V FITC/PI 双 染 法检 测OCI-LY3 细胞凋亡 按试剂盒说明书进行操作,取对数生长期的OCI-LY3细胞株接种于6孔板中,培养24 h后,根据组别的设置分别加入青蒿琥酯终浓度分别为10、20 μmol/L的培养基,并设立未加药的空白对照组;药物作用24 h后,收集细胞;使用预冷的PBS 洗涤细胞2 次(离心300 g,5 min);加入200µL的Binding Buffer悬浮细胞;加入5µLAnnexin V-FITC混匀后,加入5µL PI(Propidium Iodide),混匀;室温、避光、反应15 min,用流式细胞仪检测细胞凋亡率的情况,采用flowjor软件分析实验数据。
1.2.6 Real time PCR 法检测凋亡相关基因在mRNA表达水平 实验细胞及分组按照“1.2.4”中设置并处理细胞,用试剂盒提取细胞总RNA,分光光度法测定其在260~280 nm 的浓度和纯度。根据TransScript®First-Strand cDNA Synthesis SuperMix 试剂盒合成DNA 第一链逆转录合成cDNA,cDNA 第一链合成体系20 µL:取灭过菌且无核酸酶的0.2 mL PCR 管,依次加入如下组份:RNA(2 µg) 2 µL、2×TS Reaction Mix 10 µL、Primer Oligo dT(18) 1 µL、无核酸酶的双蒸水至总体积20µL;42 ℃保温15 min得到cDNA;往上步骤中的0.2 mLPCR管依次加入如下组分:前引物和后引物(10 μmol/L)各0.4 µL、2×TS Top/Tip Green qPCR SuperMix 10 µL 无核酸酶双蒸水至总体积20 µL;轻轻混匀后,然后1 000 r/min离心20 s;行PCR扩增:反应参数:94 ℃30 s,然后94 ℃,5 s,65 ℃15 s,72 ℃10 s,40个循环。PCR引物序列由上海生工生物司验证并合成,选择GAPDH为内参照,基因表达水平采用2-△△Ct计算。各基因引物序列见表1。

表1 引物序列
1.2.7 Western blot 法检测凋亡相关蛋白表达 实验细胞及分组按照“1.2.4”中设置并处理细胞,采用RAPI 裂解液进行细胞蛋白提取,通过BCA 法检测蛋白浓度,采用12%SDS-PAGE 胶进行电泳、转膜,5%脱脂奶粉封闭2 h,加入稀释的一抗Bcl-2、Caspase-3和GAPDH(1∶1 000)4 ℃孵育过夜,PBST 洗膜3 次,每次5 min,加入稀释的辣根过氧化物酶标记的二抗(1∶4 000),反应1 h,洗膜3 次,每次5 min,曝光。蛋白条带采用Quantity one 软件分析灰度值与GAPDH蛋白条带灰度值进行比较,分析待测蛋白表达水平。
1.3 统计学处理
采用SPSS 20.0 统计软件处理数据,计量资料以表示,组间差异采用One-way ANOVA分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度ART对OCI-LY3细胞活性的影响
在CCK-8 实验中,为探究ART 对弥漫大B 细胞淋巴瘤细胞的作用,采用1、5、10、15、20、25 μmol/L。结果显示,与空白对照组比较,ART 浓度≥10 μmol/L时,对OCI-LY3细胞具有显著抑制作用且呈浓度依赖性(P<0.05 或0.01),见图1。故后续实验选择低浓度为10 μmol/L,高浓度为20 μmol/L。
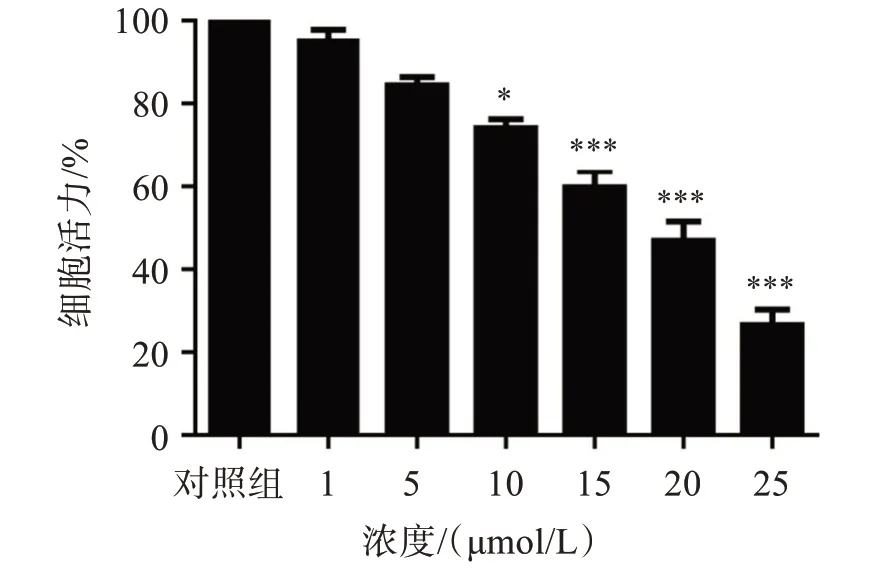
图1 不同浓度青蒿琥酯对OCI-LY3细胞增殖活性的影响
2.2 不同浓度ART对OCI-LY3细胞形态的影响
与空白对照组比较,10 μmol/L 的ART 处理能够显著抑制细胞聚集成团生长,并且20 μmol/L ART 浓度会进一步加剧这一现象,且细胞透亮度明显降低,可见部分细胞破碎,见图2,显示ART 能显著影响细胞体外生长状态,提示可抑制细胞增殖活性。

图2 青蒿琥酯对细胞形态的影响(200倍)
2.3 ART对OCI-LY3细胞ROS的影响
与对照组比较,10 μmol/L 的ART 处理细胞能够显著地促进细胞中ROS含量的增加(15.87±2.08)(P<0.01),而20 μmol/L ART 处理则进一步增加细胞ROS含量(26.61±1.53)(P<0.01),且随着ART 浓度的增加细胞内ROS也明显增加,见图3。
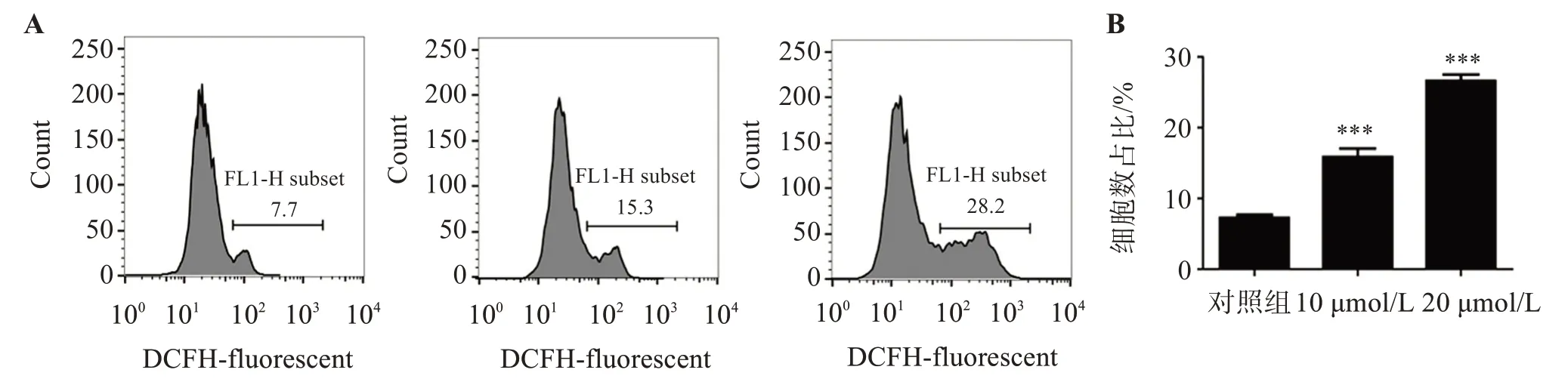
图3 青蒿琥酯对OCI-LY3细胞ROS含量的影响
2.4 ART对OCI-LY3细胞凋亡的影响
通过流式细胞术双染检测,与空白对照组相比较,浓度为10 μmol/L ART 导致细胞发生凋亡(P<0.01),20 μmol/L凋亡率更高(P<0.01),见图4。

图4 青蒿琥酯对OCI-LY3细胞凋亡的影响
2.5 ART对OCI-LY3细胞凋亡相关基因转录的影响
qRT-PCR 显示,与空白对照组比较,10 μmol/L ART 能够显著抑制抗凋亡基因bcl-2 的表达,同时促进凋亡基因caspas-3 表达(P<0.01),在20 μmol/L 更为显著(P<0.01),见图5。

图5 青蒿琥酯对OCI-LY3细胞Bcl-2和caspase-3基因表达的影响
2.6 ART对OCI-LY3细胞凋亡相关蛋白表达的影响
与空白对照组相比,10 μmol/L 抗凋亡蛋白Bcl-2表达显著降低,凋亡相关蛋白Caspas-3的表达则升高(P<0.05),以20 μmol/L更为显著(P<0.01),见图6。

图6 青蒿琥酯对OCI-LY3细胞Bcl-2和Caspase-3蛋白表达的影响
3 讨论
弥漫大B 细胞淋巴瘤是非霍奇金淋巴瘤中最常见的一种,为一组形态学、免疫表型、遗传学和临床表现都具有明显异质性的B 细胞性淋巴瘤。国内淋巴瘤病理学统计资料显示,DLBCL 在中国人NHL 中约占55%。近年来,CD20 单克隆抗体利妥昔单抗联合CHOP方案(美罗华+环磷酰胺+阿霉素+长春新碱+强的松,R-CHOP)的广泛运用,明显改善了DLBCL总体的预后。但是R-CHOP方案主要以改善GCB-DLBCL的预后为主,使得GCB-DLBCL 的5 年总生存率从46%升至80%,而对ABC-DLBCL 预后的改善仅从32%提高至50%。因此,如何进一步提高ABC-DLB‐CL的疗效是临床上亟待解决的问题。
肿瘤的发生发展与细胞增殖和凋亡密切相关,有效诱导细胞凋亡和抑制肿瘤细胞增殖已成为肿瘤治疗的新方向[5]。细胞凋亡涉及一系列基因的激活、表达和调控。Caspase-3 是肿瘤细胞凋亡的关键性分子,裂解的Caspase-3 是Caspase-3 的主要活性形式,在细胞中主要是促进细胞的凋亡。Bcl-2 参与多种肿瘤的发生发展,并发挥着重要的生物学功能[6]。Bcl-2是抗凋亡蛋白在细胞中发挥抑制细胞凋亡的功效,同时抑制Caspase-3 的活性发挥抑制凋亡的作用[7]。以往的研究发现,癌细胞由于代谢活跃而含有比正常细胞更高水平的ROS,这与细胞增殖、分化和细胞死亡密切相关。由于ROS 水平较高,癌细胞显示出更多的氧化应激损伤,这一特性可用作癌症治疗的药物靶点。线粒体的ROS 主要来源于呼吸链泄漏。细胞内升高的ROS 表达可能会损伤线粒体DNA,继而导致参与呼吸链的相关线粒体RNA 的转录受损,进一步增强了ROS 的产生[8]。最近的研究表明过表达ROS参与线粒体介导的凋亡并且细胞的氧化应激能够抑制抗凋亡蛋白Bcl-2 的表达[9]。本研究中在青蒿琥酯的作用下能够显著的促进ABC 型弥漫大B 细胞淋巴瘤细胞中ROS 的含量,并且细胞中抗凋亡蛋白Bcl-2在mRNA 和蛋白水平上也显著的降低,细胞凋亡水平显著上升,同时也发现细胞的中凋亡蛋白Caspase-3的表达明显增强。
多项研究表明,青蒿琥酯对多种人类肿瘤细胞发挥细胞毒性作用[10-11],并且临床研究报道其具有抗肿瘤效应。Zhang等[12]的研究揭示青蒿琥酯能够发挥抗泌乳素瘤活性通过抑制细胞线粒体的代谢功能诱导细胞凋亡。最新的研究表明青蒿琥酯能够抑制Wnt信号通路抑制肠道肿瘤的发生发展[13],同时也有报道其参与细胞的一种全新的死亡方式铁死亡[14]。本研究结果表明,青蒿琥酯能够诱导ABC 型弥漫大B 细胞淋巴瘤细胞中ROS 表达,并且抑制细胞增殖促进细胞凋亡,这与Zhou等[15]的研究结果是相一致的。
综上所述,青蒿琥酯能够显著抑制ABC 型弥漫大B细胞淋巴瘤细胞的增殖,并诱导细胞ROS的产生同时促进其凋亡,下调抗凋亡基因Bcl-2 表达和上调促凋亡基因caspase-3 mRNA 和蛋白水平的表达,可为青蒿琥酯应用于ABC 型弥漫大B 细胞淋巴瘤的临床治疗并改善ABC-DLBCL预后提供实验理论依据。
