间接3D打印制备Ti/HAp复合材料的结构与性能
2021-12-22刘晏军刘业谭彦妮
刘晏军,刘业, 2,谭彦妮
间接3D打印制备Ti/HAp复合材料的结构与性能
刘晏军1,刘业1, 2,谭彦妮1
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 深圳升华三维科技有限公司,深圳 518132)
采用离子掺杂改性的方式制备不同铷(Rb)含量的羟基磷灰石(Rb-Hydroxyapatite,Rb-HAp)粉末,然后用间接3D打印法制备Ti/Rb-HAp复合材料,对该材料的形貌和物相组成进行分析,测定材料的力学性能,并通过体外细胞培养和细胞增殖与分化实验,研究材料的生物学性能。结果表明:Ti/Rb-HAp复合材料的孔隙率较高,多孔结构有利于新骨组织向内生长和体液的传输。Rb的加入可提高Ti/HAp复合材料的抗弯强度和抗压强度,并且抗压强度随Rb含量增加而小幅提高。与纯Ti相比,Ti/Rb-HAp复合材料可促进MG-63细胞的增殖和ALP活性,具有良好的细胞相容性。浸泡在模拟体液中,Ti/Rb-HAp复合材料表面形成致密的磷灰石层,表明该材料具有优异的生物活性。
钛/羟基磷灰石复合材料;间接3D打印;生物相容性;力学性能;矿化性能
钛和钛合金具有良好的生物相容性和力学性能,广泛应用于人体硬组织修复[1−2]。但钛和钛合金的生物惰性使其植入假体很难和人体组织产生紧密的化学键合。另外,钛和钛合金的弹性模量比人体骨高很多,植入人体后容易产生“应力屏蔽”效应,影响植入材料附近骨组织的正常发育[3]。因此,作为骨植入材料,需进一步提高钛和钛合金的生物活性,以促进骨组织再生。羟基磷灰石(hydroxyapatite,HAp)作为人体骨骼的主要无机成分,具有优异的生物活性、生物相容性和骨传导性等,是一种应用前景广阔的生物陶瓷。但HAp的断裂韧性差,在生理条件下抗疲劳性能不足。将Ti与HAp复合能综合二者的优势,得到兼顾优异力学性能和高生物活性的复合材料。离子掺杂是进一步提高HAp生物学功能的重要方法,且HAp结构对于阳离子和阴离子取代都是灵活的,使增强HAp不同生物学功能和调节HAp晶体中酸碱位的数目成为可能。例如镁[4]、锶[5]、锂[6]、硅[7]、氟[8]等多种元素都被用作HAp的掺杂元素,以促进成骨细胞的增殖和分化。LIU等[9]研究含Li生物玻璃陶瓷(Li-bioglass ceramics,Li-BGC)的结果表明,生物材料释放的Li+具有促进血管生成和血管化的能力。铷(Rb)是人体内的一种天然物质和微量营养素,在医学中已有应用,例如:将RbCl用作超高速离心过程中的密度梯度介质以分离提取DNA和RNA;放射性铷用于血液放射性示踪标记;RbI取代KI用于治疗甲状腺肿大等[10]。Rb与Li同属于IA主族元素,且最外层电子数相同,具有相似的化学性质。所以,推测Rb也具有促进体外血管生成和体内新血管形成的能力。RbCl溶液具有对细胞友善的渗透压,常被用于验证Rb的生物学功能。OUYANG等[11]研究了RbCl对破骨细胞和成骨细胞平衡状态的影响,证实Rb具有促进成骨和促进血管生成的作用。HAp中掺Rb可提高生物学性能。
近年来,3D打印技术为生产定制化的人体组织替代材料提供了理想的平台,它可直接利用患者的计算机断层扫描三维模型制作替代品,而不受任何几何约束和模具限制。HAN等[12]采用选区激光融化技术成功制备Ti/HAp复合材料,相比于纯Ti,该材料的显微硬度大幅提升约80%,纳米硬度提升约50%。因此3D打印技术制备Ti/HAp复合材料具有良好前景。深圳升华三维科技有限公司于2016年提出一种间接3D打印新技术,即粉末挤出打印技术(powder extrusion printing),将“3D打印”与“粉末冶金”法相结合。既摆脱了模具的束缚,通过逐层打印在短短数小时内得到想要的模型生坯,又兼具传统粉末冶金的脱脂和烧结工艺,最终得到高性能金属部件。本文作者以Rb改性HAp粉末和Ti粉为原料,采用间接3D打印法制备Rb-HAp质量分数分别为3%和5%的Ti/Rb-HAp复合材料,分析复合材料的物相成分和微观结构,测试材料的抗弯和抗压强度,并研究其体外矿化性能和细胞相容性等,为研究3D打印Ti/HAp复合生物材料提供理论基础和实验依据。
1 实验
1.1 原材料
实验原料:四水合硝酸钙(Ca(NO3)2·4H2O)、磷酸氢二胺((NH4)2HPO4)、硝酸铷(RbNO3)、氨水(NH3·H2O)等,均为分析纯试剂,购于中国国药集团化学试剂有限公司。打印钛(Ti)粉购于中航迈特粉冶科技(徐州)有限公司。模拟体液(simulated body fluid,SBF)购于长沙雅尔试剂有限公司。
1.2 材料制备
1.2.1 Rb-HAp粉末的制备
按照物质的量比(Rb)/(Rb+Ca)分别为0、1%、3%、5%、7%、10%,以及(Rb+Ca)/(P)为5/3的比例,称量RbNO3、Ca (NO3)2·4H2O和(NH4)2HPO4。将Ca (NO3)2·4H2O和RbNO3混合溶解于去离子水中,得到100 mL含Rb和Ca的混合溶液。将(NH4)2HPO4溶解于100 mL去离子水中,制成含P的溶液。将含 (Rb+ Ca)的混合溶液和含P溶液均加热至60 ℃,磁力搅拌下在含P溶液中加入稀释的氨水使溶液pH值为9,再滴加到含(Rb+Ca)混合溶液中,搅拌以充分混匀,用稀释的氨水调节pH值为9。将反应体系在120 ℃的水热釜中保温12 h。反应完毕后分别用去离子水和无水乙醇清洗沉淀物数次,干燥后即得到Rb含量(摩尔分数,(Rb))分别为0、1%、3%、5%、7%、10%的Rb-HAp复合粉末。
1.2.2 Ti/Rb-HAp复合材料制备
前期对Rb-HAp粉末性能研究发现,与纯HAp粉末相比,Rb摩尔分数为0~5%的Rb-HAp表现出较强的生物学性能,Rb含量不宜过高,因此只选取(Rb)分别为0、1%、3%和5%的Rb-HAp粉末作为原料制备Ti/Rb-HAp复合材料。将原料Ti粉过325目筛网(筛孔直径45 μm),然后将Ti粉分别与HAp粉末、3%Rb-HAp与5%Rb-HAp复合粉末按照质量比为95:5的比例混合,用混炼机混合均匀,得到Ti/HAp、Ti/3%Rb-HAp、Ti/5%Rb- HAp等3种混合粉末。在混合粉末中加入一定量的黏结剂,用造粒机造粒,再用UPS-240S打印机制备成块状生坯(尺寸为30 mm×12 mm×6 mm)和圆柱形生坯(直径为8 mm,高度为12 mm)。采用水基脱脂法进行脱脂,将生坯浸泡在水中,在60 ℃恒温水浴锅中脱脂48 h以除去大部分有机黏结剂。脱脂后的样品在1 180 ℃左右高温烧结,得到最终的间接打印Ti/HAp和Ti/Rb-HAp复合材料。同时采用相同的间接3D打印工艺制备纯Ti,用于与Ti/Rb-HAp复合材料进行对比。
1.3 组织与性能表征
1.3.1 形貌观察
采用X射线衍射仪(XRD,D/ruax 2550 PC)分析Ti/Rb-HAp复合材料的物相组成,所用靶材为Cu,电压为40 kV,电流为250 mA。用金相显微镜(LEICA, DM4000M)观察材料表面的显微组织。用扫描电镜(SEM,FEI Quanta 250 FEG)观察Ti/Rb-HAp复合材料的弯曲断口微观形貌。将Ti/Rb-HAp复合材料浸泡在10 mL 37 ℃的模拟体液(simulated body fluid, SBF)中,分别在1、3、7和14天后取出,通过电感耦合原子发射光谱仪(ICP-AES,IRZS Advantage 1000)分析溶液中Ca2+、PO43−、Rb+的浓度。
1.3.2 密度与孔隙率测定
依据国标GB/T5163—2006,利用电子天平MSA324S-000-DU,采用排水法检测材料的密度和孔隙率。每组样品取3个平行样进行测定。
1.3.3 力学性能测试
将块状Ti/Rb-HAp复合材料试样在37 ℃恒温干燥箱中干燥养护3天,然后利用美国液压伺服动态系统 Instron 3369力学试验机,采用三点抗弯法测定Ti/Rb-HAp复合材料的抗弯强度。将Ti/Rb-HAp复合材料圆柱体试样在37 ℃的恒温干燥箱中干燥养护3天,然后通过美国液压伺服动态系统 Instron 3369力学试验机测定材料的抗压强度和压缩模量,加载速度为1.0 mm/min。
1.3.4 体外诱导矿化
将Ti/Rb-HAp块状复合材料浸泡在7.5 mL 37 ℃的SBF中,每48 h更换一次SBF溶液,分别在1、3、7天后用SEM观察材料的表面形貌。
1.3.5 细胞培养
采用MG-63细胞进行细胞实验。细胞种板前,培养皿中的MG-63细胞在细胞培养箱(湿度为95%,温度37 ℃,CO2含量(体积分数,下同)为5%)中生长。所用完全培养基由基础高糖培养基(high-glucose dulbecco’s modified eagle’s medium,DMEM)中加入胎牛血清(FBS)和双抗混合而成,其中胎牛血清和双抗的体积分数分别为10%和1%。根据细胞生长状态,每2~3天更换一次完全培养基。每天用荧光倒置显微镜观察MG-63细胞生长状态,当细胞数量达到实验要求时,采用0.25%的胰酶消化细胞。所有操作均在无菌超净台中完成,所用试剂、耗材和仪器均在高压釜中121 ℃消毒30 min,然后用紫外线照射20 min后使用。
1.3.6 细胞增殖与分化
将培养好的状态良好的MG-63细胞制成悬浮液,取100 μL加入到96孔板中,细胞密度为5×103个/孔,放入培养箱培养。24 h贴壁生长后吸出细胞液,将纯Ti和Ti/Rb-HAp小圆片放入孔板中,再加入完全培养基浸没样品表面,继续培养1天、3天、5天和7天,每48 h进行一次换液。然后采用CCK-8法(波长450 mm)检测MG-63细胞在纯Ti和Ti/Rb-HAp材料表面的增殖情况,评估MG-63细胞在材料表面的细胞活性,并与空白组(完全培养基培养的MG-63细胞)作对照,通过比较培养不同天数后实验组细胞与空白组培养24h后的细胞量比值来判断不同培养时间下的细胞增殖。用吸光度表征细胞增殖,吸光度越大,表明细胞活性越强,材料对细胞的毒性越小。每组设置4个平行样。
每个培养板小孔接种5×103个MG-63细胞,在与Ti/Rb-HAp复合材料共培养3天和7天后,用碱性磷酸酶(alkaline phosphatase, ALP)检测试剂盒检测细胞的ALP活性。
1.3.7 数据处理
所有数据均用SPSS 25.0软件进行统计分析。实验结果均表示为平均值±标准偏差。进行单向方差分析后,用最低显著性差异方法进行事后比较,确定统计学显著性。所有体外研究测定均重复3次,当概率值<0.05时具有统计学意义(*<0.05,**<0.01)。
2 结果与讨论
2.1 微观结构
图1(a)和(b)所示为间接3D打印法制备的纯Ti、以及Ti/HAp、Ti/3%Rb-HAp和Ti/5%Rb-HAp等复合材料的XRD谱。与标准PDF卡片对比后发现,所有材料的主要成分均为Ti,并具有良好的晶体结构。进一步通过细胞精修可知材料为密排六方结构的α-Ti。Ti/Rb-HAp复合材料在2为31°~35°区间存在明显的HAp特征峰,31.77°和32.90°处的峰分别对应HAp的(211)和(300)晶面。表明采用间接3D打印法可成功制备Ti/Rb-HAp复合材料。此外,相比于纯Ti,Ti/Rb-HAp的特征峰更平缓,这是由于其原有晶体结构被部分破坏而使Ti的结晶度降低。
图2所示为Ti和Ti/Rb-HAp复合材料表面抛光后的金相照片。由图可见Ti/Rb-HAp复合材料为明显的多孔材料,Rb-HAp粉末均匀分布在钛基体的孔隙中,两相交织成网状。图3所示为纯Ti和Ti/Rb-HAp复合材料弯曲断口表面的SEM微观形貌,从图中清楚地看到团聚状态的HAp粉末和不规则的Ti块状组织。这表明材料的烧结致密化程度低,有明显的不规则孔隙,观察不到清晰的纯Ti区域。断裂纹从应力处扩展至边缘,断裂前无缩颈等明显的塑性变形现象,表明材料发生脆性断裂。在图3中矩形区域内观察到裂纹形状近似于准解理态,伴随相互平行的台阶和河流状花纹;块状Ti基体上出现清晰的断裂纹,裂纹延伸路径横贯整个区域,复合材料属于脆性断裂。组织中的孔隙缺陷是造成Ti/Rb-HAp复合材料脆性断裂的直接原因,在应力作用下沿解理面完全断开,具体表现为块状Ti基体上的河流状花纹。Ti/Rb-HAp复合材料发生脆性断裂实际是微小孔隙相互交联和解理面滑移相结合造成的。

图1 Ti和Ti/Rb-HAp复合材料的XRD谱
(a) 2=10°−80°; (b) 2=31°−35°

图2 Ti和Ti/Rb-HAp复合材料的金相照片
(a) Ti; (b) Ti/HAp; (c) Ti/3%Rb-HAp; (d) Ti/5%Rb-HAp

图3 Ti和Ti/Rb-HAp复合材料的弯曲断口表面SEM图
(a) Ti; (b) Ti/HAp; (c) Ti/3%Rb-HAp; (d) Ti/5%Rb-HAp
2.2 物理和力学性能
2.2.1 孔隙率
图4所示为纯Ti和Ti/Rb-HAp复合材料的孔隙率和密度。纯Ti的密度显著大于Ti/Rb-HAp复合材料的密度,具有最小的孔隙率20.40%。对于Ti/Rb-HAp复合材料,随Rb-HAp复合粉末中的Rb含量从0增加至5%,孔隙率从42.75%减小至33.55%,平均密度从2.57增加至2.98 g/cm3。这是因为HAp粉末使原有的Ti晶体结构发生膨胀畸变,孔隙率变大,材料密度降低[14]。同理,Rb掺杂进入HAp晶体结构替代部分Ca2+,由于Rb+半径大于Ca2+,也使HAp粉末发生晶格膨胀,导致材料密度降低,所以Ti/Rb-HAp复合材料的密度低于纯Ti的密度。由于Rb的密度大于Ca的密度,故随Rb含量增加,Rb-HAp密度增大,所以Ti/Rb-HAp复合材料的密度随Rb含量增加而增大。

图4 Ti和Ti/Rb-HAp复合材料的孔隙率和密度
2.2.2 力学性能
图5(a)所示为纯Ti和Ti/Rb-HAp复合材料的抗弯强度。由图可见,纯Ti的抗弯强度最高,平均抗弯强度为542.5 MPa,Ti/Rb-HAp复合材料的平均抗弯强度在40~100 MPa之间。Ti/HAp、Ti/3%Rb-HAp、Ti/5%Rb-HAp等3种材料的平均抗弯强度分别为43.7、92.4和67.8 MPa。对于Ti/Rb-HAp复合材料,Rb替代部分Ca,少量Rb进入HAp晶格间隙,使HAp晶体结构更紧密,材料的孔隙度降低从而提高材料的抗弯强度。故与Ti/HAp相比,Ti/3%Rb-HAp的抗弯强度提高111.4%。Ti/Rb-HAp复合材料的抗弯强度显著低于纯Ti的抗弯强度,可能是因为HAp粉末与Ti基体界面结合处结构不稳定,同时孔隙度显著提高,导致材料的抗弯强度大幅降低。
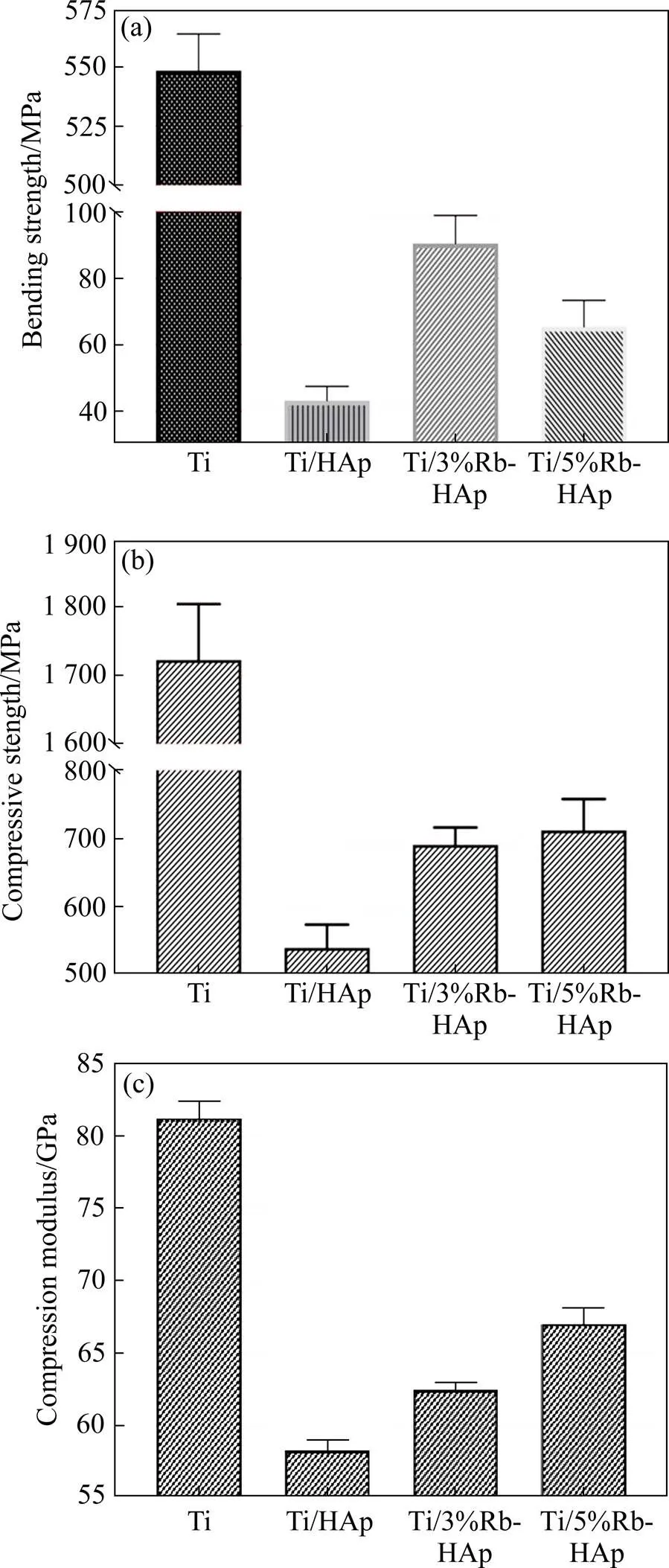
图5 Ti和Ti/Rb-HAp复合材料的抗弯强度(a)、抗压强度(b)和压缩模量(c)
Fig.5 Flexural strength (a), compressive strength (b) and compressive modulus (c) of Ti and Ti/Rb-HAp composites
常见评估3D打印材料强度的方法是测量抗压强度[15]。图5(b)所示为纯Ti和Ti/Rb-HAp复合材料的抗压强度。由图可见,Ti/HAp、Ti/3%Rb-HAp和Ti/5% Rb-HAp这3种复合材料的平均抗压强度随Rb含量增加而提高,分别为540.73 、691.25 和712.58 MPa。与Ti/HAp相比,掺入3%Rb和5%Rb的Ti/Rb-HAp复合材料抗压强度有一定提高。当Rb含量为5%时材料的抗压强度最高达到712.58 MPa,比Ti/HAp的抗压强度提升31.78%。而Ti/3%Rb-HAp和Ti/5%Rb- HAp的抗压强度没有显著差异。这表面掺杂少量Rb可提高Ti/HAp复合材料的抗压强度。抗压强度与材料内在缺陷(例如孔隙)的数量和大小密切相关[16],Ti/Rb-HAp复合材料孔隙率大是其强度显著低于纯Ti的主要原因。
图5(c)所示为Ti和Ti/Rb-HAp复合材料的压缩模量。由图可见,Ti、Ti/HAp、Ti/3%Rb-HAp和Ti/5%Rb- HAp等4种材料的压缩模量分别为82.04、59.16、62.71和67.03 GPa,即Ti/Rb-HAp的压缩模量显著低于纯Ti;随Rb含量增加,Ti/Rb-HAp复合材料的压缩模量增大。由图2和图3可知Ti/Rb-HAp复合材料的孔隙率明显高于纯Ti的孔隙率,导致其压缩模量降低。
HYUN等[17]研究表明,多孔Ti压块的弹性模量和抗弯强度随孔隙率增加而线性下降,在孔隙率为40%时弹性模量趋近于0。正常人体骨的弹性模量范围为7~25 GPa[18],本研究制备的多孔Ti/HAp复合材料孔隙率为20%~42%,其强度和弹性模量随孔隙率升高而降低,因此可以通过调整Ti/Rb-HAp复合材料的成分和工艺参数来调整孔隙率,从而使材料的强度及弹性模量与人体自然骨匹配,因此Ti/Rb-HAp复合材料在生物医学骨植入领域有广阔的应用前景。
2.3 生物学性能
2.3.1 体外诱导矿化性能
图6所示为Ti/HAp、Ti/3%Rb-HAp和 Ti/5%Rb- HAp复合材料在SBF中浸泡1,3和7天后的SEM图。通过图7对比研究在这3种材料表面形成磷灰石的能力。由图可见,浸泡1天后,在材料表面有一些不规则形状的微小颗粒,其中Ti/5%Rb-HAp表面的颗粒更多。浸泡3天后,Ti/Rb-HAp材料表面明显覆盖一层薄的磷灰石层,磷灰石主要呈圆球形,许多颗粒聚集形成团聚体;浸泡7天后,Ti/Rb-HAp材料表面覆盖的磷灰石层更加致密。这表明随时间延长,Ti/Rb-HAp材料表面形成的磷灰石量不断增加。
此外,还观察到在浸泡后期含Rb量多的Ti/5%Rb- HAp材料表面覆盖的磷灰石更致密,这与掺Rb导致HAp发生晶格畸变,部分破坏HAp原有晶体结构释放出更多的Ca2+和PO43−有关。骨组织植入材料的诱导矿化能力至关重要,因为它可增强材料和人自有骨之间的化学结合,有助于防止植入手术后微渗漏和细菌感染带来的有害影响[19]。众所周知,钙磷盐与含磷酸盐的生理液体接触时,会产生由HAp和其前驱体组成的沉淀物[20]。生成的磷灰石层是生物材料具有良好生物活性的基础,有利于与宿主骨组织的整合,而且在细胞黏附、分化和骨组织修复、矿化过程中起着积极的作用[21]。实验结果表明,Ti/Rb-HAp复合材料具有良好的生物活性。

图6 Ti/Rb-HAp复合材料在SBF中浸泡1、3、7天后表面矿化产物SEM图
(a), (d), (g) Ti/HAp composites after soaking for 1, 3 and 7 days;(b), (e), (f) Ti/3%Rb-HAp composite after soaking for 1, 3 and 7 days; (c), (f), (i) Ti/5%Rb-HAp composite after soaking for 1, 3 and 7 days
图7所示为Ti/Rb-HAp复合材料在SBF溶液中浸泡1、3、7、14天后,溶液中Ca2+、PO43−和Rb+的浓度。随浸泡时间延长,SBF溶液中的Ca2+,PO43−和Rb+浓度增加直至趋于稳定,且在0~3天增加幅度较大。总的来说,随Ti/Rb-HAp复合材料中Rb含量增加,Ca2+,PO43-和Rb+释放量增加,这可能是由于材料的孔隙率不同所致。Ti/HAp材料的孔隙率最大,与容液接触的面积增大,释放的离子更多。
Ti/Rb-HAp复合材料浸泡在SBF中,其表面生成磷灰石的过程主要为晶体形核和长大过程,需要具备以下三个方面的条件[22]:1) 存在大量的磷灰石成核源;2) 磷灰石沉积表面的界面能较低;3) 材料表面的局部溶液呈过饱和状态。Ti/Rb-HAp复合材料浸泡在SBF中,一方面复合材料中的HAp溶解释放Ca2+和PO43−,使SBF中的钙磷离子呈过饱和状态;另一方面,SBF溶液中的—OH−吸附在带正电荷的Ti表面形成Ti-OH基团,为磷灰石层的形成提供有利的形核位点[23]。浸泡过程中,Ti—OH基团与Ca2+生成钛化钙产物,之后再结合游离的PO43−生成无定型态的磷灰石[24]。从生物相容性的角度来说,生物材料植入人体后能否生成具有生物活性的磷灰石层是植入材料应用于临床阶段的前提条件。体外矿化结果表明,本研究采用间接3D打印法制备的Ti/Rb-HAp复合材料,在SBF中浸泡后表面生成致密的磷灰石层,该材料具有良好的生物活性。
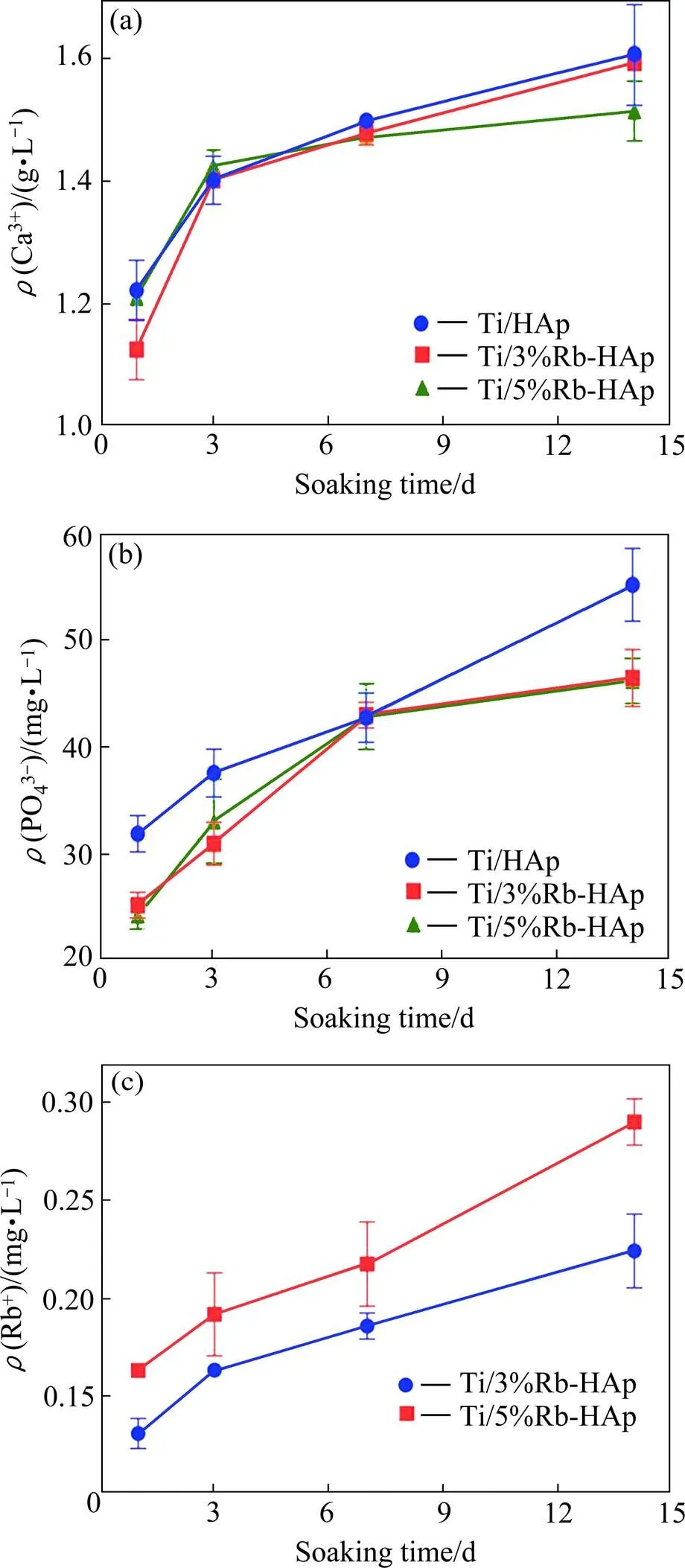
图7 SBF中的Ca2+、PO43−和Rb+浓度随Ti/Rb-HAp复合材料浸泡时间的变化
(a) Ca2+; (b) PO43−; (c) Rb+
2.3.2 细胞增殖与分化
图8所示为Ti和Ti/Rb-HAp复合材料在培养基中培养的MG-63细胞活性和完全培养基培养(对照组)的MG-63细胞活性。从图8(a)所示CCK-8方法测试结果看出,在培养基中培养1天和3天后,Ti表面的细胞活性最大,其次是完全培养基培养的MG-63细胞活性,Ti/Rb-HAp复合材料表面的细胞活性最小,这表明在培养初期,Ti对MG-63细胞亲和力更好。随着孵育时间延长至5天和7天,Ti和Ti/Rb-HAp复合材料表面的MG-63细胞均显著增加,细胞大量增殖,且明显高于在对照组上的增殖,表明Ti/Rb-HAp复合材料的细胞黏附力高于对照组,即Ti/Rb-HAp复合材料有利于细胞增殖。实验结果表明,在Ti中添加Rb-HAp不会产生任何细胞毒性作用,并且可促进MG-63细胞增殖,其中的Ti/3%Rb-HAp复合材料表面细胞增殖率更高。
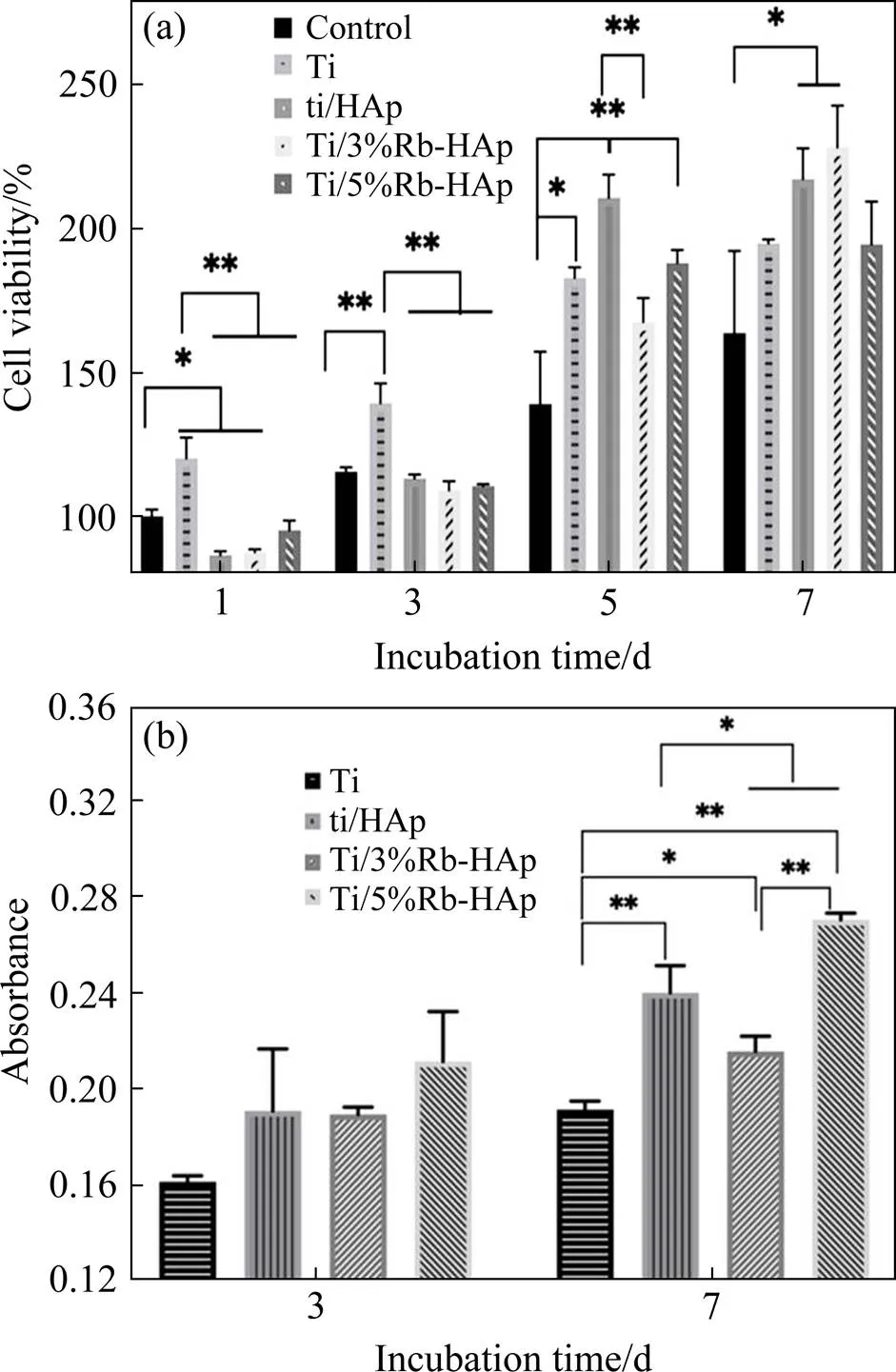
图8 Ti和Ti/Rb-HAp复合材料表面的MG-63细胞活性
(a) CCK-8test result(ratio of the number of cells on the material surface to the number of cells in the control group after one day of culture); (b) ALP test result (wave length is 450 nm)
图8(b)所示为Ti和Ti基复合材料与MG-63细胞共培养3天和7天后的ALP活性。培养3天后,与对照组相比,所有Ti和Ti基复合材料均促进了MG-63细胞的ALP蛋白表达。随培养时间延长至7天,促进作用进一步增强。这表明Ti和Ti/Rb-HAp材料对ALP活性具有明显的促进作用,并使该蛋白的峰值表达程度不同。
材料表面特征不仅影响成骨细胞的黏附,还影响成骨细胞的分化。ROMERO等[25]将黏附在Ti粗糙表面上的蛋白质层与空白组对比,发现与糖酵解和细胞凋亡相关的蛋白质数量减少,Ti粗糙表面可增加整合素在细胞信号通路和血液凝固过程中的表达,粗糙多孔的Ti表面具有更高的细胞代谢水平。LI等[26]分析了多孔Ti6Al4V支架上的人骨髓间充质干细胞在7 天时的ALP活性,发现在405 nm波长下孔径为400~500 μm的Ti6Al4V支架吸光度增加,即细胞活性增强。本研究也观察到在第7天时具有更高孔隙率的Ti/HAp复合材料的ALP活性相对孔隙率较低的纯Ti明显提高。相互贯通的多孔结构可促进成骨细胞在孔隙中增殖,有利于新骨组织向内生长及体液的传输,从而使种植在多孔Ti/HAp复合材料表面的MG-63细胞表现出更强的活性。同时Ti/Rb-HAp复合材料的多孔粗糙表面也有利于提高MG-63细胞代谢水平,促进细胞的增殖分化。
将Ti与Rb-HAp复合,可改善材料的表面生物活性和释放活性离子来促进ALP表达。Ti/Rb-HAp复合材料在早期阶段的促进作用相对较弱,这可能是由于早期阶段Ca2+、Rb+快速释放,在溶液中形成瞬时高浓度的饱和态,之后生成游离的纳米磷酸钙。随培养时间延长,Ca2+因细胞的吸收以及完全培养基的定期更换,浓度逐渐降低,同时游离的纳米磷酸钙因矿化作用而逐渐沉积,导致潜在的副作用逐渐消失,Ti/Rb-HAp对细胞的促进作用随之增强,在细胞培养后期仍可增强MG-63细胞的ALP活性。Rb+与溶液中的Ti-OH-结合生成的Rb2TiO3经水解可提高材料/细胞界面的局部pH值。因此,在含有Rb的表面/细胞界面处获得较高的局部pH值。有文献报道,pH值增大可促进成骨细胞的分化[27]。此外,多孔粗糙的表面也有利于MG-63细胞代谢水平的提高,促进细胞的增殖分化。
3 结论
1) 采用间接3D打印法成功制备Ti/Rb-HAp复合材料,Rb的加入可提高Ti/HAp复合材料的抗弯强度、抗压强度和压缩模量,抗压强度和压缩模量均随Rb含量增加而小幅提高。与纯Ti相比,Ti/Rb-HAp复合材料由于孔隙率显著提高,导致强度下降,同时压缩模量显著降低。材料的断裂方式为脆性断裂。
2) Ti/HAp复合材料浸泡在模拟体液中,表面形成致密的磷灰石层,材料具有优异的生物活性。
3) 与纯Ti相比,Ti/Rb-HAp复合材料能促进成骨细胞黏附增殖,并增加与成骨细胞分化和矿化方面的表达。此外,粗糙的多孔材料表面有利于MG-63细胞代谢水平的提高,从而促进细胞的增殖分化。综合来看,Ti/3%Rb-HAp复合材料具有最好的生物学性能和力学性能。
[1] GEETHA M, SINGH A K, ASOKAMANI R, et al. Ti based biomaterials, the ultimate choice for orthopaedic implants-A review[J]. Progress in Materials Science, 2009, 54(3): 397−425.
[2] WANG C R, XIE Q Y, GUO Z, et al. A 3D printed porous titanium alloy rod with biogenic lamellar configuration for treatment of the early-stage femoral head osteonecrosis in sheep[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 106(2): 453−460.
[3] MICHAEL D W, SCHUMACHER R, MAYER K,et al. Bone regeneration by the osteoconductivity of porous titanium implants manufactured by selective laser melting: a histological and micro computed tomography study in the rabbit[J]. Journal of Shoulder and Elbow Surgery, 2013, 19(23): 2645−2654.
[4] CACCIOTTI I, BIANCO A, LOMBARDI M, et al. Mg-substituted hydroxyapatite nanopowders: synthesis, thermal stability and sintering behaviour[J]. Journal of the European Ceramic Society, 2009, 29(14): 2969−2978.
[5] EDWIN N, SARANYA S, WILSON P. Strontium incorporated hydroxyapatite/hydrothermally reduced graphene oxide nanocomposite as a cytocompatible material[J]. Ceramics International, 2019, 45(5): 5475−5485.
[6] ŠUPOVÁ M. Substituted hydroxyapatites for biomedical applications: A review[J]. Ceramics International, 2015, 41(8): 9203−9231.
[7] CASARRUBIOS L, GOMEZ N, SANCHEZ S, et al. Silicon substituted hydroxyapatite/VEGF scaf-folds stimulate bone regeneration in osteoporotic sheep[J]. Acta Biomaterialia, 2020, 101(1): 544−553.
[8] GINESTE L, RAN Z, FRAYSSINET P, et al. Degradation of hydroxylapatite, fluorapatite, and fluorhydroxyapatite coatings of dental implants in dogs[J]. Journal of Biomedical Materials Research, 1999, 48(3): 224−234.
[9] LIU Y Q, CHUN D. Lithium-containing biomaterials stimulate bone marrow stromal cell-derived exosomal miR-130a secretion to promote angiogenesis[J]. Biomaterials, 2019, 192(2): 523− 536.
[10] 谭彦妮,刘咏. 铷及含铷材料的性能与应用研究进展[J]. 中国有色金属学报, 2017, 27(2): 272−281.
TAN Yanni, LIU Yong. Research progress on properties and applications of rubidium and rubidium containing materials[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(2): 272−281.
[11] OUYANG Z X, HUANG Q L, LIU B, et al. Rubidium chloride targets jnk/p38-mediated nf-κb activation to attenuate osteoclastogenesis and facilitate osteoblastogenesis[J]. Frontiers in Pharmacology, 2019, 10(7): 584−597.
[12] HAN C J, WANG Q, SONG B, et al. Microstructure and property evolutions of titanium/nano-hydroxyapatite composites in-situ prepared by selective laser melting[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2017, 71(5): 85−94.
[13] LI X, WANG T. Causes analysis on brittle fracture of pure titanium wires[J]. Physical and Chemical Tests-Physical Section, 2016, 52(1): 66−70.
[14] OMRAN A M, WOO K D, KANG D S, et al. Fabrication and evaluation of porous Ti–HA bio-nanomaterial by leaching process[J]. Arabian Journal of Chemistry, 2015, 8(3): 372−379.
[15] JANG Y E, LEE B N, KOH J T, et al. Cytotoxicity and physical properties of tricalcium silicate-based endodontic materials[J]. Restorative Dentistry & Endodontics, 2014, 39(2): 89−94.
[16] ZHANG J T, LIU W Z, SCHNITZLER V, et al. Calcium phosphate cements for bone substitution: Chemistry, handling and mechanical properties[J]. Acta Biomaterialia, 2014, 10(3): 1035−1049.
[17] OH I H, NOMURA N, MASAHASHI N, et al. Mechanical properties of porous titanium compacts prepared by powder sintering[J]. Scripta Materialia, 2003, 49(12): 1197−1202.
[18] JURCZYK K, NIESPODZIANA K, JURCZYK M U, et al. Synthesis and characterization of titanium-45S5 Bioglass nanocomposites[J]. Materials & Design, 2011, 32(5): 2554− 2560.
[19] YANG X Y, LIU M, ZHAO Y, et al. Rational design and fabrication of a β-dicalcium silicate-based multifunctional cement with potential for root canal filling treatment[J]. Journal of Materials Chemistry B, 2014, 2(24): 3830−3838.
[20] GANDOLFI MG, CIAPETTI G, TADDEI P, et al. Apatite formation on bioactive calcium-silicate cements for dentistry affects surface topography and human marrow stromal cells proliferation[J]. Dental Materials, 2010, 26(10): 974−992.
[21] SEO M S, HWANG K G, LEE J, et al. The effect of mineral trioxide aggregate on odontogenic differentiation in dental pulp stem cells[J]. Journal of Endodontics, 2013, 39(2): 242−248.
[22] BOHNER M, LEMAITRE J. Can bioactivity be tested in vitro with SBF solution[J]. Biomaterials, 2009, 30(12): 2175−2179.
[23] LI P J, KANGASNIEMI I, GROOT K, et al. Bonelike hydroxyapatite induction by a gel-derived titania on a titanium substrate[J]. Journal of the American Ceramic Society, 1994, 77(5): 1307−1312.
[24] TAKADAMA H, KIM H M, KOKUBO T, et al. TEM-EDX study of mechanism of bonelike apatite formation on bioactive titanium metal in simulated body fluid[J]. Journal of Biomedical Materials Research, 2001, 57(3): 441−448.
[25] ROMERO F, SANCHEZ A M, ARAUJO N. Proteomic analysis of silica hybrid sol-gel coatings: A potential tool for predicting the biocompatibility of implants in vivo[J]. Biofouling. 2017, 33(8): 676−689.
[26] LI G Y, WANG P L, PAN W, et al. In vitro and in vivo study of additive manufactured porous Ti6Al4V scaffolds for repairing bone defects[J]. Scientific Reports, 2016, 6.
[27] CIVANTOS A, CRISTINA D, RAISA J P, et al. Designing bioactive porous titanium interfaces to balance mechanical properties and in vitro cells behavior towards increased osseointegration[J]. Surface and Coatings Technology, 2019, 368(25): 162−174.
Structure and properties of Ti/HAp composites prepared by indirect 3D printing
LIU Yanjun1, LIU Ye1, 2, TAN Yanni1
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;2. Shenzhen Uprise 3D Corporation, Shenzhen 518132, China)
Rb-Hydroxyapatite (Rb-HAp) powders with different Rb content were prepared by ion-doped modification method, and then Ti/Rb-HAp composites were prepared by indirect 3D printing method. The morphology and phase composition of the composites were analyzed, the mechanical properties of the composites were determined, and the biological properties of the composites were studied by cell culture and cell proliferation and differentiation experiments in vitro. The results show that Ti/Rb-HAp composites have higher porosity, and the porous structure is favorable for the inward growth of new bone tissue and the transport of body fluid. The addition of Rb can improve the bending strength and compressive strength of Ti/HAp composites, and the compressive strength increases slightly with the increase of Rb content. Compared with the pure Ti group, Ti/Rb-HAp composites promote the proliferation and ALP activity of MG-63 cells, so the composite has good cytocompatibility. After immersion in simulated body fluid, a dense apatite layer formed on the surface of the composite, indicating that the Ti/HAp composites have excellent biological activity.
titanium/hydroxyapatite composites; indirect 3D printing; biocompatibility; mechanical properties; mineralization properties
10.19976/j.cnki.43-1448/TF.2021072
TB333
A
1673-0224(2021)06-515-10
湖南省自然科学基金青年基金资助项目(2019JJ50797)
2021−08−24;
2021−10−06
谭彦妮,副教授,博士。电话:18975196565;E-mail: tanyanni@csu.edu.cn
(编辑 汤金芝)
