氟磷灰石-碳还原过程热力学分析及钙、硅迁移转化
2021-12-22穆刘森马丽萍郭致蓥
穆刘森,马丽萍,杨 静,郭致蓥,姚 远,敖 冉,隗 一,杨 杰
(1. 昆明理工大学环境科学与工程学院,云南昆明 650500;2. 云南磷化集团有限公司,云南昆明 650600;3. 成都信息工程大学资源环境学院,四川成都 610200)
黄磷作为含磷矿物加工提炼的产物,不仅是制造精细磷化工产品的基本原料,还被广泛应用于农业、军工和尖端科技等领域[1-2]。国内黄磷主要采用电炉法生产,将磷矿、硅石和焦炭混合于电炉内,通过炉内的电热能使混合物熔融发生碳热还原反应,同时磷元素以磷蒸汽的形式升华,经洗涤冷凝后精制为成品。电炉法制黄磷1 t 的能耗为13 000 ~15 000 kW · h,同时产生炉渣9~10 t[3-4]。渣中钙、硅含量占比较高,且钙、硅元素的不同特性及不同存在形式是实现炉渣资源利用的重要因素之一,所以碳热还原过程中钙、硅元素的迁移过程及存在形式对实现全量资源化利用具有重要意义。
国内外学者对磷矿石还原反应过程进行了大量研究,JACOB 等[5]研究二氧化硅和氧化铝对碳热还原纯磷酸三钙的影响,发现磷酸钙先被碳还原成CaO、CO(g)和P2(g),然后SiO2和Al2O3与CaO 反应生成硅酸钙和铝酸钙;张雪峰等[6]以磷酸钙、焦炭和硅石为反应物探讨了碳热还原过程,提出了离子型还原机制,认为反应分为两个阶段,第一阶段C 先将PO43-还原为PO33-,PO33-进而被C 还原为P2,第二阶段硅石在参与还原PO33-时自身被氧化为SiO32-,并与Ca2+结合生成CaSiO3;JIANG 等[7-8]用自制纯氟磷灰石进行还原反应,认为氟磷灰石先和SiO2反应脱氟后生成Ca3(PO4)2和2CaF2· SiO2,Ca3(PO4)2再被C 还原成P2(g),当硅钙比高时2CaF2·SiO2立即和SiO2反应生成SiF4逸出;孙永升等[9]则利用FactSage6.4热力学软件对氟磷灰石的还原过程进行热力学分析,认为在无其他添加剂时氟磷灰石在1 174 ℃左右会分解为Ca3(PO4)2和CaF2,当温度升高至1 425 ℃左右时Ca3(PO4)2会被C还原成CaO和P2,当加入SiO2后能降低氟磷灰石起始还原温度,并与CaO 反应生成硅酸盐;LIU 等[10]在真空环境下研究氟磷灰石的还原过程,提出在真空环境下氟磷灰石直接与碳反应生成P2(g)、CaO、CO(g)和CaF2,后CaO与SiO2反应生成硅酸钙进而促进正反应进行。然而,对还原体系中钙硅元素的相态转变的研究却鲜有报道。笔者以实际生产中的磷矿石为原料,硅石为助熔剂,焦炭为还原剂在符合实际的酸度值下研究电炉法制磷过程中钙和硅的迁移变化规律和反应历程,为进一步实现热法加工全量资源化利用提供理论基础。
1 实验原部分
1.1 实验原料与方法
实验所用的磷矿石、硅石和焦炭均来自云南省某磷化工企业,经X射线衍射分析,磷矿中主要物相是Ca5(PO4)3F(氟磷灰石),硅石中是SiO2;磷矿石及硅石化学成分分析结果见表1,焦炭工业分析结果见表2。

表1 原料化学成分%

表2 焦炭工业分析%
按照实际生产中碳过量系数为1.05、酸度值为0.85进行配料,将原料放置于T2E三维混合机中混合1 h,以确保原料均匀混合。称取适量的混合物置于氧化铝坩埚中,将坩埚放入KTL1 600 管式炉中,设定升温程序进行升温并通入氮气作保护气。温度分别从室温升至1 250、1 300、1 350、1 400、1 450、1 500 ℃,待反应结束后立即取出,将自然冷却至室温的炉渣研磨,过筛(0.106 mm(150目))筛后置于干燥器中用于分析表征。
1.2 计算方法
笔者基于FactSage7.1 中的氧化物数据库(FToxid)和纯物质数据库(FactPS),应用Equilib模块计算在碳热还原反应过程中,达到热力学平衡时各相产物的组成和钙硅元素的分布情况;用Reaction 模块计算可能发生的化学反应的热化学性质变化。模拟计算前的参数设定如下:根据实际生产中碳过量系数为1.05、酸度为0.85的标准,设定参加反应物的量n(Ca5(PO4)3F)1 mol、n(SiO2)5 mol、n(C)10 mol;设定温度计算范围为50~1 550 ℃,步长为100 ℃。设定压力为常压(101 325 Pa)。
2 结果与讨论
2.1 钙、硅元素的迁移转化过程
在不同温度下体系中含钙矿物的转变情况见图1。由图1 可知,炉渣中的钙以多种形式存在,并随温度变化而迁移转化。钙元素在1 150 ℃以下以Ca5(PO4)3F(氟磷灰石)的形式存在;当温度达到1 250 ℃时,Ca5(PO4)3F(氟磷灰石)消失,全部转变为Ca3(PO4)2和CaF2;随着温度继续升高,在1 350 ℃时Ca3(PO4)2逐渐消失,并转化为CaSiO3;当温度达到1 450 ℃以上时,少量CaF2发生熔融转变为液相,钙元素主要以CaSiO3和CaF2的形式存在。

图1 不同温度下体系中含钙物相的转变情况
不同温度下体系中含硅矿物的转变情况见图2。由图2可知,在1 200 ℃以下硅元素以石英的形式存在;温度达到1 250 ℃时,石英开始逐渐减少,并出现新的CaSiO3相和少量气相SiF4;当温度到达1 450 ℃以上时,含硅物相以CaSiO3为主。
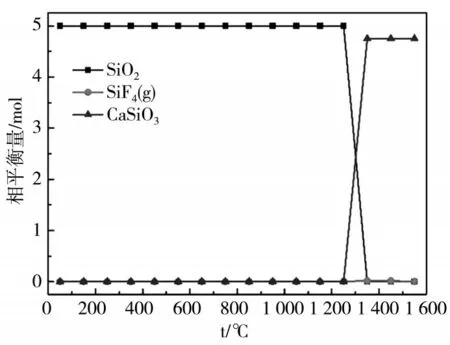
图2 不同温度下体系中含硅物相的转变情况
2.2 碳热还原反应热力学分析
吉布斯自由能变(ΔG)是判断化学反应能否发生的依据。式(1)至式(8)为磷矿碳热还原最可能发生的反应过程[11-12]。用FactSage7.1热力学软件中的Reaction模块计算各反应的ΔG随温度t的变化情况。

Ca5(PO4)3F体系在0 ~1 700 ℃下可能发生的各反应ΔG值的变化情况见图3。由图3可知,随着温度升高,各反应的ΔG值均不断减小,反应(1)、(2)、(3)ΔG=0的温度分别为1 180、1 250、1 435 ℃,说明反应发生的可能性为(1)>(2)>(3)。

图3 反应(1)至(3)的ΔG与温度的关系
Ca3(PO4)2体系在0 ~1 700 ℃下可能发生的各反应ΔG值的变化情况见图4。反应(6)、(7)、(8)的吉布斯自由能变值在0 ~1 700 ℃范围内都大于零,说明反应(6)、(7)、(8)几乎不可能发生,反应(4)和(5)ΔG=0 的温度分别为1 476、1 200 ℃,说明反应(4)和(5)都有可能发生,且在1 200 ℃时,反应(5)优先发生。

图4 反应(4)至(8)的ΔG与温度的关系
反应(1)、(2)、(4)和(5)的平衡常数对数值与温度的关系见图5。由图5 可知,平衡常数K都随温度的升高而增大,说明4个反应均为吸热反应。在1 000 ~1 300 ℃时反应(1)的平衡常数K高于反应(2),说明此时反应(1)为主导反应。在温度高于1 350 ℃时,反应(2) 的平衡常数K远高于反应(1),说明此时反应(2)为主导反应;在1 000 ~1 700 ℃温度区间上,反应(5)的平衡常数K都远高于反应(4),说明当升高同样的温度时,反应(4)才刚刚开始进行,反应(5)已经彻底反应完全,由此可以推测在整个过程中反应(5)为主导反应。

图5 反应平衡常数对数值与温度的关系
2.3 相图分析
采用Factsage7.1 中的Phase Diagram 模块对CaO-SiO2二元体系进行计算,结果见图6。由图6可知,随着温度升高,各相区的主要组成物质为CaSiO3、Ca2SiO4、Ca3SiO5和Ca3Si2O7,图中出现2处温度较低的低共融点,即Q 和P 点,当m(SiO2)/m(CaO)约为1.7 时,CaO-SiO2二元体系会在约1 436 °C 即Q 点形成由α-鳞石英和α- CaSiO3组成的低共熔物;当m(SiO2)/m(CaO)约为0.83时,体系会在约1 460 ℃即P 点形成由α- CaSiO3和Ca3Si2O7形成的低共熔物。根据热力学计算结果可知Ca3(PO4)2被C还原后生成的CaO会与SiO2反应生成不同的硅酸盐,由相图结果可知若适当控制体系的酸度,可在较低温度下产生液相,加快反应速率并降低反应温度。

图6 CaO-SiO2二元体系相图
2.4 炉渣物相分析
1) XRD分析
磷矿体系在1 250 ~1 500 ℃下反应1 h后自然冷却炉渣的XRD图谱见图7。由图7可知,在1 250 ℃时,体系中Ca5(PO4)3F 和SiO2的衍射峰强度较高,同时出现较弱的CaF2和CaSiO3的衍射峰,说明此时反应刚刚开始,磷矿中Ca5(PO4)3F 发生脱氟和热解,但此时的反应速率较慢,生成的Ca3(PO4)2立即与C 发生还原反应,这解释了XRD 图谱中没有出现Ca3(PO4)2的原因;随着温度升高,当温度到达1 350 ℃时,反应速率加快,Ca5(PO4)3F 和SiO2的衍射峰强度逐渐减小,出现了Ca2SiO4的衍射峰,说明此时CaO 盈余并和CaSiO3反应生成Ca2SiO4;在1 450 ℃时,所有衍射峰强度减弱,并出现少量Ca3SiO5,说明CaO继续与Ca2SiO4发生反应生成Ca3SiO5;当温度到达1 500 ℃,XRD 图中出现弥散的峰形,衍射峰全部消失,说明此时体系中形成硅酸盐系低共熔物,即非晶态玻璃相熔融体,残渣活性较高。

图7 不同温度下自然冷却的炉渣的XRD图谱
结合XRD和热力学分析可知,在1 250 ℃时反应(1)和(2)优先发生,即Ca5(PO4)3F首先发生脱氟和分解反应生成CaF2、Ca3(PO4)2和CaSiO3,随着温度的升高反应(5)发生,Ca3(PO4)2被C 还原,生成的产物CaO与SiO2反应生成了不同形式的硅酸钙,促进反应正向进行。
2) FT-IR分析
磷矿体系在1 250 ~1 500 ℃下反应1 h 后自然冷却炉渣的FT-IR图谱见图8。1 250 ℃和1 350 ℃共出现5个吸收峰。1 100 cm-1和600 cm-1处的吸收峰为氟磷灰石离子团[PO4]3-中P—O键的反对称伸缩振动和弯曲振动[13]。790 cm-1和460 cm-1处的吸收峰是由于架状硅酸盐石英中O—Si—O 键的弯曲振动引起。1 095 cm-1处的吸收峰为离子团[SiO4]4-中Si—O键的非对称拉伸振动[14]。自然冷却炉渣的红外光谱随温度的升高发生变化,当温度达到1 350 ℃时,在600 ~400 cm-1出现Si—O 键的非对称拉伸振动吸收峰,说明形成了新的物相。随着温度升高,吸收峰的形状发生变化,556 cm-1处的吸收峰是含Si—O键振动的硅酸三钙的特征,表明有离子团[SiO5]6-生成[15]。这与XRD分析结果一致。
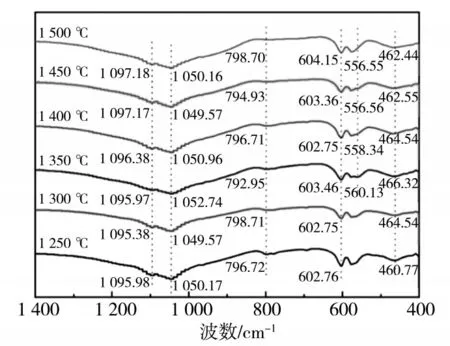
图8 不同温度下自然冷却炉渣的FT-IR图谱
3) SEM分析
磷矿体系在不同温度下反应1 h 后自然冷却炉渣的SEM 图见图9。由图9 可知,在1 250 ℃时,渣相结构松散相互分离,表面棱角清晰,矿物晶型稳定,只有少部分颗粒发生黏结,说明此时反应处于初级阶段,已经发生小规模的熔融现象。随着温度升高,当温度达到1 400 ℃时,颗粒间黏结现象加重,渣相致密度增加,表面产生絮状结构,说明已经发生了大规模的熔融现象,并产生玻璃相。温度到达1 500 ℃时,颗粒表面光滑棱角逐渐模糊,亮区增多,应为此时产生大量液相及硅酸盐系低共熔物扩散至颗粒表面造成,这也解释了当温度高于1 500 ℃时XRD 图谱中的衍射峰逐渐减弱并消失及出现“鼓包”的原因。

图9 不同温度下自然冷却炉渣的SEM图
2.5 元素迁移路径
为钙硅元素在整个反应体系中的迁移转化路径见图10,每个色块代表一个温度下钙、硅的物相存在形式。图10 左侧为钙元素在整个反应体系中的迁移变化路径,虚线内的区域为反体系中的主反应和控制步骤。在1 250 ℃以下时,钙元素以Ca5(PO4)3F的固相形式存在于体系中;当温度升至1 250 ℃时,Ca5(PO4)3F 发生分解和脱氟,此时钙元素以Ca3(PO4)2、CaF2和CaSiO3的固相形式存在;随温度继续升高,Ca3(PO4)2和C 反应生成了CaO,CaO 随即与SiO2反应生成CaSiO3;当温度到达1 350 ℃以上时,富余的CaO 与CaSiO3反应生成不同的钙硅酸盐,生成钙硅酸盐的顺序为CaSiO3、Ca2SiO4和Ca3SiO5。图10 右侧为硅元素在整个反应体系中的迁移变化路径,1 250 ℃以下时,硅元素以SiO2的固相形式存在。1 250 ℃时固相SiO2转变为固相CaSiO3,同时有少量气相SiF4逸出体系;随着温度升高,CaSiO3与盈余的CaO反应产生不同的钙硅酸盐并形成低共熔物。

图10 钙和硅元素的迁移路径
3 结论
(1)Ca最初以Ca5(PO4)3F为主要形式存在于矿石中,随着温度升高逐渐转变为主要以CaSiO3、Ca3(PO4)2和CaF2的形式存在;Si最初以SiO2为主要形式存在于硅石中,随温度升高和反应的进行逐渐转变为主要以CaSiO3、Ca2SiO4和Ca3SiO5的固相形式存在,并有少量以气相SiF4形式逸出。
(2)Ca5(PO4)3F 首先发生脱氟和分解反应,而后Ca3(PO4)2与C 发生还原反应生成CaO,CaO 与SiO2反应生成不同形式的钙硅酸盐即CaSiO3、Ca2SiO4和Ca3SiO5。
(3)残渣SEM 分析表明:随温度升高,体系中颗粒间由独立分散逐渐转变为相互黏结,在1 400 ℃时发生熔融产生含有硅酸盐系低共熔物的液相,反应物随液相扩散进而增大反应面积,液相的形成及扩散会影响反应进行的程度。
