1例Rhmod个体的RHAG基因分析
2021-12-22黄娴李立新李双玉吴丽娜解金辉
黄娴 李立新 李双玉 吴丽娜 解金辉
Rh血型系统(ISBT004)包含RHD和RHCE两个同源连锁基因,分别编码D抗原和CcEe抗原,是最重要的红细胞血型系统之一。RHAG血型系统(ISBT030)由RHAG基因编码Rh相关蛋白RhAG,RhAG蛋白对RhD/CE抗原在红细胞膜上的正确连接定位十分重要[1]。RHAG基因变异可导致Rh血型抗原显著减少,称为Rhmod[2]。我们通过1例由于RHAG新复合杂合突变导致的Rhmod家系进行血清学与基因检测,并采用生物信息学方法和蛋白结构模型,初步探讨这例新的复合突变导致Rhmod型的分子基础。
材料与方法
1 研究对象 Rhmod型家系来自天津,先证者父亲已故,无兄弟姐妹子女,直系亲属仅现存母亲。先证者,女,18岁,无输血史和妊娠史,因溶血性黄疸收住入院,总胆红素51 μmol/L,间接胆红素27 μmol/L,血红蛋白93 g/L。医院初检为Rh阴性,送检血液中心进行交叉配血,为切脾手术备血。
2 试剂与仪器 抗C、c、E、e(CE-IMMUNODIAGN OSTIKA公司),抗D试剂4种(上海血液生物,加拿大宜美康,CE-IMMUNODIAGNOSTIKA,Sanquin),DNA提取试剂盒(Magen公司),Taq DNA聚合酶(Takara公司)。微柱凝胶抗球蛋白检测卡、孵育器、卡式离心机(BIO-RAD公司),离心机(KUBOTA公司),分光光度计(IMPLEN公司),PCR仪(ABI公司),电泳仪(Thermo公司),凝胶成像仪(北京东讯天地)。所有试剂与仪器均在有效期内使用。
3 方法
3.1 Rh抗原检测:采用试管盐水法、微柱凝胶卡法,使用4种克隆株的抗D试剂检测先证者RhD抗原。用吸收放散试验检测其红细胞是否表达微量的D抗原,放散法使用Sanquin公司的酸放散试剂盒。由于样本量所限,未进行RhCE抗原的吸收放散试验。采用试管盐水法和微柱凝胶卡法检测所有受试者的RhCE抗原、不规则抗体筛查和直抗。
3.2 DNA提取及PCR扩增:采用蛋白酶K法抽提所有受试者的外周静脉血DNA,检测抽提DNA的浓度和纯度。自行设计RHD、RHCE、RHAG基因所有外显子的PCR引物(由Invitrogen公司合成),寻最适条件进行PCR-SSP。
3.3 DNA测序分析:RHD、RHCE、RHAG的PCR扩增产物送Invitrogen公司测序,测序引物使用扩增引物。测序结果用Choromas软件与ISBT公布的RHD(NG_007494)、RhCE(RhCE*ce,NM_020485)、RHAG(NG_011704)基因序列进行比对。先证者母亲进行相同的PCR扩增和RHAG基因测序。
3.4 生物信息学分析:使用PolyPhen-2和Provean两个在线生物信息学软件,分析氨基酸变异对蛋白质功能的影响。运用PyMOL软件,对变异氨基酸进行空间定位,并分析其与周围氨基酸的氢键作用。
结 果
1 血清学检测结果 先证者D、C、c、E、e抗原盐水法、微柱凝胶卡法均为阴性,分析可能为Rh抗原系统抗原不表达(Rhnull表型)或弱表达(Rhmod表型)。吸收放散试验显示D抗原为阳性,先证者符合Rhmod表型。其母亲Rh抗原未见明显异常,Rh血型为ccDEE。先证者和母亲抗筛、直抗均阴性。
2RHD和RHCE基因变异检测结果 先证者RHD基因1-10外显子及剪切点区域未发现突变,RHCE*01.01第1外显子存在48G>C(Trp16Cys),是常见的RHCE等位基因。
3RHAG基因变异检测结果 如图1所示,先证者RHAG基因第3外显子编码第142位氨基酸的碱基发生c.425T>C,使亮氨酸转为脯氨酸(p.Leu142Pro),第8外显子编码第376位氨基酸的碱基发生c.1126G>A,使甘氨酸转为苏氨酸(p.Gly376Ser),两处变异均为杂合错义突变。先证者母亲RHAG基因第8外显子也存在c.1126G>A。

图1 先证者RHAG基因测序结果
4 生物信息学分析结果
4.1 蛋白影响力评估:如图2所示,p.Leu142Pro变异PolyPhen-2评分结果为0.999分,Provean评分结果为-6.220分;p.Gly376Ser变异PolyPhen-2评分结果为1.000分,Provean评分结果为-5.580分,预示这两处变异均为有害变异,可影响蛋白质功能。

图2 2种生物信息学软件对氨基酸变异预测结果
4.2 变异位点空间结构分析结果:PyMOL模型分析显示,RhAG蛋白有12个α-螺旋,p.Leu142Pro位于第5个α-螺旋跨膜区域接近胞内处,p.Gly376Ser位于第12个α-螺旋跨膜区域,如图3所示。图4为氨基酸变异前后氢键的比较,p.Leu142变为p.Pro142后,与p.Pro138的氢键作用消失;p.Gly376变为p.Ser376后,增加p.Ala372、p.Val373、p.Leu377位之间的3个氢键。分析显示2处变异均可能改变氨基酸间氢键的联系。

图3 RhAG蛋白三维空间结构模型
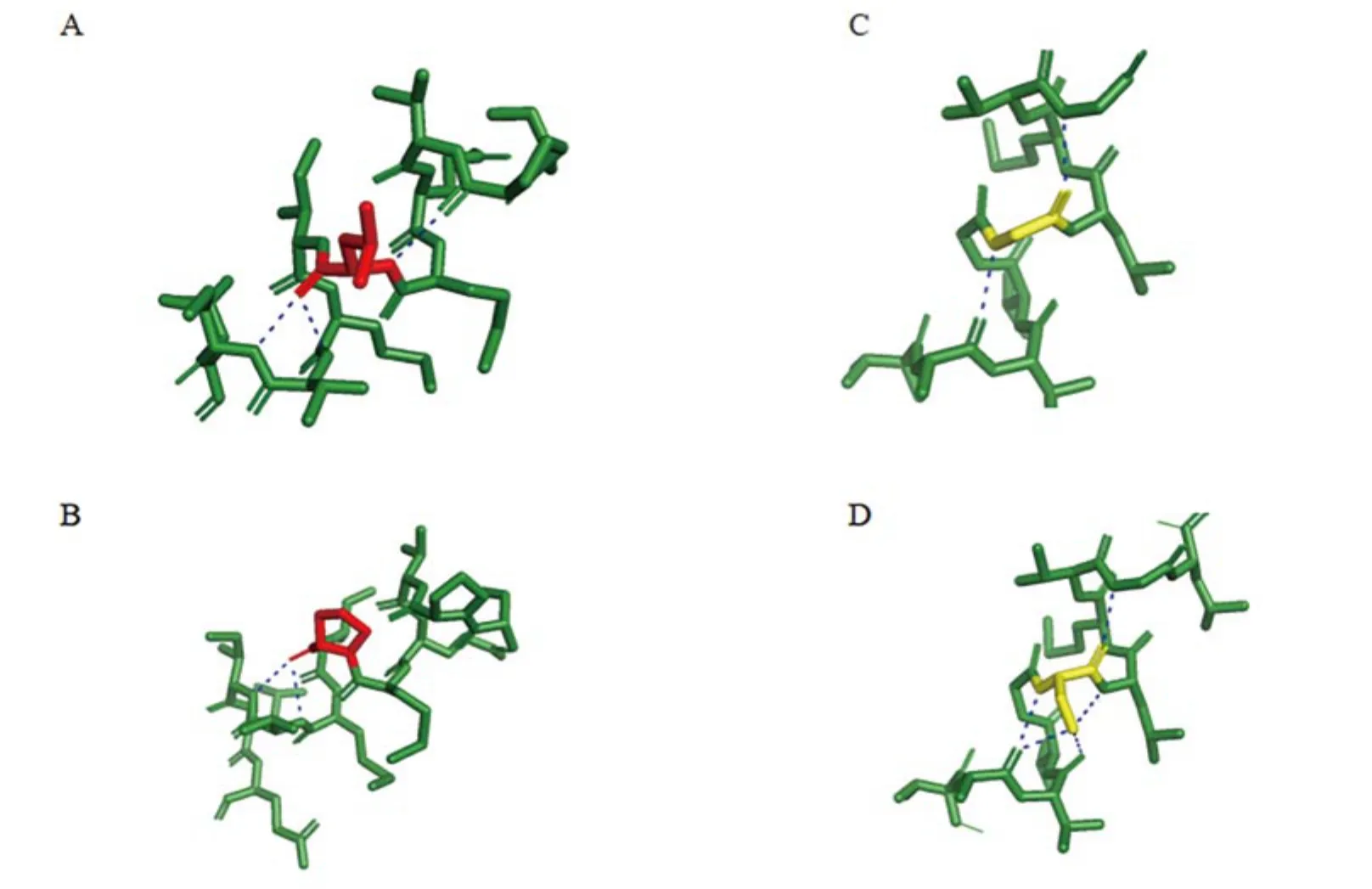
图4 氨基酸变异前后氢键比较
讨 论
RHAG基因位于6号染色体长臂6p11-p21. 1,它编码的RhAG抗原蛋白含409个氨基酸,12次穿膜,N端和C端都在膜内[3]。RhAG蛋白是膜上多聚体的主要成分之一,与RhD、RhCE、GPB、GPA、CD47、LW、带3蛋白和带4.2蛋白组成蛋白复合物[4]。如果RhAG抗原不能正常表达,不仅造成RhD/CE蛋白不能正常穿膜,还会造成红细胞塌陷,口形和球形红细胞增多[5],细胞水分过多和阳离子外流[6],红细胞在体内存活期缩短,个体易发生轻到中度的代偿性溶血性贫血[7-8],少数重度病例在脾切除术后仍有溶血症状[9]。本文中先证者患有溶血性黄疸,可能与RHAG基因变异有关,脾切除手术未输血,术后溶血和贫血症状减轻。
Rh缺失型可分为无效等位基因型(amorph type)及调节型(regulator type)。Rhmod属于调节型,RHD/CE基因正常,但RHAG是无活性的突变纯合子或双杂合子[10]。本文中先证者的RHAG基因外显子存在425T>C和1126G>A两处变异,均为杂合错义突变,导致Rh抗原表达显著减少的Rhmod型。Rhmod型案例罕见,目前国际上报道的Rhmod型有RHAG1183delA、RHAG3G>T、236G>A[11]、 398T>C、572G>A[12]和707A>C等,比对国内外文献和NCBI、ISBT数据库网站,未发现本文中RHAG两处位点变异的报道,为新的基因变异。
先证者的两处变异,1126G>A遗传自母亲,先证者父亲已故无法测序且无兄弟姐妹子女,推测425T>C可能遗传自父亲。而先证者母亲Rh抗原未见明显异常,母亲应为携有一条正常RHAG基因,一条变异基因。进一步试验可检测先证者及母亲RhAG及其它相关蛋白的表达水平,还可构建突变细胞体外分析变异对蛋白表达的影响。本文三维模型显示先证者1处变异氨基酸位于α-螺旋跨膜区域接近胞内区,2处变异均可能改变氨基酸分子间作用,蛋白功能预测软件预测为有害,推测其可能影响其与RhD/CE蛋白在胞内结合形成多聚体而不利于RhD/CE蛋白跨膜,为探索Rhmod的分子机制提供启示。
利益冲突所有作者均声明不存在利益冲突
