基于网络药理学的“陈皮-半夏”药对治疗冠脉微循环障碍的作用机制研究
2021-12-21金颂峰宫丽鸿邸静鑫
金颂峰,宫丽鸿,邸静鑫
(1. 辽宁中医药大学附属第二医院,辽宁沈阳 110034;2. 辽宁中医药大学附属医院,辽宁沈阳 110032;3. 辽宁中医药大学杏林学院,辽宁沈阳 110016)
近年来,约40%的患者由于急性冠脉综合征入院,但其冠脉造影结果未见明显异常,这就与先前心外膜冠状动脉无狭窄便认为不存在缺血的观点不相吻合,说明此时可能存在着冠脉微循环障碍(coronary microvascular dysfunction,CMD)[1]。冠脉微循环(coronary microvascular)由微动脉(<300 μm)、毛细血管(平均8 μm)和微静脉(<500 μm)构成,是心肌组织发生营养交换、维持心脏各生理功能的重要场所[2]。在各种致病因素的作用下,冠脉微循环的固有结构、功能以及冠脉微血管的阻力出现异常,引发心肌细胞灌注不足,导致以心肌缺血为主要症状的冠脉微循环障碍的发生[3]。CMD 涉及患者人群广泛,其发病可增加心血管相关不良事件的发生风险,引起急性心血管事件甚至死亡的发生。
随着中医药治疗CMD 的研究日益深入,迫切需要从多成分、多靶点、多途径的角度来解释中医药是如何发挥的治疗作用。“陈皮-半夏”作为治疗心系疾病中药复方的核心组成与经典药对,二者常相须为用,可有效改善CMD 的症状,在临床应用非常广泛[4]。正如《太平惠民和剂局方》中的二陈汤,可以充分体现二药合用之功效。陈皮(Citri Reticulatae Pericarpium)为芸香科植物橘(Citrus reticulata)及其栽培变种的干燥成熟果皮,具有理气健脾、燥湿化痰的功效[5]。研究显示[6],陈皮的主要有效成分为黄酮类化合物,其具有调血脂、抗血栓、抗动脉粥样硬化、心脑保护等作用,患者对该化合物的摄入可有效改善心血管疾病。半夏(Pinellia ternata(Thunb.)Breit.)为天南星科植物半夏的干燥块茎,具有燥湿化痰、宽胸散结之功效,可抗炎、抗血栓、抗心律失常和抗氧化等功效[7]。目前,“陈皮-半夏”药对治疗CMD 的药效机制尚不明了,故有待进一步探析。
网络药理学作为一门整合了生物信息学、计算机技术、药理学等众多学科的新兴学科,能够从系统层面揭示各类药物对机体的调控作用,在推进中医药现代化研究的方面发挥了至关重要的作用[8]。因此,本文运用网络药理学方法,探析“陈皮-半夏”药对治疗冠脉微循环障碍的主要活性成分、主要靶点基因、关键通路及其作用机制,为后续相关实验研究提供依据与思路。
1 资料与方法
1.1 收集筛选药对活性成分
以“陈皮”、“半夏”为关键词在中药系统药理学分析平台[9](TCMSP,https://tcmspw.com/tcmsp.php)检索两味中药的所有化学成分。为更好地筛选药对中的有效化合物,本研究联合口服利用度(Oral bioavailability,OB 值)、类药性(Drug-like,DL值)对“陈皮-半夏”药对活性成分进行ADME 属性筛选,基于以往研究[10]将OB≥30%、DL≥0.18 作为为筛选药对主要活性成分的标准。其中OB 值代表生物口服利用度,能够反映药物被机体吸收进入循环的百分比;DL 值代表类药性,能够反映化合物中特定的功能基团与大多数药物相同或相似的物理特征。
1.2 收集筛选药对作用靶点
在TCMSP 数据库中收集并筛选出药对的活性分子及相对应的蛋白靶点后,利用最新版的UniProt数据库(https://www.uniprot.org/),查询靶点蛋白对应的人类基因名称,进行名称标准化处理后录入Excel 表格。使用Cytoscape 3.7.1 软件构建“药对活性成分-有效靶点”网络。
1.3 收集筛选疾病靶点基因
以“Coronary microvascular dysfunction”、“CMD”为关键词分别在使用人类基因数据库(GeneCards,http://www.genecards.org/)和在线人类孟德尔遗传基因数据库(OMIM,https://omim.org/)进行搜索,查找与冠脉微循环障碍相关的疾病靶基因,合并2 个数据库的搜索结果,去除重复和假阳性的基因,获得疾病靶点基因。计算其Relevance score 中位数为3.44,以Relevance score>3.44 作为疾病靶点筛选的标准。
1.4 获取药对与疾病的共同靶点
将1.2 得到的“陈皮-半夏”药对靶点基因与1.3得到的冠脉微循环障碍靶点基因输入在线韦恩图平台(http//bioinfogp. cnb. csic. es/tools/venny/index.html)获得“陈皮-半夏”药对与CMD 的交集靶点基因,绘制韦恩图。
1.5 构建蛋白质相互作用(PPI)网络
将1.4 得到的交集靶点基因上传至String 平台[11](https://string-db.org/),物种设置为人类“Homo sapiens”,其他参数设为默认值,构建蛋白质相互作用网络,下载其数据与初步的PPI 蛋白互作关系图。为进一步筛选核心靶点基因,将下载的数据导入Cytoscape3.7.1 软件中,设置节点大小、颜色来反映连接度值(Degree),再次构建PPI 网络,根据Degree 值筛选核心靶点基因。
1.6 GO 功能、KEGG 通路富集分析
将1.4 得到的交集靶点基因导入DAVID 数据库中(https://david.ncifcrf.gov/home.jsp),校订物种信息为人类,设置P<0.01 后,对其进行GO(gene ontology)生物学过程富集分析[包括:细胞组成(cellular component,CC)、分子功能(molecular function,MF)、生物过程(biological process,BP)]和KEGG 代谢通路(KEGG pathway analysis)富集分析,按P 值升序排列,各选择前20 条分析结果,使用在线绘图工具Bioinformatics 平台(http//http://www.bioinformatics.com.cn/)分别绘制对应的高级气泡图。
1.7 构建“药对活性成分-疾病靶点-通路”网络
在Cytoscape3.7.1 中导入“陈皮-半夏”药对活性成分、关键靶点基因、前20 条KEGG 富集通路,绘制“药对活性成分-靶点-通路”网络图。
2 结果
2.1 药物活性成分及靶点筛选
在TCMSP 数据库中初步收集到179 个“陈皮-半夏”药对活性成分,其中陈皮63 个、半夏116个。本研究以OB 值≥30%、DL 值≥0.18 为为筛选药对主要活性成分的标准,筛选后得到陈皮活性成分5 种,半夏11 种,共计纳入“陈皮-半夏”药对活性成分16 种,成分信息见表1。

表1 “陈皮-半夏”药对活性成分Tab 1 Active components of Chenpi-Banxia drug pair
将预测得到的靶点基因去重后,获得陈皮活性成分作用靶点69 个,半夏128 个,合并去重处理后,共计得到“陈皮-半夏”药对活性成分潜在作用靶点105 个,“药对活性成分-有效靶点”网络图见图1。
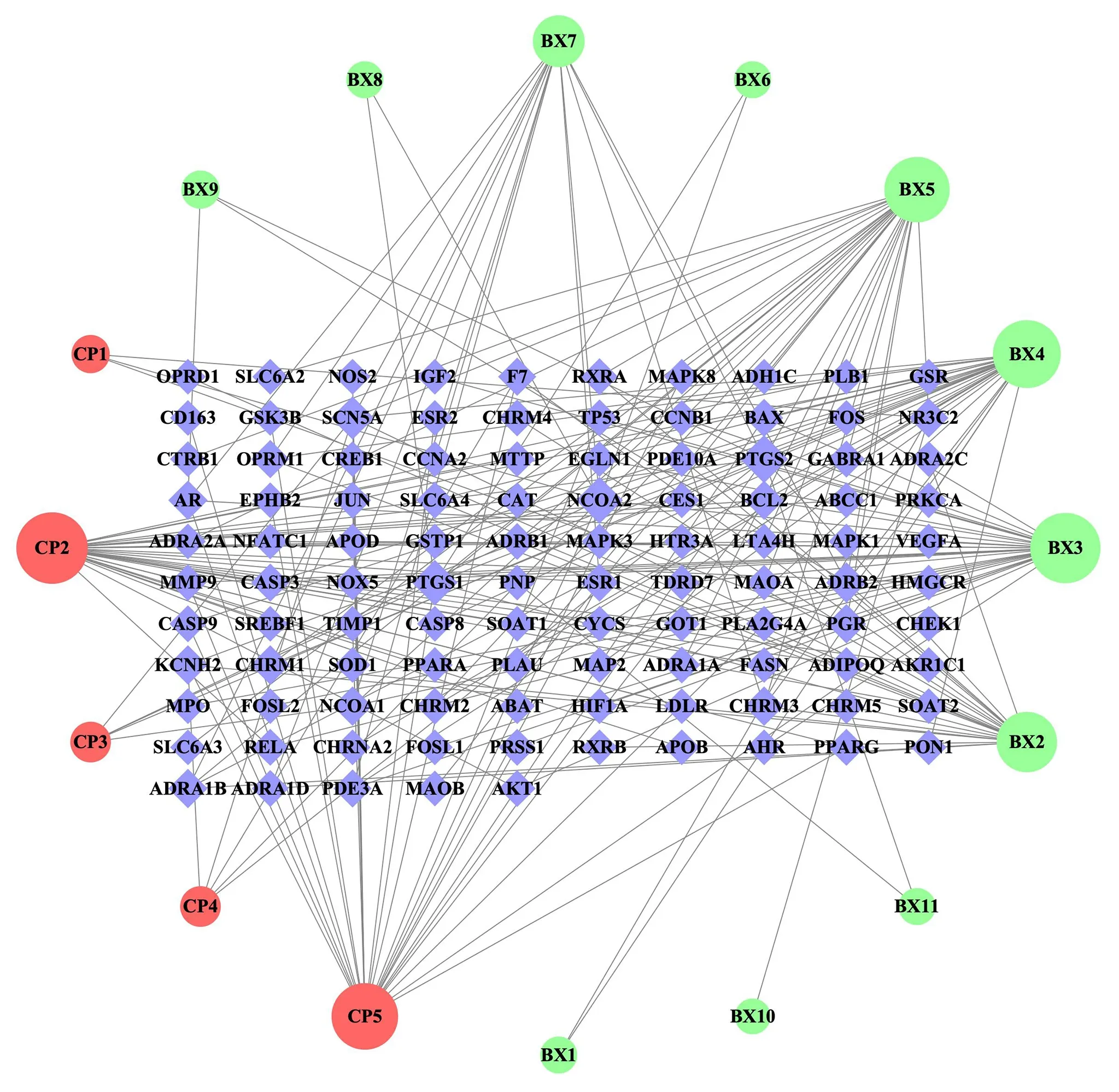
图1 “药对活性成分-有效靶点”网络图Fig 1 Network diagram of active components-effective targets
2.2 CMD 疾病靶点及药对与疾病交集靶点的获取
合并Genecards 和OMIM 数据库搜索结果,去重后共收集到CMD 疾病靶点1 483 个,考虑靶点基因过多,按Relevance Score 分数由高到低进行排序,筛选大于其中位数的靶点后,获742 个靶点。在Venny 平台中将筛选出的“陈皮-半夏”药对活性成分靶点与CMD 疾病靶点取交集,得到56 个交集靶点基因,见图2。
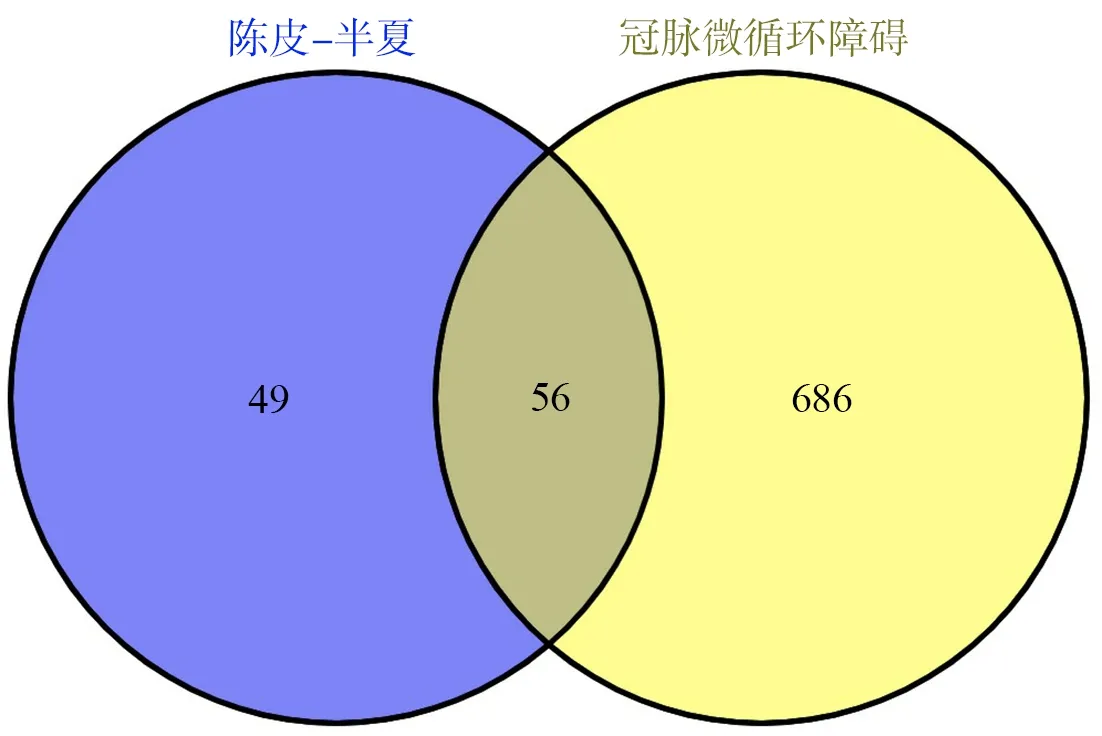
图2 “陈皮-半夏”-CMD 交集基因韦恩图Fig 2 Venny map of intersection target genes of Chenpi-Banxia-CMD
2.3 “陈皮-半夏”药对治疗CMD 的关键靶点PPI网络
在String 平台上传56 个交集靶点基因,下载其数据与初步的PPI 蛋白互作关系图,见图3。为筛选核心靶点基因,将下载的数据导入Cytoscape3.7.1,绘制高级PPI 网络图,见图4。该PPI 网络由56 个节点和556 条边构成,节点越大,颜色越深,连线越密集,则地位越重要。节点度值前5 的靶点为AKT1、VEGFA、BCL2、BAX、JUN,分别对应45、41、38、37、37,提示这些靶点可能是“陈皮-半夏”药对治疗CMD 的关键核心靶点。
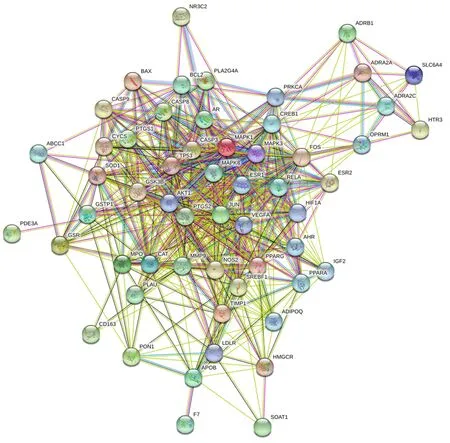
图3 “陈皮-半夏”药对与CMD 的初步PPI 网络图Fig 3 Preliminary PPI network diagram of Chenpi-Banxia drug pair and CMD
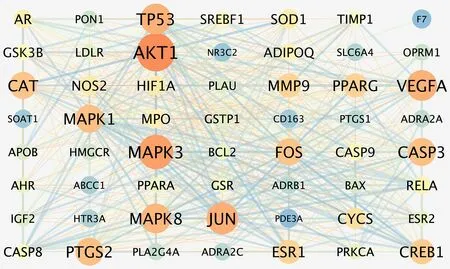
图4 ”陈皮-半夏”药对与CMD 的高级PPI 网络图Fig 4 Advanced PPI network diagram of Chenpi-Banxia drug pair and CMD
2.4 GO 功能和KEGG 通路富集分析
通过DAVID 数据库对“陈皮-半夏”药对活性成分治疗CMD 的关键靶点进行GO 功能和KEGG 通路富集分析,共有409 个GO 术语条目,其中细胞组成(CC)41 个,分子功能(MF)67 个,生物过程(BP)301 个,KEGG 富集显示106 条通路。按P 值排序后,取前20 条通过Bioinformatics 网站绘制高级气泡图,见图5~8。
GO 功能富集分析结果显示,细胞组成(CC)主要集中于胞浆(cytosol)、质膜(plasma membrane)、核(nucleus)等部位,见图5;分子功能(MF)主要集中于蛋白质结合(protein binding)、蛋白质同源二聚活性(protein homodimerization activity)、相同蛋白结合(identical protein binding)等方面,见图6;生物过程(BP)主要集中于转录的正调控、DNA 模板化(positive regulation of transcription,DNA-templated)、凋亡过程的负调控(negative regulation of apoptotic process)、蛋白质磷酸化的正调控(positive regulation of protein phosphorylation)等方面,见图7。
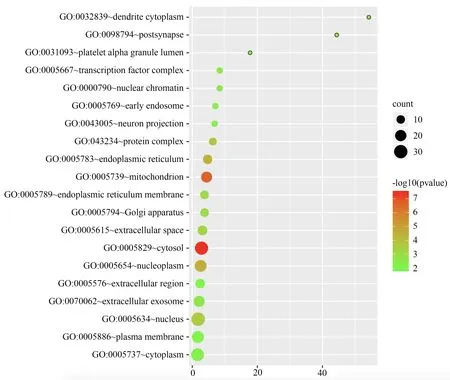
图5 “陈皮-半夏”药对治疗CMD 关键靶点的GO-CC 分析Fig 5 GO-CC bubble diagram of Chenpi-Banxia drug pair in the treatment of CMD key targets
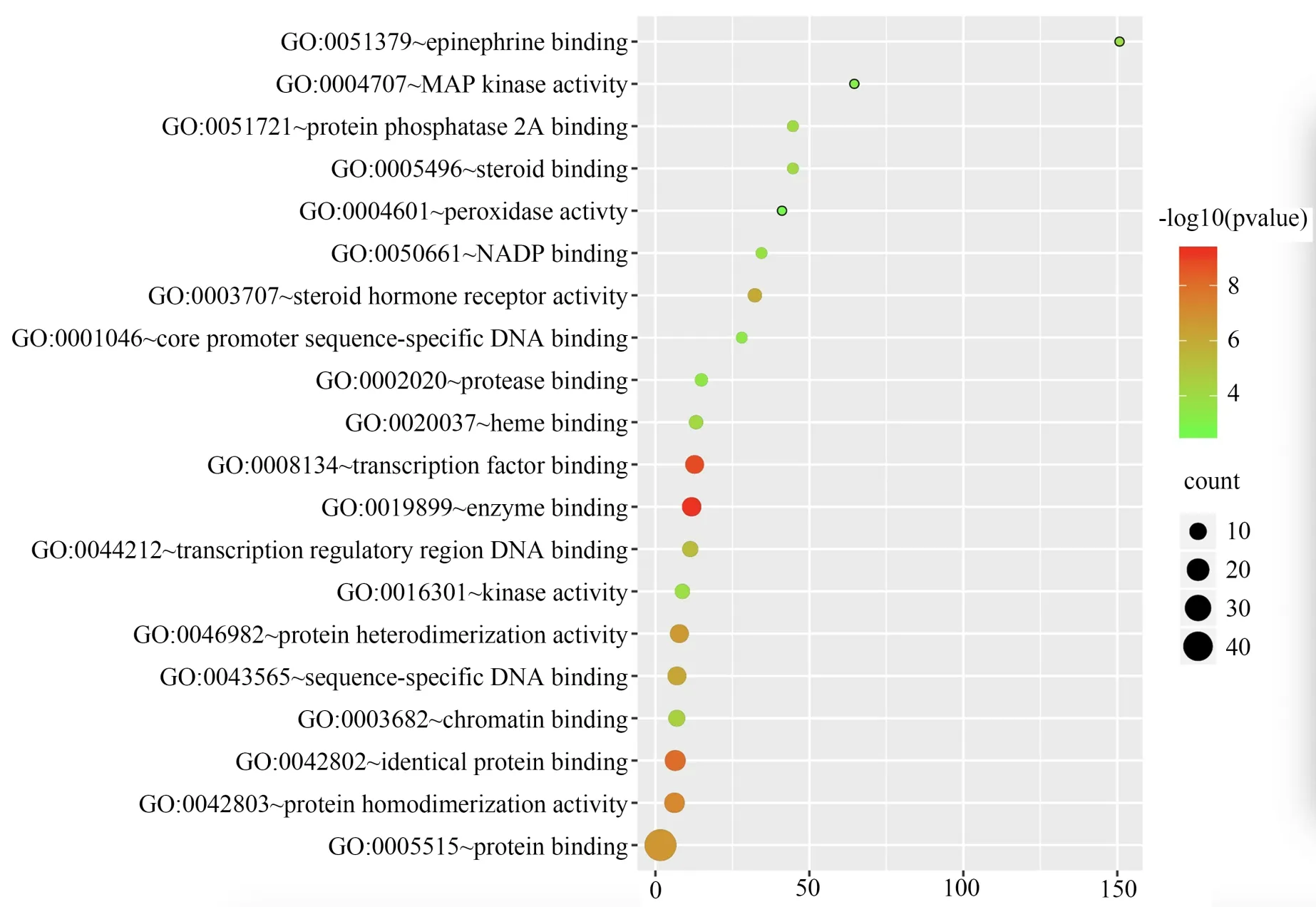
图6 “陈皮-半夏”药对治疗CMD 关键靶点的GO-MF 分析Fig 6 GO-MF bubble diagram of Chenpi-Banxia drug pair in the treatment of CMD key targets
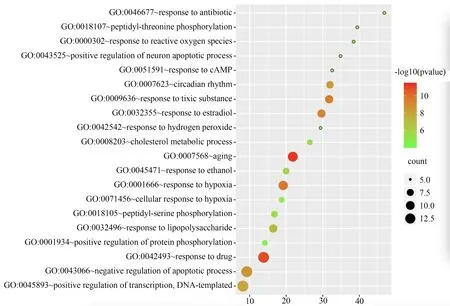
图7 “陈皮-半夏”药对治疗CMD 关键靶点的GO-BP 分析Fig 7 GO-BP bubble diagram of Chenpi-Banxia drug pair in the treatment of CMD key targets
KEGG 通路富集分析结果显示,PI3K-Akt 信号通路(PI3K-Akt signaling pathway)、癌症蛋白聚糖(Proteoglycans in cancer)、癌症通路(Pathways in cancer)、鞘脂信号通路(Sphingolipid signaling pathway)、低氧细胞应激信号通路(HIF-1 signaling pathway)等20 条关键通路与“陈皮-半夏”药对治疗CMD 可能相关,见图8。根据以上KEGG 通路富集结果,并结合文献查阅,筛选出与CMD 相关的通路,涉及PI3K-Akt、TNF、VEGF、Apoptosis、HIF-1等信号通路。
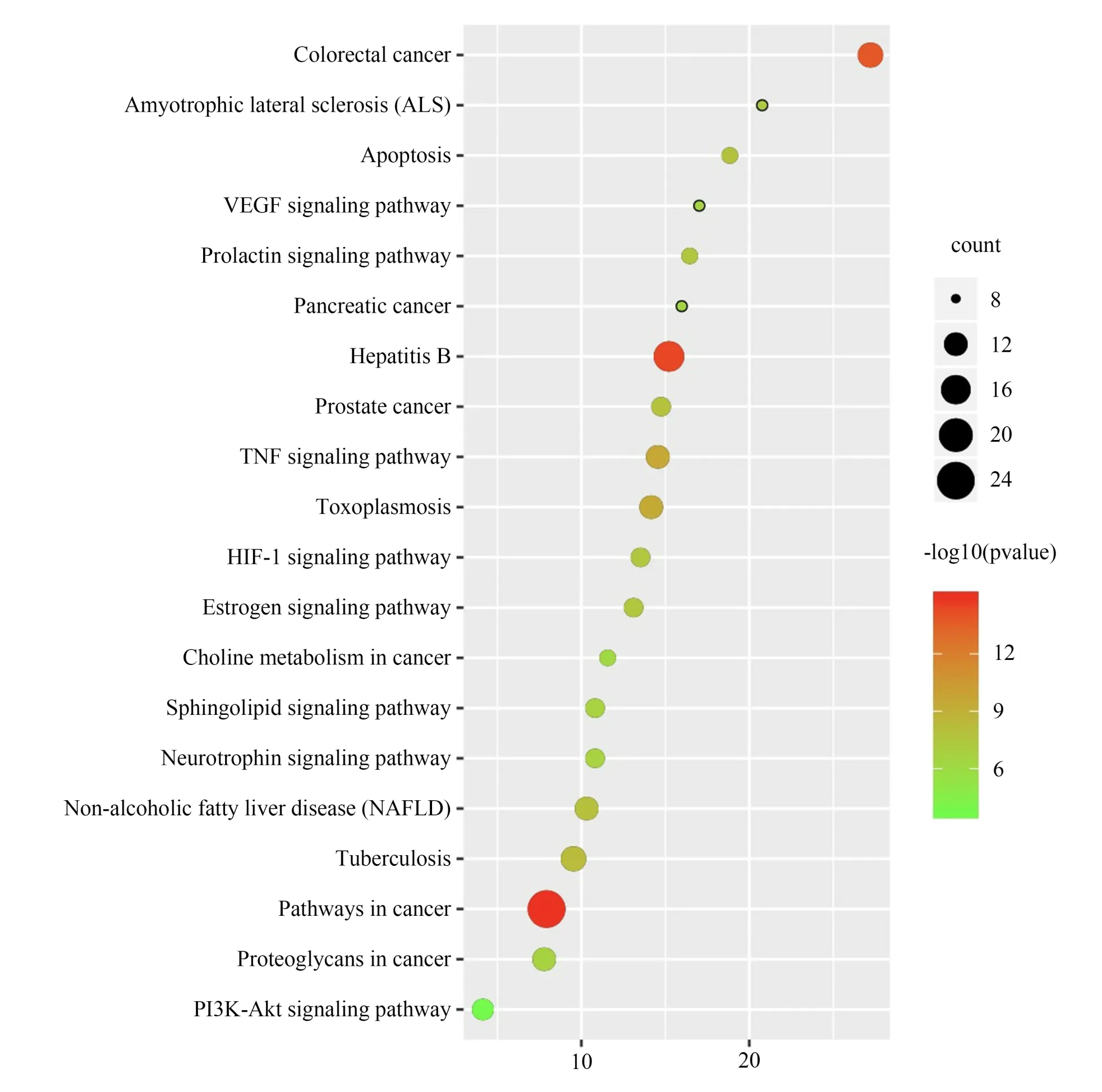
图8 “陈皮-半夏”药对治疗CMD 关键靶点的KEGG 通路富集分析Fig 8 KEGG bubble diagram of Chenpi-Banxia drug pair in the treatment of CMD key targets
2.5 “药对活性成分-疾病靶点-通路”网络图
将“陈皮-半夏”药对活性成分、关键靶点基因、前20 条KEGG 富集通路导入Cytoscape3.7.1,绘制“药对活性成分-疾病靶点-通路”网络图,见图9。其中粉色V 形节点代表通路,红色与绿色圆形节点分别代表两种药物活性成分,紫色菱形节点代表关键靶点基因,对应标记见表1。该网络图反映出“陈皮-半夏”药对治疗CMD“多成分、多靶点、多通路”的调控特点。
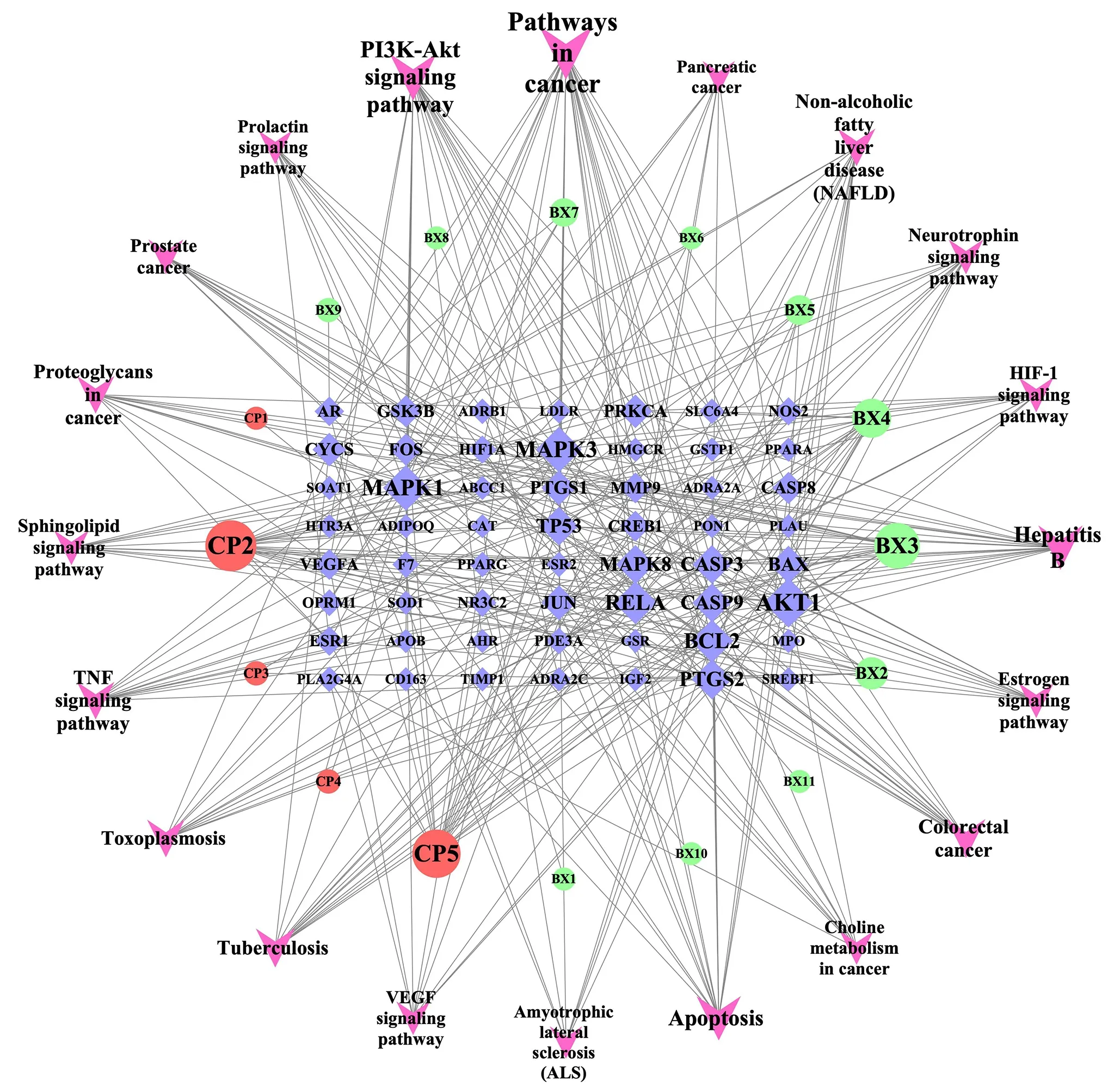
图9 “药对活性成分-疾病靶点-通路”网络图Fig 9 Active ingredients-disease target-pathway network diagram
3 讨论
自20 世纪中期以来,生理学家已经认识到冠脉微循环对于维持心肌灌注具有重要意义[12],因此对冠脉微循环障碍的研究显得尤为重要。冠脉微循环障碍(CMD)主要指冠脉微循环血管的结构、形态、功能障碍,从而导致微血流异常及血液流变性紊乱[13]。目前的硏究认为,CMD 与介入后无复流、慢血流、微血栓形成、心肌缺血再灌注损伤等有关[14]。根据CMD 的临床表现,可将其归属为中医学的“胸痹”范畴。现代人嗜食肥甘,导致脾气虚弱,健运失施,水湿内阻,聚湿生痰。痰凝可致血瘀,二者胶结而生内热,进而热盛风动,导致脉络绌急,这就与CMD 血管栓塞痉挛的发病机制相似[15]。“陈皮-半夏”作为祛湿化痰、宽胸散结的经典药对,是中医治疗心系疾病中药复方中的核心组成。但目前尚缺乏“陈皮-半夏”药对治疗CMD 的相关实验研究,故在此运用网络药理学进行初步探讨。
研究基于网络药理学探讨“陈皮-半夏”药对治疗冠脉微循环障碍的潜在作用机制,通过检索TCMSP 数据库得到“陈皮-半夏”药对关键化学成分179 个,参与调节冠脉微循环障碍的关键化学成分105 个,且度数在前三位为柚皮素[16]、诺比林[17]、黄芩素[18]、β-谷甾醇[19],均被报道在CMD 等心血管疾病的治疗过程中发挥良好的作用。通过PPI 网络图的分析中可知,“陈皮-半夏”药对作用靶点与CMD靶点之间相互影响,靶点间的关系错综复杂,表明其治疗作用机制复杂多样。统计其中关联性最高的靶点,位于前几位的靶点分别为AKT1、VEGFA、BCL2、BAX、JUN。AKT1 是PI3K 下游直接的重要蛋白,是AKT 三个同种型蛋白结构中的一种[20],AKT 活化后可以调节VEGF 介导的血管生长[21],使内皮细胞迁移来减慢心功能受损速度,还可通过抑制心肌细胞凋亡来增加心肌细胞活性,磷酸化的AKT 具有抗凋亡、促细胞生存及促蛋白合成等活性[22]。BCL2 和BAX 是BCL2 家族中被公认的一对调控凋亡的关键基因[23],BAX 可降低BCL2表达并升高细胞内Ca2+,促进细胞凋亡;而BCL2 则通过一种抗氧化剂或抑制氧自由基生成,改变细胞内Ca2+外流,调节细胞内cGMP 含量,抑制细胞凋亡[24]。JUN 是组成转录因子AP-1(激活蛋白-1)的一类蛋白族,包括c-JUN、v-JUN、JUN B 和JUN D。研究表面[25]AP-1 通过对各种生长因子和细胞因子的转录,参与调节细胞增殖、分化、凋亡以及炎症等多种细胞过程,其中c-JUN 蛋白对诱导炎性介质分泌起重要作用[26]。通过可视化网络可见“陈皮-半夏”药对治疗CMD 是通过激活AKT1 抗凋亡与促细胞生存以保护心肌细胞、调节VEGF 介导冠脉微循环血管内皮细胞生长、调控BCL2 和BAX 抑制凋亡保护冠脉微循环、调节JUN 蛋白调控炎性介质分泌以减慢CMD 形成过程中的炎症反应等多途径多靶点发挥用,具有多种潜在作用机制。
GO 生物学富集过程提示冠脉微循环障碍的治疗与抑制细胞凋亡、保护冠脉微循环内皮细胞功能、抑制炎性反应等密切相关,这与PPI 得到的结果相吻合。通过KEGG 通路富集分析及相关文献查阅可知,陈皮-半夏”药对治疗CMD 主要涉及PI3K-Akt、TNF、VEGF、Apoptosis、HIF-1 等信号通路。近年来有研究发现PI3K-Akt 信号通路的下调可以抑制冠脉微循环内皮细胞的迁移、增殖和血管形成,提示冠脉微循环内皮细胞功能障碍可能与PI3K-Akt 信号通路障碍相关[27]。TNF 作为炎症相关通路,肿瘤坏死因子-α(TNF-α)的生物学活性占其总活性的70%~95%,可促使大量白细胞活化、聚集,并黏附于冠脉微循环内皮细胞,从而阻塞微血管,同时其也可以活化血小板促进冠脉微循环内血栓形成,加重组织炎症,最终导致CMD 的发生[28]。冠脉微循环内皮细胞功能障碍是CMD 发生的主要病理生理机制,VEGF 作为介导血管内皮生长因子的重要信号通路能够促进血管内皮细胞增生、促进血管增生、增加血管通透性,故VEGF 通路对冠脉微循环内皮细胞功能的保护起到至关重要的作用[29]。研究发现细胞凋亡可能是引发血管内皮功能障碍进而导致CMD 发生的重要原因[30],因此基于Apoptosis 相关通路,从抑制细胞凋亡的角度保护血管内皮功能,已成为保证冠脉微循环稳定、治疗CMD 不可替代的基础[31]。HIF-1 作为低氧细胞应激信号通路,其生物活性主要是由HIF-1α 决定。研究发现,HIF-1α 的稳定表达对心血管系统有一定保护作用,当HIF-1α 表达水平增高时,可使患者血清缺氧和炎症反应程度明显增加,导致冠脉微循环血管内皮细胞损伤更加严重[32]。
综上所述,“陈皮-半夏”药对主要通过保护冠脉微循环内皮细胞功能、抑制细胞凋亡、影响炎性反应等途径治疗冠脉微循环障碍。研究通过构建“药对活性成分-疾病靶点-通路”网络对“陈皮-半夏”药对的关键活性成分以及靶标进行了预测,并将研究结果与已知实验结果进行对比,所得结果真实可靠,为后续的“陈皮-半夏”药对的临床应用以及CMD 相关疾病的基础与临床研究提供了数据支持。
