EphA4 受体对大鼠海马脑区神经元脑源性神经营养因子蛋白质和转录本表达的影响
2021-12-21马娜陈静史晋朝张倩李建国
马娜,陈静,史晋朝,张倩,李建国
山西医科大学生理学系细胞生理学教育部重点实验室,山西太原030001
脑卒中占全世界所有死亡人数的9%,目前尚无有效的治疗手段[1]。大脑作为机体内最重要的器官,具有多种自我保护机制,如抗氧化、抗兴奋毒性、抗凋亡、抗炎和降低能量代谢等机制的激活,损伤晚期增强促存活基因的表达等[2]。卒中后脑组织功能结构的改变是损伤刺激和脑内保护机制激活共同作用的结果。因此,对神经元损伤的防治不应只注重减少损伤,同时应注重增强内源性保护机制的作用[2-3]。其中,增强脑组织促存活基因的表达,如脑源性神经生长因子(brain-derived neurotrophic factor,BDNF),是一种重要的自我保护机制[4]。
BDNF 作为神经营养素家族的一员,通过其酪氨酸激酶受体信号系统参与神经发生、神经元分化、神经元存活和突触可塑性等调节过程[5-6],且与缺血脑损伤密切相关。大鼠BDNF 基因包含11 个外显子(Ⅰ~ⅨA),可被各自剪接至同一个的编码外显子(Ⅸ)后,形成11 种BDNF 转录本,并最终翻译为一种成熟BDNF 蛋白[7]。不同转录本分别由各自启动子进行转录调节,不同mRNA 的翻译效能不同,并最终影响BDNF 蛋白的表达水平[8]。其中转录本Ⅰ、Ⅱ、Ⅳ和Ⅵ在人类与啮齿类动物间高度保守[9]。本研究中由于BDNF mRNA 序列高度同源,非同源序列较短,未能设计出特异性引物将其严格区分,只检测了BDNF 转录本Ⅰ、Ⅱc、Ⅲ、Ⅳ、Ⅵ和Ⅹ1。这些转录本各自有单独的启动子转录调节机制,同时受细胞内多种信号通路的调控。
Eph 受体是酪氨酸激酶受体家族中含量最大的受体,ephrin 配体-Eph 受体信号系统在生物体发育过程和组织体内稳态维持中发挥重要作用。Eph 受体分为EphA 和EphB 两个亚型,EphA 受体主要参与神经系统发育过程中神经网络的形成、神经再生和突触可塑性。研究表明,短暂脑缺血大鼠海马CA1区椎体神经元EphA4 受体水平上调,抑制EphA4 受体功能减弱了缺血后CA1 椎体神经细胞死亡[10]。因此,探讨Eph 受体是否通过影响BDNF 蛋白的表达,增强受损神经元的内在保护机制,将为临床上脑卒中的治疗以及神经元保护提供新的思路。本研究探讨了EphA4 受体对大鼠海马脑区神经元BDNF 蛋白质和转录本表达的影响,现报道如下。
1 材料与方法
1.1 实验动物 SPF 级健康SD 大鼠乳鼠,出生1 ~3 d,由山西医科大学实验动物中心提供,许可证号:SYXK(晋)2015-0001。本实验对大鼠乳鼠的所有处理均以科研为目的进行使用,且按照山西医科大学动物伦理相关规定进行[SYXK(晋)2015-0001]。
1.2 主要试剂及仪器 EphA4-Fc 购自美国R&D Systems 公司;BCA 蛋白定量试剂盒和HRP 标记的山羊抗兔二抗购自武汉博士德生物工程公司;12%蛋白预制胶、转印仪及凝胶成像仪购自美国Bio-Rad公司;BDNF 兔单克隆抗体(ab108319)购自英国Abcam公司;β-actin 兔单克隆抗体购自美国Bioworld Technology 公司;细胞总RNA 提取试剂盒购自北京天根生化科技有限公司;PCR 反转录及扩增试剂盒购自日本TaKaRa 公司;PVDF 膜购自美国Merckmillipore公司;荧光定量PCR 仪购自美国罗氏公司。
1.3 海马神经元的原代细胞培养及分组给药 取SD大鼠乳鼠(雌雄不限),用75%酒精浸泡5 s 消毒,断头,剪开颅骨,取出全脑,置于无菌滤纸上,以脑中线为起点,拨开大脑皮层,暴露出新月状海马回,夹出海马组织,立即置于2 mL 4 ℃无菌PBS 溶液中,在倒置显微镜下剔除微血管、脑膜和非海马的多余脑组织。将剔好的海马组织置于1 mL 4 ℃PBS 溶液中,剪成约1 mm3的组织小块,加入1 mL 0.25%胰蛋白酶,轻轻晃动摇匀,37 ℃细胞培养箱消化15 ~20 min;将消化后的组织块和消化液一起移入15 mL离心管中,加入3 mL 完全培养液(80%高糖DMEM +10%胎牛血清+10%马血清+0.1%青、链霉素)终止消化5 min,待组织块下沉至管底,弃上清,加入5 mL完全培养液清洗5 min,弃上清,再加入3 mL 完全培养液,用口径细而圆钝的玻璃吸管吹打20 次,将离心管静置5 min,吸取上层细胞悬液,经200 目无菌滤网过滤至另一离心管中。若吹打1 次后仍有不少组织沉淀,可再加入2 mL 完全培养液继续吹打10 次。加入足够的完全培养液,吹打均匀,快速计数,根据计数结果,调整细胞终浓度为(5 × 105~ 1 ×106)个 / mL,接种于培养皿中,轻晃混匀,置 37 ℃,5% CO2培养箱中培养,12 h 内禁止晃动。接种16 h后,去除完全培养液,加入2 mL B27 无血清培养基,每3 d 半量换液1 次,培养至6 ~7 d,将培养的原代海马神经元细胞分为正常对照组和EphA4-Fc 组,EphA4-Fc 组给予 EphA4 受体拮抗剂 EphA4-Fc(细胞培养液内 EphA4-Fc 浓度保持在 10 μg / mL),培养7 d 后,检测BDNF 蛋白和mRNA 的表达。
1.4 BDNF 蛋白表达的检测 采用Western blot 法。提取各组海马神经元总蛋白,使用BCA 蛋白定量试剂盒测定蛋白浓度。取50 μg 蛋白,经12% SDSPAGE 分离后,转印至 0.2 μm PVDF 膜上,室温下以0.3%明胶封闭3 h;加入BDNF 兔单克隆抗体和β-actin 兔单克隆抗体(1 ∶4 000 稀释),4 ℃孵育过夜;加入 HRP 标记的山羊抗兔二抗(1 ∶8 000 稀释),4 ℃孵育2 h,化学发光成像。以β-actin 为内参照,使用Image J 软件对蛋白条带进行定量分析。
1.5 BDNF mRNA 表达的检测 采用qPCR 法。提取各组海马神经元细胞总RNA,使用反转录试剂盒反转录为cDNA,再使用扩增试剂盒进行qPCR 扩增,检测BDNF mRNA 水平。BDNF mRNAⅠF 引物序列:5′-CACTGAGTCTCCAGGACAGCAAAG-3′,R 引物序列:5′-CACAGCTGGGTAGGCCAAGT-3′;BDNF mRANⅡc F 引物序列:5′-ATGCAAGTGTTTATCTCCAGGATCT-3′,R 引物序列:5′-CACAGCTGGGTAGGCCAAGT-3′;BDNF mRAN Ⅲ F 引物序列:5′-GGGCTGGATGCTTCATTGAG-3′,R 引物序列:5′-GGGTAGGCCAAGTTGCCTTGT-3′;BDNF mRAN Ⅳ F 引物序列:5′-CAGAGCAGCTGCCTTGATGTTTA-3′,R 引物序列:5′-GGGTAGGCCAAGTTGCCTTGT-3′;BDNF mRAN Ⅵ F 引物序列:5′-GAGAGCTTTGTGTGGACCCTGA-3′,R 引物序列:5′-GGGTAGGCCAAGTTGCCTTGT-3′;BDNF mRANⅩ1 F 引物序列:5′-ATCCCTTCAGTGCGAGAGAAAA-3′,R 引物序列:5′-GTGGAACACCCTTCCTCGTCT-3′;内参基因 GAPDH F 引物序列:5′-GGAGAAACCTGCCAAGTATGA-3′,R 引物序列:5′-TTGAAGTCACAGGAGACAACC-3′。引物序列由宝生物工程(大连)有限公司设计合成。扩增条件:95 ℃预变性 30 s;95 ℃变性 5 s,60 ℃退火延伸34 s,共40 个循环。以GAPDH 作为内参照,利用2-△△Ct法计算 BDNF 多个 mRNA 的相对表达量。
1.6 统计学分析 利用SPSS 22.0 软件进行统计学分析,实验数据以Mean ± SEM 表示,各组两两比较采用t 检验,以P < 0.05 为差异有统计学意义。应用GraphPad prism 6 软件绘制统计图。
2 结 果
2.1 抑制EphA4 受体功能对大鼠海马脑区神经元BDNF 蛋白表达的影响 Western blot 分析显示,与正常对照组相比,EphA4-Fc 组大鼠海马神经元BDNF蛋白的表达水平从0.98±0.06 升高至1.36±0.04,且差异有统计学意义(t=5.485,P=0.00 15),见图1。
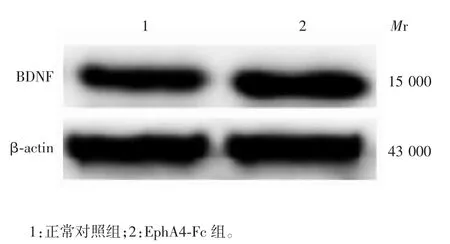
图1 Western blot 分析两组大鼠海马脑区神经元BDNF蛋白的表达(n = 4)Fig.1 Western blotting of BDNF protein expression in rat hippocampal neuron of two groups(n = 4)
2.2 抑制EphA4 受体功能对大鼠海马脑区神经元BDNF mRNA 表达的影响 qPCR 结果显示,与正常对照组相比,EphA4-Fc 组大鼠海马脑区神经元BDNF mRNA 中转录本Ⅱc 的表达水平明显升高,且差异有统计学意义(t = 6.915,P = 0.000 3),见图 2。
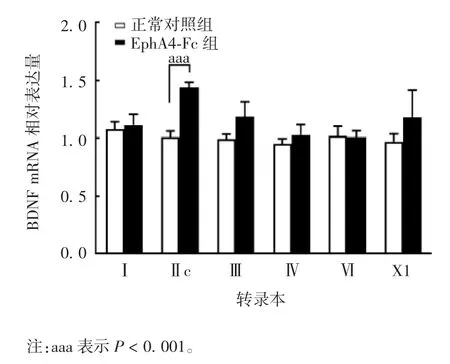
图2 两组大鼠海马脑区神经元BDNF mRNA 的表达(n = 5)Fig.2 BDNF mRNA expression in rat hippocampal neurons of two groups(n = 5)
3 讨 论
脑卒中是缺血性心脏疾病之后的第二常见的死亡原因和首位致残原因[11-12],而目前对缺血后脑损伤的机制仍未阐明。20 余年来,兴奋性神经毒所致的钙超载学说一直在缺血性脑损伤的发生机制研究中占有首要地位[13],但谷氨酸受体拮抗剂和钙通道阻断剂的临床实验结果不理想。本研究发现,通过给与培养神经元EphA4-Fc 拮抗EphA 受体功能后,BDNF 蛋白表达量增多。
BDNF 作为机体细胞一种重要的内源性保护物质[4],其研究越来越受到重视。BDNF 不但在损伤晚期增强脑的修复,而且可在损伤早期通过多种途径和机制实现其神经保护作用,如抗细胞内Ca2+超载;对抗氧化应激;增强线粒体功能;抗细胞凋亡;改变离子通道功能;促进新生神经元形成等功能[14]。BDNF 分布在中枢神经系统、周围神经系统、骨和软组织等广泛区域内,但主要在中枢神经系统内表达。成年小鼠和大鼠整个大脑均有BDNF 表达,其中在海马区神经元表达最高[15]。成熟BDNF 蛋白与酪氨酸激酶受体结合,通过PI3K 和MAPK 等信号通路转导,发挥促进细胞存活、轴突生长、可塑性和细胞迁移等功能[16]。
细胞各种功能处在一个动态平衡的调节状态,如在神经元轴突生长和突触形成过程中,BDNF 通过其受体TrKB 发挥促进作用,而ephrinA 通过其受体EphA(与TrKB 同属酪氨酸激酶受体)发挥抑制效应。Eph 受体亦属于酪氨酸激酶受体家族,分为EphA 和EphB 两个亚型。EphA 参与神经系统发育过程中神经网络的形成、神经再生和突触可塑性。EphA4 受体酪氨酸激酶在中枢神经系统的发育中起重要作用。Ephrin-A3 和EphA4 之间的相互作用对于通过排斥效应调节突触功能、可塑性和脑重塑至关重要[17]。在成年人中,EphA4 富集在海马中,海马体是一种大脑结构,不仅对学习和记忆至关重要,还易受缺血性损伤。本课题组前期研究发现,大鼠脑缺血后CA1 区ephrinA3 及其受体EphA4 表达增高,阻断EphA4 后能够减少神经元死亡[10],这与本实验结果相一致。
本研究同时发现,通过给与培养神经元EphAFc 拮抗EphA 受体功能后,BDNF mRNA 转录本中Ⅱc 表达增多,而其他转录本无明显变化。BDNF 基因包括 9 个 5′-端非编码外显子和 1 个 3′-端编码外显子,经选择性剪接后共形成11 种转录本。不同转录本分别由各自启动子进行转录调节,不同mRNA的稳定性及翻译效能不同,并最终影响BDNF 蛋白的表达水平[8]。其中转录本Ⅰ、Ⅱ、Ⅳ和Ⅵ由于在人类与啮齿类动物间高度保守[9],且研究表明,其启动子区域的DNA 甲基化及组蛋白修饰改变后,可导致转录本表达发生改变。本研究通过检测大鼠乳鼠海马脑区神经元给予EphA4 受体拮抗剂后发现,BDNF 蛋白及Ⅰ、Ⅱc、Ⅲ、Ⅳ、Ⅵ和Ⅹ1 转录本表达各异,这与我们前期研究结果一致,即不同转录本的表达会影响BDNF 蛋白的翻译水平[18]。抑制EphA4受体功能能够增高大鼠海马脑区神经元BDNF 蛋白表达,并与BDNF mRNA 中转录本Ⅱc 的表达水平升高相关,提示转录本Ⅱc 将会成为临床通过增加BDNF 蛋白治疗卒中过程中的重要靶点。
EphA 受体可通过多种信号途径调节神经元的存活,如Src 激酶信号通路、丝分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路以及小分子GTP 酶RhoA、Rac 或细胞分裂周期42(Cdc42)的视素信号通路[19-20]。研究发现,MAPK 信号通路激活可降低组蛋白乙酰化程度[21]。组蛋白乙酰化修饰可调控细胞内基因的转录水平,在脑缺血大鼠,海马CA1 区BDNF 蛋白表达水平降低与BDNF启动子 1、2、4、6 区组蛋白 H3K27 的乙酰化程度降低相关[18]。因此我们推测,抑制EphA4 受体功能能够通过抑制其下游MAPK 信号,增加BDNF 组蛋白乙酰化程度,使BDNF mRNA 中转录本Ⅱc 的表达水平升高,进而增加BDNF 蛋白的表达。
综上所述,本研究发现,EphA4 受体信号通路与大鼠海马脑区神经元BDNF 转录本及BDNF 蛋白表达相关,抑制EphA4 受体功能通过mRNA 转录本Ⅱc的表达增加,使大鼠海马脑区神经元BDNF 蛋白翻译增加,从而能够增强损伤神经元的内在保护机制。本研究为临床上脑卒中的治疗以及神经元保护提供了新的思路。
