前列腺纤维性增生的差异表达基因筛选及富集研究*
2021-12-21万少平蔡季肖靓琨
万少平,蔡季,肖靓琨
(1.岳阳市人民医院泌尿外科,湖南岳阳 414000;2.织金县人民医院泌尿外科,贵州织金 552100;3.岳阳市人民医院外科,湖南岳阳 414000)
良性前列腺增生是引起中老年男性排尿障碍最常见的良性疾病之一[1],随着年龄增长,少数患者会出现尿潴留[1-3]。临床经尿道前列腺电切治疗男性下尿路症状和尿潴留时,发现大多数患者良性前列腺增生是尿道周围腺体的扩大增生,导致排尿困难;显微镜下观察电切前列腺组织,前列腺增生多呈结节性改变,以不同比例间质和腺上皮构成;少数排尿困难的患者,前列腺扩大增生不明显,术中发现前列腺稍增大,甚至变小,呈纤维性收缩,电切组织显微镜下观察组织间质以胶原纤维增生为主,仅见少量增生腺体[4-8]。本研究通过差异基因(differentially expressed genes, DEGs)比较的方法,认识纤维性增生的致病基因,不仅可以深入认识其病理发生的分子本质,为良性前列腺纤维性增生提供基因诊断方法,而且可以指导该类型前列腺增生的治疗。
1 资料与方法
1.1 一般资料
选取2017年2月—2019年12月岳阳市人民医院和织金县人民医院收治的前列腺增生患者14 例,年龄60~91 岁。所有患者出现尿潴留,前列腺特异性抗原<4 ng/L。入院后行前列腺等离子电切手术治疗,病理诊断为良性前列腺增生,其中纤维性增生7 例(纤维组),结节性增生7 例(结节组)。
所有标本在手术切除后,用生理盐水冲洗3 次,去除血迹,30 min 内放入液氮速冻,置入-80℃冰箱冷冻保存。
1.2 主要试剂及仪器
Trizol RNA 提取试剂盒(美国Invitrogen 公司),Agilent 2100 bioanalyzer(美国Agilent Technologies 公司),六碱基随机引物(深圳华大基因公司),QiaQuick PCR 试剂盒(美国Qiagen 公司),qPCR TaqMan Probe(美国Yeasen 公司)。NanoDrop 分光光度计和Qubit 荧光计(美国赛默飞世尔科技公司)。
1.3 方法
1.3.1 提取总RNA标本送深圳华大基因公司,按照Trizol RNA 提取试剂盒说明书进行操作,提取结节性前列腺增生组织及纤维性前列腺增生组织RNA。采用Nanodrop 检测RNA 的纯度(260~280 mm光波处的OD 值),琼脂糖凝胶电泳分析RNA 程度以及是否被污染,Qubit 定量检验RNA 浓度;Agilent 2100 检测RNA 的完整性。
1.3.2 文库制备检测总RNA 样本合格后,采用Oligo(dT)磁珠富集mRNA,将mRNA 打断成短片段模板,用六碱基随机引物合成cDNA 链。cDNA 链经过QiaQuick PCR 试剂盒纯化,洗脱,末端修复,连接测序接头,琼脂糖凝胶电泳,PCR 扩增富集cDNA,完成文库制备。
1.3.3 测序文库构建完成后,Qubit 2.0 初步定量,Agilent 2100 检测文库的Insert size,qPCR TaqMan Probe 准确定量文库的有效浓度(>2 nm)。合格后,通过MGIseq-2000测序平台进行PE150测序。
1.4 统计学方法
测序数据采用SOAPnuke(v1.5.2)过滤,过滤后的数据采用Bowtie2(v2.2.5)进行比对,基因相对表达量用RSEM(v1.2.12)计算,用DESeq2(v1.4.5)进行差异基因分析,将校正后的P<0.05,且差异倍数≥2作为筛选标准。将差异表达基因进行GO 富集分析,用DAVID 工具分析KEGG 信号通路富集情况。
2 结果
2.1 差异基因相对表达量分析
对比两组后发现差异表达基因1 598 个;相较于结节组,纤维组有1 063 个基因相对表达量上调,535 个基因相对表达量下调。见图1。

图1 差异基因相对表达量的火山图
2.2 差异基因的GO富集分析
GO 富集分析将DEGs 分为3 类:生物学过程、分子功能、细胞组分。在生物学过程中,DGEs 主要富集在离子转运、细胞黏附、细胞外基质等生物学过程中(见图2)。在分子功能中,DGEs 主要富集在近端启动子DNA 结合转录激活剂、RNA 聚合酶Ⅱ、DNA 结合转录激活剂、信号受体结合等活性分子功能上(见图3)。在细胞组分中,DGEs主要富集在细胞膜、细胞外区域、质膜等细胞部位(见图4)。
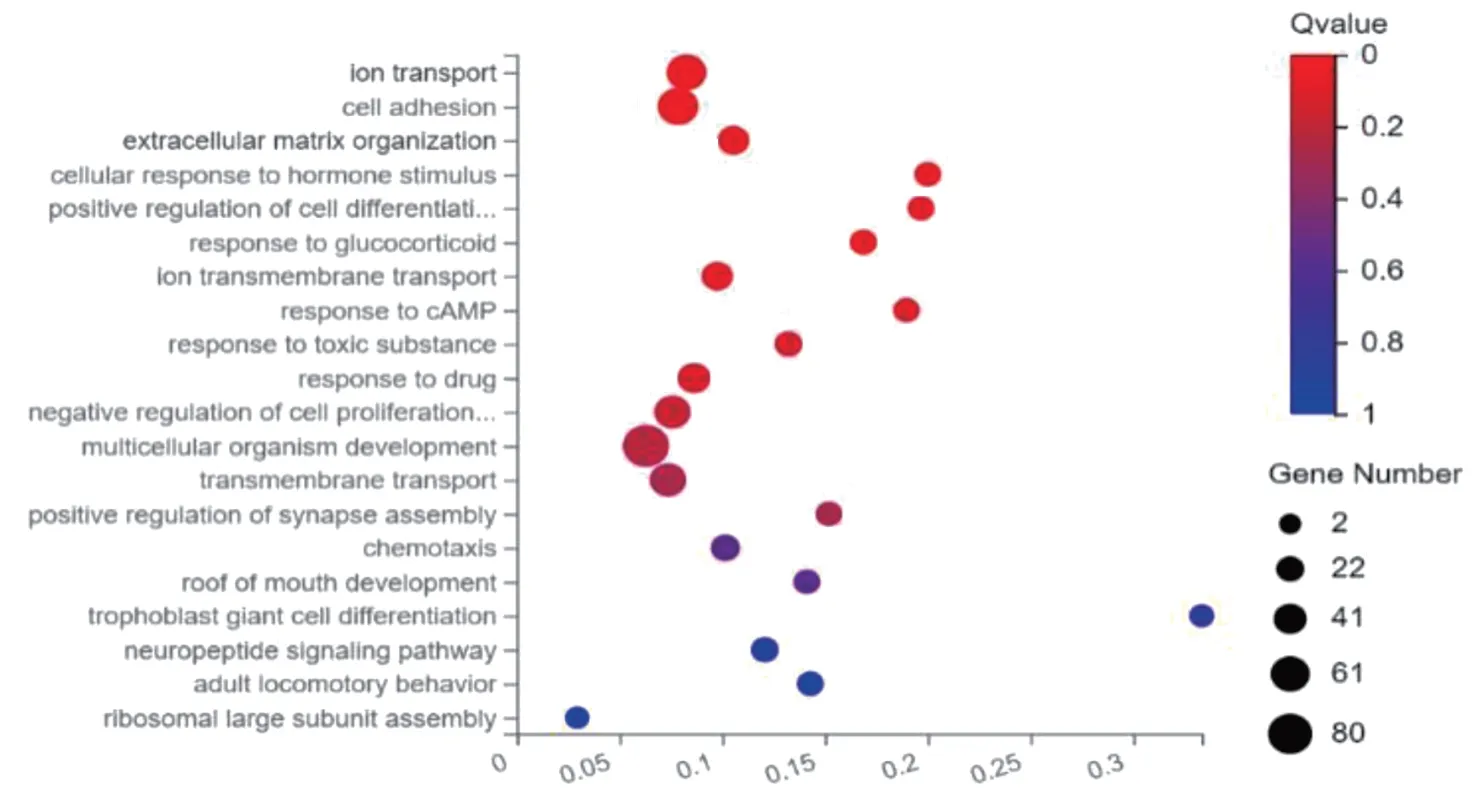
图2 GO富集分析中生物过程组气泡图
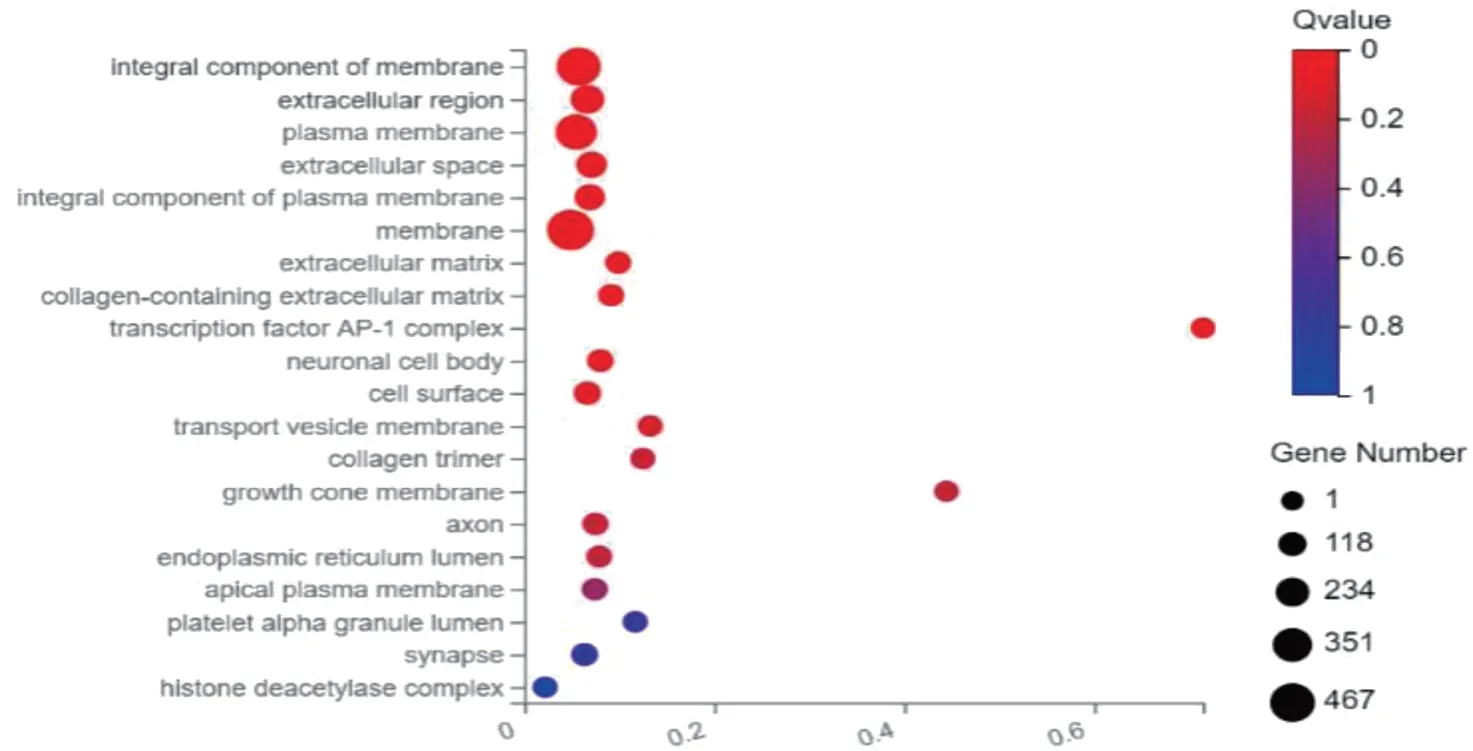
图3 GO富集分析中细胞组分组气泡图

图4 GO富集分析中分子功能组气泡图
2.3 差异基因的KEGG通路分析
通过DAVID 工具对DEGs 进行KEGG 信号通路分析后发现,DEGs 主要富集在细胞外基质—受体、细胞因子与细胞因子受体等信号通路上(见图5)。
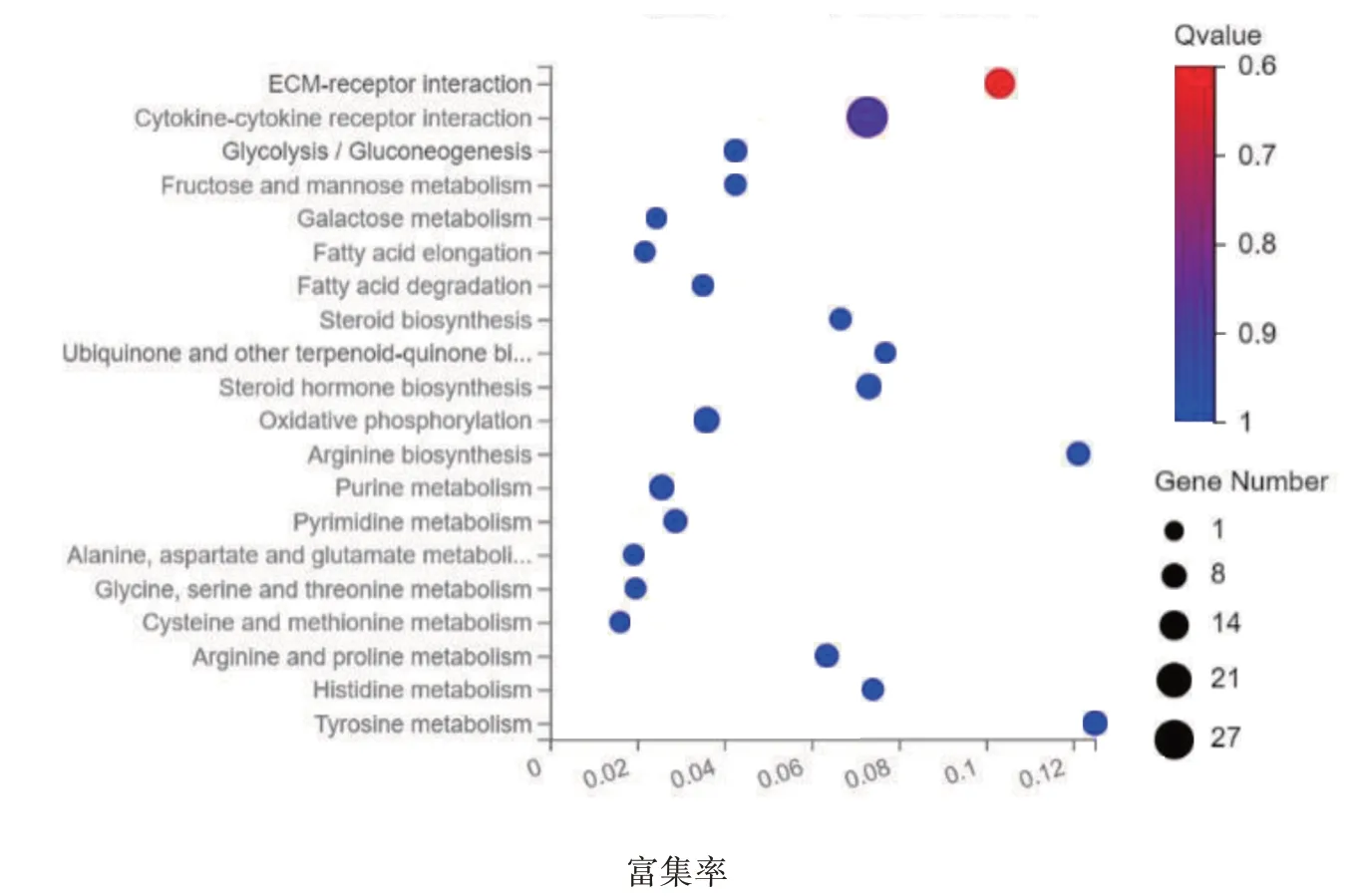
图5 KEGG富集分析气泡图
2.4 差异基因PPI互作网络分析
将两组样本DEGs 所编码的蛋白质利用String数据库进行PPI 网络互作,预测DEGs 间相互作用,选取PPI 网络中连通度排序前10 位为核心基因并排序。结果为FOS、GNG13、CXCR4、CCL2、OPRM1、PPBP、GAL、OPRK1、JUN、EGR1。对纤维性增生组而言,PPBP、OPRM1、GAL为上调,其余基因均为下调。这些关键基因的关系见图6。

图6 前列腺纤维性与结节性增生关键差异基因的联系
3 讨论
临床良性前列腺结节性增生非常常见,良性前列腺纤维性增生相对较少,本研究从两类患者的基因水平发现其不同,为其发生、发展的作用机制及治疗提供新思路。本研究共发现1 598 个差异表达基因,与结节性增生组织相比,纤维性增生组织中相对表达量上调基因1 063 个,相对表达量下调基因535 个。对这些基因进行GO 富集分析后发现,DGEs 主要富集在离子转运、细胞黏附、细胞外基质组生物学过程,和富集在近端启动子DNA 结合转录激活剂、RNA 聚合酶Ⅱ,信号受体结合等活性分子功能中。KEGG 富集通路分析发现,DEGs 主要富集在细胞外基质—受体相互作用、细胞因子与细胞因子受体相互作用等信号通路上。细胞外基质是由动物细胞合成,并分泌到胞外,分布在细胞表面和细胞之间,是多糖、蛋白质或蛋白聚糖等物质。这些物质不属于任何细胞,但可为细胞生存提供重要的结构支架和组织连接,并通过信号转导系统影响细胞的形态、增殖、分化、迁移、代谢和功能等[9]。
从PPI 互作网络分析可以发现,与纤维性前列腺增生相关的最主要3 个基因为PPBP、OPRM1、GAL。PPBP基因编码的蛋白质是血小板衍生的生长因子,属于趋化因子家族,是中性粒细胞的有效化学吸引剂和活化剂,该蛋白具有杀菌和抗真菌作用,是抗微生物的蛋白质[10-11]。GAL编码的蛋白质在泌尿生殖道广泛表达神经内分泌肽——甘丙肽及其相关肽,其已被证明具有抗真菌活性,并被认为是先天免疫系统的一部分[12-13]。本研究筛选出的PPBP和GAL基因,均可以表达抗菌活性物质,提示前列腺纤维性增生的发生、发展可能与微生物感染有关,至于微生物是细菌或真菌,还未明确。
OPRM1基因位于人类第6 号染色体6q24~q25位置上,长度96.31 kB,包括转录调控区、3 个内含子和4 个外显子。OPRM1通过神经活性配体-受体相关作用,调节雌激素信号通路来调节前列腺的增生[14-16],OPRM1和上述GAL基因对细胞的增殖为负调控,需要证实的是该负调控可能在前列腺纤维增生过程中的作用机制。
本研究筛选出了3 个与纤维性增生相关的核心差异表达基因,以及若干相关的富集生物位点和生物通路,为临床监测和治疗前列腺纤维性增生提供潜在的生物标志物及靶点。但是本研究病例数不够,可能存在一些偏倚,此外需要进一步完善分子生物学实验来确认这些基因的具体功能。
