常规MRI联合DWI在评估足月HIE严重程度中的应用观察
2021-12-21
王晶晶 许亚春 吴 平 邰兆琴 缪 慧 刘向东*
围产期新生儿比较常见的脑损伤之一为缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)。有调查显示,足月新生儿HIE发病率高达1%~2%,且15%~20%HIE患儿在新生儿期死亡,其中30%存活者出现神经发育障碍[1-2]。不同病情程度HIE患儿预后不同,轻度患儿初期具有正常发育可能性,且脑损伤能够完全恢复或者只出现轻度脑发育延迟,但是中重度患儿预后较为严重,尤其是重度患儿,一般会引起死亡或者造成永久性脑损伤,故临床评估HIE患儿病情程度具有重要意义。随着磁共振成像(magnetic resonance imaging,MRI)技术不断发展,其在足月HIE患儿病情评估中已经得到了广泛应用[3-4]。本研究以96例足月HIE新生儿及30例健康足月新生儿为研究对象,探讨MRI联合弥散加权成像(diffusion weighted imaging,DWI)在评估足月HIE严重程度中的应用价值。
1 资料与方法
1.1 一般资料选取2015年12月至2018年12月期间我院96例足月HIE新生儿,并取同期50例足月新生儿(均无窒息史,且无神经系统症状以及体征)纳入对照组,分为对照组1(日龄<7d)28例与对照组2(日龄7~28d)22例。96例足月HIE患儿中,日龄<7d 50例,日龄7~28d 46例,按照病情程度分别纳入轻度组1(n=16)、中度组1(n=20)与重度组1(n=14);轻度组2(n=15)、中度组2(n=18)与重度组2(n=13)。日龄<7d、日龄7~28d新生儿中,不同病变程度组与对照组性别、体重、日龄等一般资料比较无统计学意义(P>0.05)(表1)。
纳入标准:与HIE诊断标准[5]相符;新生儿家属签署研究知情同意书。排除标准:合并胆红素脑病、遗传性代谢病或者低血糖脑病;临床资料不完整者。
1.2 方法使用MR扫描仪(型号:德国西门子 1.5T),所有研究对象均进行T1加权成像(T1weighted image,T1WI)、T2加权成像(T2weighted image,T2WI)与DWI检查。其中T1WI:快速自旋回波(fast Spin-echo,FSE)序列,回波时间(echo time,TE)与重复时间(repetition time,TR)分别为8.0、360.0ms,视野与层间距分别为26cm×26cm、0mm,激励次数与矩阵分别为2、288×256。T2WI:选择FSE序列,TE与TR分别为90、2800ms,层间距与层厚分别为0、3mm,矩阵、视野及激励次数分别为256×224、26cm×26cm、2。DWI扫描:TE与TR分别为70、6000ms,层间距与层厚分别为0、3mm,矩阵、视野与激励次数为128×128、26cm×26cm、2,扩散敏感梯度具有三个方向,b 值设置为1000s/mm2,控制扫描时间24s。
表1 不同病变程度组与对照组一般资料比较(例,)

表1 不同病变程度组与对照组一般资料比较(例,)
完成扫描检查后,对研究对象MRI资料按照检测部位及信号改变进行分类统计,将检查信息传至ADW 4.1工作站,采取Functool 图像后处理软件对8个感兴趣区(region of interest,ROI)表观弥散系数(apparent diffusion coefficient,ADC)进行测量。
1.3 观察指标比较日龄<7d、日龄7~28d患儿中不同病情程度组与相应日龄对照组ROI (包括脑干、顶叶白质与额叶白质、放射冠、侧脑室旁白质、豆状核、内囊后肢以及丘脑腹外侧核)ADC。
1.4 统计学方法使用SPSS 19.0处理分析检测数据,计量资料以()表示,多组比较以F检验,组间比较以t检验;计数资料以(%)表示,采用χ2检验。P<0.05为比较有统计学意义。
2 结 果
2.1 日龄<7d患儿不同病情程度组与相应日龄对照组ADC比较由表2可知,对照组1、轻度组1、中度组1、重度组1脑干与豆状核ADC比较无明显差异(P>0.05);轻度组1、中度组1、重度组1顶叶白质与额叶白质ADC明显低于对照组1(P<0.05),三组间比较无显著差异(P>0.05);中度组1、重度组1放射冠ADC明显低于轻度组1、对照组1(P<0.05),中度组1与重度组1、轻度组1与对照组1组间比较无明显差异(P>0.05);重度组1侧脑室旁白质、内囊后肢ADC明显低于其他三组(P<0.05),中度组1内囊后肢ADC明显低于对照组1(P<0.05);重度组1丘脑腹外侧核ADC明显低于对照组1(P<0.05)。
表2 日龄<7d患儿不同病情程度组与相应日龄对照组ROI ADC比较()

表2 日龄<7d患儿不同病情程度组与相应日龄对照组ROI ADC比较()
注:*表示与对照组1比较,差异存在统计学差异(P<0.05);#表示与轻度组1比较,差异存在统计学差异(P<0.05);&表示与中度组1比较,差异存在统计学差异(P<0.05)。下同。
2.2 日龄7~28 d患儿中不同病情程度组与相应日龄对照组ADC比较由表3可知,对照组2、轻度组2、中度组2、重度组2脑干、顶叶白质、额叶白质、侧脑室旁白质、豆状核及丘脑腹外侧核ADC比较无明显差异(P>0.05);中度组2、重度组2放射冠ADC明显低于对照组2、轻度组2(P<0.05),中度组2与重度组2、对照组2与轻度组2比较无显著差异(P>0.05);中度组2、重度组2内囊后肢ADC明显低于对照组2(P<0.05),且重度组2明显低于轻度组2(P<0.05)。
表3 日龄7~28d患儿中不同病情程度组与相应日龄对照组ADC比较()

表3 日龄7~28d患儿中不同病情程度组与相应日龄对照组ADC比较()
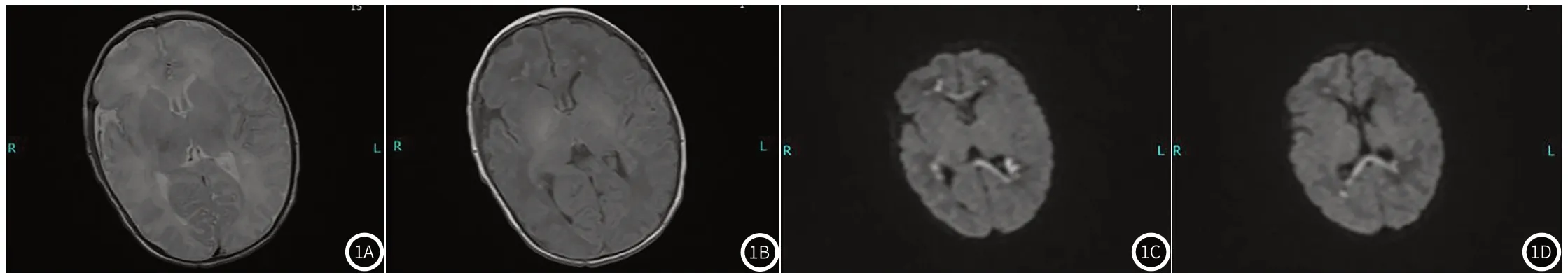
图1 典型病例影像图。T1WI示双侧脑室周围多发斑点状稍高信号(图1B);T2WI病灶在周围脑白质衬托下呈略低信号(图1A);DWI序列双侧脑室周围白质及胼胝体多发点状及条片状高信号(图1C-1D)。
2.3 典型病例图像图为足月HIE新生儿(6d)影像图。
3 讨 论
新生儿HIE的出现并非单一因素所致,其由各种复杂病理生理变化与生化变化引起,属于新生儿急救医学主要研究内容。HIE病变部位、病情严重程度和以下两方面因素密切相关:一是缺氧缺血情况持续时间;二是为脑内代谢物质水平具体变化情况[6-7]。而MRI技术对人体中枢神经系统产生的病变较为敏感,故在新生儿HIE临床诊断中已经得到了广泛应用,其中尤以DWI技术最重要。对于DWI弥散加权程度,主要取决于b值,b值代表序列里面施加梯度大小具体亮度值,随着b值的增加,对弥散探测也更敏感;组织间ADC决定了DWI图像的对比,有效反映了人体水分子在不同方向弥散平均值,其中水分子弥散较为明显者,则ADC更高。有报道指出,采取MRI方式检查新生儿HIE时,DWI的灵敏度最高,而ADC具有最高特异度[8]。
HIE早期,新生儿神经元以及纤维束细胞膜组织钠钾泵功能障碍,引起水分子弥散率以及弥散方向改变,诱发细胞毒性水肿,由于细胞膜与细胞器等会对细胞之中水分子弥散能力造成影响,粘滞度提升,同时细胞外间隙相应游离水减少导致缺血区域内ADC值减小,DWI上表现出明显高信号,其中ADC值的减小和细胞毒性水肿程度具有线性相关性[9-10]。由于脑白质以及灰质核团之内丘脑腹外侧含大量髓鞘,故人体脑髓鞘化程度能用于评估脑组织发育成熟状况。尽管该过程复杂,但呈现一定规律性,通常于妊娠20周开始产生髓鞘化现象,按照从下往上、从背侧至腹侧及从中心至外周顺序。中央白质较早呈现髓鞘化,因而内囊后肢ADC检测值最低。对于额顶叶深部白质而言,其较迟髓鞘化,因而ADC检测最大[11-12]。在新生儿日龄逐渐增大过程中,脑含水量越来越少,髓鞘化程度加大,随着神经元与胶质细胞不断生长,使得细胞外空间缩小,最终大脑各部位ADC检测值均有所减小,其中以额顶叶白质减小较为明显[13-14]。
本研究结果显示,轻度组1、中度组1、重度组1顶叶白质与额叶白质ADC明显低于对照组1,且三组间比较无显著差异;中度组1、重度组1放射冠ADC明显低于轻度组1、对照组1;重度组1侧脑室旁白质、内囊后肢ADC明显低于其他三组,中度组1内囊后肢ADC明显低于对照组1,且重度组1丘脑腹外侧核ADC明显低于对照组1,表明日龄<7d HIE患儿顶叶白质与额叶白质ADC相较于正常新生儿存在明显降低趋势,放射冠、内囊后肢ADC则能区别轻度患儿与中重度患儿,脑室旁白质、内囊后肢、丘脑腹外侧核ADC能用于区别重度患儿。本研究中,中度组2、重度组2放射冠ADC明显低于对照组2、轻度组2;中度组2、重度组2内囊后肢ADC明显低于对照组2,且重度组2明显低于轻度组2,与余旭东等[15]的研究结论相符。说明对于日龄7~28d HIE患儿而言,放射冠ADC能用于评估病情轻度患者与中重度患者,内囊后肢ADC能用于评估中重度患者。
综上,对足月HIE患儿采取常规MRI联合DWI检查方法,对其病情严重程度评估具有重要意义。但本研究存在样本数较少方面的局限,受样本个体因素影响较大,有待后续进一步深入研究。
