血管软化丸调控miR-17-5p与PCSK9/VLDLR信号通路抗动脉粥样硬化研究
2021-12-21孔艳芳秦合伟胡长春
孔艳芳,秦合伟,,王 媛,胡长春
(1.河南省中医院 河南中医药大学第二附属医院,河南 郑州 450002;2.河南中医药大学,河南 郑州 450002)
动脉粥样硬化(atherosclerosis,AS)是导致缺血性心脑血管疾病的主要病理基础,目前西医防治AS的临床效果不理想,而中医药防治AS取得了一定的成果,但具体作用机制不明确;新近研究发现微小RNA(microRNA,miR)参与了AS的发生、发展,其中miR-17-5p能够通过抑制血管平滑肌细胞(vascular smooth muscle cell,VSMC)极低密度脂蛋白受体(very low density lipoprotein receptor,VLDLR)的表达,影响前蛋白转化酶枯草溶菌素(proprotein convertase subtillisin/kexin type 9,PCSK9)的表达,进而负调控VLDLR表达,缓解血管内膜的增生,抑制血管管腔狭窄和平滑肌细胞的增殖迁移,抑制AS的形成。鉴于最新研究进展和本课题组前期研究基础,笔者推测中医药防治AS的作用机制可能与调控miR-17-5p,靶向调控VLDLR或靶向调控PCSK9有关。因此,本研究旨在观察血管软化丸抗AS的作用机制是否与靶向调控miR-17-5p,靶向调控VLDLR或靶向调控PCSK9间接调控VLDLR,抑制血管炎症反应,减轻VSMC有关。
1 材料
1.1 实验动物 健康雄性ApoE小鼠60只,SPF级,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。健康雄性C57BL/6小鼠15只,体质量(20±2)g,购自南京大学模式动物研究所,生产许可证号:SCXK(苏)2015-0001;SD大鼠60只,体质量(300±20)g,雄性,购自郑州市惠济区华兴实验动物养殖场,动物生产许可证号:SCXK(豫)2019-0002。所有动物饲养于河南中医药大学第二附属医院动物实验中心,实验动物使用许可证号:SYXK(豫)2016-0009,(22±1)℃恒温、60%~75%恒湿、12 h循环照明,自由摄食、饮水。人VSMC购自上海沪震生物科技有限公司。
1.2 伦理审查 经河南中医药大学第二附属医院动物实验伦理委员会审核通过,本实验设计方案符合安全性和公平性原则,实验动物符合国家对医学实验动物的有关要求。伦理审核批准标号:20190622。
1.3 实验药物 本研究所用血管软化丸(药物组成:山楂、神曲、珍珠、代赭石各30 g,莱菔子、茯苓、枸杞子各15 g,陈皮、连翘、郁金、三七各12 g、清半夏9 g)方中所有中药均来源于河南中医药大学第二附属医院药剂科;按照“人和动物体表面积折算的等效剂量比率表”换算低、高2个剂量分别为21.6、86.4 g/kg,分别相当于60 kg成人临床用量等效量的5.8、23.3倍,医院煎药房按照要求煎煮成生药含量为0.864、3.456 g/mL。
1.4 含药血清制备 SD大鼠高剂量组(20只)灌胃给予血管软化丸高剂量制备高剂量含药血清;SD大鼠低剂量组(20只)灌胃给予血管软化丸低剂量制备低剂量含药血清;每日早晚2次灌胃,连续灌胃5 d。空白血清对照组(20只)给予等量的生理盐水灌胃,每日2次;各组大鼠末次灌胃后1 h,给予腹腔注射水合氯醛(350 mg/kg)麻醉,腹主动脉取血,37 ℃静置1 h,3 000 r/min离心10 min,分离血清,放入离心管中,0.45 μm微孔滤膜过滤除菌,分装,-20 ℃保存备用。
2 方法
2.1 细胞实验
2.1.1 VSMC培养和分组 VSMC在含有15%(V/V
)热灭活胎牛血清的DMEM培养基(含有100 U/mL青霉素和100 mg/mL链霉素)中培养,以每孔1×10/mL的细胞数将细胞铺板于24孔板,37 ℃、5% CO的环境下培养,通过加入氧化低密度脂蛋白(oxidation low lipoprotein,Ox-LDL)20 μg/mL构建平滑肌细胞损伤模型。模型复制成功后分为4组:(1)模型组:VSMC+Ox-LDL+不含药正常血清;(2)miRNA-17-5p抑制剂组:VSMC+Ox-LDL+HiperFect转染试剂,将RNA-17-5p抑制剂转染VSMC;(3)含药血清高剂量组:VSMC+Ox-LDL+中药高剂量含药血清;(4)含药血清低剂量组:VSMC+Ox-LDL+中药低剂量含药血清。干预48 h后观察收集细胞总RNA和总蛋白进行相应指标检测。2.1.2 血清干预和细胞转染的具体方法
(1)血清干预:将第3~5代VSMC弃去培养基,用PBS温和洗3遍,在37 ℃、5% CO孵箱中培养16 h,观察到每孔内细胞铺板率达50%,弃掉孔内旧培养基,分别加入血管软化丸不同浓度(6.25、12.5和25 μg/mL)含药血清的RPMI1640培养基,最终选取25 μg/mL含药血清,进行含药血清干预。
(2)细胞转染:在无菌条件下,用含有10% FBS的细胞培养基DMEM,将VSMC(1×10/mL)接种于6孔板,每孔含有2 mL培养基;37 ℃温度下在5% CO细胞培养箱中孵育备用;取miR-17-5p抑制剂,以0.6 μL(20 mol/L)和HiPerFect转染试剂12 μL滴加入300 μL的不含FBS和抗生素的DMEM细胞培养基,混合为浓度5 μmol/L在室温条件下放置5~10 min形成转染复合物,将转染复合物均匀滴入上述接种VSMC培养基中,孵育直至血管内皮细胞融合度约80%时终止培养,刮取细胞,以提取血管内皮细胞的RNA。经qRT-PCR检测,细胞转染成功率为70%。
2.1.3 四甲基偶氮唑盐(methyl thiazolyltetrazolium,MTT)法检测细胞活性 收集各组细胞并调整密度为每孔2×10个细胞,接种于96孔板中,每组设5个复孔,培养24 h后加入MTT 20 μL(浓度为5 mg/mL),培养箱孵育4 h后取出,弃上清,加入二甲基亚砜150 mL,摇床震荡10 min后,于490 nm波长测定吸光度(A
)值。2.1.4 检测细胞miR-17-5p、VLDLR和PCSK9 mRNA表达水平 采用RT-PCR法:收集血清处理48 h后的细胞,提取总RNA,逆转录,采用SYBR Green进行qRT-PCR反应;反应参数:95 ℃ 30 s,1个循环;95 ℃ 5 s,55 ℃ 10 s,40个循环,样本中目的基因的计算方法为2-ΔΔ。GAPDH为内参。引物序列:miR-17-5p正向引物5′-CCAGCCAAAGTGCTTACAGTGC-3′,反向引物5′-GTGCAGGGTCCGAGGTATTC-3′;VLDLR正向引物5′-CCCGTTCTACTCAGTGTATCCC-3′,反向引物5′-CTGCCATCGTCACAGTCATCC-3′;PCSK9正向引物5′-GCGTCGTGGTGATTGGATTG-3′,反向引物5′-CAGGGGTGTTGTGGATGCT-3′;GAPDH正向引物5′-AGTGTGACGATTAATCGCAAG-3′,反向引物5′-ATCCACATCTC TCGTTGTGGC-3′。
2.1.5 Western blot法检测细胞VLDLR和PCSK9蛋白表达水平 收集处理48 h后的细胞,提取蛋白,采用BCA蛋白定量法,蛋白电泳,分离,转膜,室温下5%脱脂奶粉封闭2 h,用相应的一抗(VLDLR和PCSK9),分别按照1∶200和1∶500孵育,4 ℃过夜,洗涤后标记二抗(滴度1∶200)杂交。采用化学发光试剂盒检测,使用Image Lab 4.1图像分析软件检测VLDLR和PCSK9印迹条带净吸光度值,以β-actin内参照,结果以样本灰度值/内参照灰度值表示。
2.2 体内实验
2.2.1 模型复制与给药 C57BL/6小鼠给予全程普通饲料喂养,作为正常对照组;ApoE小鼠给予全程高脂饲料(含脂肪21%、胆固醇0.15%)喂养,分为4组,每组15只;饲养8周模型复制成功(每组随机抽取1只小鼠主动脉壁可见明显的斑块形成)后开始干预。每日灌胃1次,连续干预8周后取材进行检测。①对照组:C57BL/6小鼠给予等量生理盐水灌胃;②模型组:ApoE小鼠给予等量生理盐水灌胃;③miR-17-5p 抑制剂组:ApoE小鼠尾静脉注射miR-17-5p抑制剂处理;④血管软化丸高剂量组:ApoE小鼠采用血管软化丸灌胃量为86.4 g/(kg·d);⑤血管软化丸低剂量组:ApoE小鼠采用血管软化丸灌胃量为21.6 g/(kg·d)。
2.2.2 样品采集和病理形态学观察 经药物干预8周后取材,禁食12 h后摘眼球取血,用于血清指标检测;取胸腹全长主动脉,一部分主动脉固定于4%甲醛溶液中,用于HE染色;一部分置于-80 ℃冻存用于主动脉相关指标检测。
2.2.3 ELISA法测定外周血清中白细胞介素-6 (interleukin- 6,IL-6)、白细胞介素-10 (interleukin-10,IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子水平 采用ELISA法检测血清中IL-6、IL-10、TNF-α水平,按ELISA试剂盒说明书进行。
2.2.4 RT-PCR检测各组主动脉miR-17-5p、VLDLR和PCSK9 mRNA表达水平 将主动脉称量后,加入适量的Trizol,提取总RNA。具体方法见“2.1.4”项。
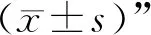
3 结果
3.1 一般情况 动物模型鉴定时每组各处死1只,除去撕咬致死5只,灌胃致死6只,剔除各组离群值,各组进入统计数量均为10只。
3.2 各组VSMC存活率比较 与模型组比较,miR-17-5p抑制剂组,血管软化丸高、低剂量含药血清组VSMC存活率均明显升高(P
<0.
05)。见图1。
注: A.模型组;B.miR-17-5p抑制剂组;C.血管软化丸高剂量组;D.血管软化丸低剂量组;与模型组比较,*P<0.05;与miR-17-5p抑制剂组比较,#P<0.05
3.3 VSMC中miR-17-5p、VLDLR、PCSK9 mRNA表达水平比较 与模型组比较,miR-17-5p抑制剂组,血管软化丸高、低剂量含药血清组VSMC中miR-17-5p和VLDLR mRNA表达水平均明显升高(P
<0.
05),PCSK9 mRNA表达水平明显降低(P
<0.
05);血管软化丸高、低剂量含药血清组miR-17-5p、VLDLR、PCSK9 mRNA表达水平比较,差异无统计学意义(P
>0.
05)。见表1。
表1 各组VSMC中miR-17-5p、VLDLR、PCSK9 mRNA表达水平比较
3.4 各组VSMC内VLDLR、PCSK9蛋白表达水平比较 与模型组比较,miR-17-5p抑制剂组,血管软化丸高、低剂量组VSMC中VLDLR蛋白表达水平均明显降低(P
<0.
05),VSMC中PCSK9蛋白表达水平均明显升高(P
<0.
05);血管软化丸高、低剂量组各项指标比较,差异均无统计学意义(P
>0.
05)。见表2和图2。
表2 各组VSMC中VLDLR、PCSK9蛋白表达水平比较
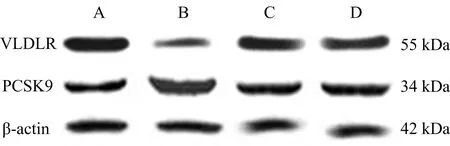
注:A.模型组;B.miR-17-5p抑制剂组;C.血管软化丸高剂量组;D.血管软化丸低剂量组
VLDLR和
PCSK9蛋白表达水平
3.5 主动脉病理形态观察 光学显微镜下观察发现,模型组小鼠主动脉管径厚薄不均匀,内膜不光滑,管腔内可见明显AS斑块形成,斑块内可见浅染无定形物和钙化颗粒物,部分AS斑块截面积大于主动脉截面积。miR-17-5p抑制剂组和血管软化丸高、低剂量组AS病变程度明显较模型组减轻。见图3。

图3 各组小鼠主动脉病理形态(HE染色,10×20倍)
3.6 各组小鼠血清IL-6、IL-10、TNF-α水平比较 与对照组比较,模型组小鼠血清IL-6和TNF-α水平明显升高(P
<0.
05),IL-10水平明显降低(P
<0.
05);与模型组比较,miR-17-5p抑制剂组和血管软化丸高、低剂量组血清IL-6和TNF-α水平明显降低(P
<0.
05),IL-10水平明显升高(P
<0.
05)。血管软化丸高、低剂量组各项指标比较,差异均无统计学意义(P
>0.
05)。见表3。
表3 各组小鼠外周血IL-6、IL-10、TNF-α水平比较
3.7 各组主动脉miR-17-5p、VLDLR、PCSK9 mRNA表达水平比较 与模型组比较,miR-17-5p抑制剂组,血管软化丸高、低剂量组主动脉miR-17-5p、VLDLR mRNA表达水平均明显降低(P
<0.
05),主动脉PCSK9 mRNA表达水平明显升高(P
<0.
05);血管软化丸高、低剂量组miR-17-5p、VLDLR、PCSK9 mRNA表达水平比较,差异均无统计学意义(P
>0.
05)。见表4。
表4 各组主动脉miR-17-5p、VLDLR、PCSK9 mRNA表达水平比较
4 讨论
miRNA在AS的发生发展过程中发挥了重要的作用,人为调控miRNA的表达也是疾病防治的一个重要方法,其中miRNA-17-5p的表达水平与AS严重程度密切相关。有研究发现,低密度脂蛋白受体(low-density lipoprotein,recptor,LDLR)能够通过结合并内吞低密度脂蛋白(low-density lipoprotein,LDL) 调节胆固醇代谢,在LDLR数量降低时将导致血浆中LDL和胆固醇水平升高;VLDLR主要分布在心肌、骨骼肌以及脂肪组织中,能够通过与含有载脂蛋白E的脂蛋白结合,调节脂质代谢;巨噬细胞膜上VLDLR通过摄取富含三酰甘油的脂蛋白,促进三酰甘油在细胞中的沉积,导致和加重AS。此外,在粥样斑块存在情况下,研究者通过高表达VLDLR,结合低脂饮食,能够降低血浆中VLDL及LDL水平,促进AS斑块消退。
研究发现,PCSK9能够影响VLDLR的表达,增强肝脏中VLDLR的溶酶体和内涵体降解,导致血清低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)水平升高;研究者通过转染PCSK9进入VSMC,发现提高PCSK9表达能够降低VLDLR蛋白水平。新近研究发现,AS发病与miR-17-5p表达成正相关,与VLDLR表达成负相关;miR-17-5p能够靶向VLDLR,直接抑制VSMC中VLDLR的表达,MiR-17-5p通过影响PCSK9参与负调控VLDLR表达,抑制AS的发生发展。
高脂血症和AS可归属于中医“血浊”和“脉痹”范畴,痰、瘀等病理产物壅塞脉道,沉积脉壁,痰瘀蓄留不去而成“脉痹”,即AS和血栓形成。本课题组针对AS“痰阻血瘀”的基本病机,采用由保和丸加减化裁而成的血管软化丸治疗AS。该方中山楂消饮食积滞、活血化瘀为君药;神曲消食健胃,莱菔子理气消食,半夏、茯苓燥湿健脾、化痰散结,郁金、三七行气解郁、活血化瘀,枸杞子滋补肝肾、益精明目,珍珠和代赭石平肝潜阳、降逆祛痰,共为臣药;陈皮理气和中为佐药;甘草调和诸药。诸药合用,共奏消积化痰、活血化瘀之功。本课题组既往研究发现,血管软化丸防治AS与调控PI3K/Akt/mTOR通路、TLR3/TLR9、miR-155、CD40-CD40L系统、miR-467b等miR及其下游信号有关。
鉴于miR-17-5p能够靶向调控VLDLR或靶向调控PCSK9间接调控VLDLR,抑制血管炎症反应,减轻VSMC损伤,防治AS,本研究旨在验证血管软化丸抗AS的作用机制是否与靶向调控miR-17-5p,靶向调控VLDLR或靶向调控PCSK9间接调控VLDLR,抑制血管炎症反应,减轻VSMC损伤有关,进而揭示血管软化丸防治AS的分子机制,这是本研究的思路创新。
本研究结果显示,经过血清干预后,与模型组比较,miR-17-5p抑制剂组和两个中药含药血清组VSMC活性均明显升高,VSMC中miR-17-5p、VLDLR mRNA表达水平均明显降低,VSMC中PCSK9 mRNA和蛋白表达水平均明显升高;与模型组比较,miR-17-5p抑制剂组和两个中药含药血清组细胞VLDLR蛋白表达水平均明显降低。这表明VSMC活性与miR-17-5p和VLDLR mRNA表达水平呈负相关,与PCSK9 mRNA表达水平呈正相关,血管软化丸对Ox-LDL构建平滑肌细胞损伤模型的VLDLR和PCSK9表达有明显调控作用,这可能与调控miR-17-5p表达有关。
体内实验结果也显示,经过干预后,与模型组比较,miR-17-5p抑制剂组和血管软化丸高、低剂量组外周血清中IL-6和TNF-α水平明显降低,IL-10水平明显升高,miR-17-5p抑制剂组和血管软化丸高、低剂量组主动脉miR-17-5p和VLDLR mRNA表达水平均明显降低,PCSK9 mRNA表达水平明显升高;血管软化丸不同剂量组之间各项指标比较差异无统计学意义,不存在量效关系。病理学检测也证实,血管软化丸和miR-17-5p抑制剂均能防治AS。
综上所述,血管软化丸防治AS的作用机制可能与靶向调控miR-17-5p,靶向调控VLDLR或靶向调控PCSK9间接调控VLDLR,抑制血管炎症反应,减轻VSMC损伤有关。
