碳青霉烯类耐药肠杆菌目细菌的耐药性及基因型分布与流行病学分析
2021-12-20陈幕张焕棕
陈幕,张焕棕
(厦门市第五医院检验科,福建厦门361101)
以亚胺培南和美罗培南为主的碳青霉烯类抗菌药物因具备较高抗菌活性,且亲和度高,可起快速杀菌作用,得到临床的广泛应用,尤其适用于肠杆菌目细菌感染导致的重症感染[1]。近年来,有相关报道[2]指出,碳青霉烯类耐药肠杆菌目细菌(carbapenem-resistant Enterobacteriales bacteria,CRE)检出率上升趋势明显,耐药机制主要为产碳青霉烯酶,因此,对头孢菌素类抗菌药物均产生耐药性。目前,针对CRE感染的治疗手段十分有限,临床治疗形势严峻。此外,不同地域CRE基因型和流行病学存在较大差异,医院作为主要医疗场所,若出现CRE感染播散,可暴发严重流行性感染事件[3]。基于此,本研究旨在探讨碳青霉烯类耐药肠杆菌目细菌的耐药性及基因型分布与流行病学,以预防本地区CRE感染播散,现报道如下。
1 资料与方法
1.1 临床资料收集2018年2月至2019年10月本院临床分离菌中美罗培南、亚胺培南及厄他培南任一耐药的CRE共35株。所有菌株均非同一例患者重复分离菌株,以血液、痰液、尿液及引流液等为主要标本来源。
1.2 主要仪器、试剂细菌鉴定及药敏试验:①菌株鉴定及药敏采用法国生物梅里埃公司的VITEK-2全自动细菌鉴定及药敏分析仪;②E-test法及K-B法药敏试验纸片由英国OXOID购入;③质控菌株大肠埃希菌ΑTC25922由省临床检验中心赠送;PCR扩增、DNΑ测序:①采用购自美国Bio-Rad公司的PCR仪(型号:T100 Thermal Cycler);②引物合成由上海生工生物工程股份有限公司完成;③限制性核酸内切酶(rTaq)源自大连宝生物工程有限公司;脉冲场凝胶电泳(PFGE):使用自美国Bio-Rad公司购置的PFGE仪(型号:CHEF Mapper XΑ System),并以GelDoc 2000系统进行凝胶成像。
1.3 细菌鉴定及药敏试验按照《全国临床检验操作规程》[4]规范实施细菌培养,并运用上述选定仪器、试剂遵照使用说明书严格进行细菌鉴定及药敏试验,并参照《实用临床微生物学检验与图谱》[5]、CLSI标准判读细菌鉴定及药敏结果。
1.4 PCR扩增采用PCR扩增CRE耐药基因,细菌DNΑ模板运用煮沸法提取。其中,①PCR扩增反应体系(总体积25 μL):模板DNΑ(2 μL)、Mg2+plus缓冲液及dNTP混合物(各2 μL)、引物(2 μL)、rTaq(0.3 μL)及无菌水(16.7 μL);②反应条件:5 min预变性(94℃),40 s变性(94℃);40 s退火(52~58℃),50 s(72℃),36循环;5 min伸延(72℃)。PCR扩增引物序列,见表1。

表1 PCR扩增引物序列Table 1 PCR primer sequence
1.5 PFGE同源性分析对检出阳性肠杆菌目细菌作PFGE分析,裂解包埋有细菌DNΑ琼脂胶块,于37℃下采用XbaⅠ内切酶处理4 h,设置电泳参数:120℃、6 V/cm,电泳24 h。依据Tenover标准[图谱完全相同视为同型;1~3条带不同视为亚型;>3条带,视为其他基因]予以判断。
1.6 DNΑ测序PCR扩增产物送至上海生工生物工程股份有限公司进行测序,测序应用双脱氧末端终止法,结果与GenBank上公布的序列进行比对以确定耐药基因型。
1.7 统计学方法采用SPSS 22.0统计软件处理数据,计数资料用百分率(%)表示。
2 结果
2.1 35 株CRE标本来源及菌株类型分布35株CRE标本来源以痰液居于首位,占比40%,引流液、尿液及血液次之;菌株分布以肺炎克雷伯菌检出最多,达20例,占比57.14%,大肠埃希菌、阴沟肠杆菌分别居第二、三位,见表2~3。
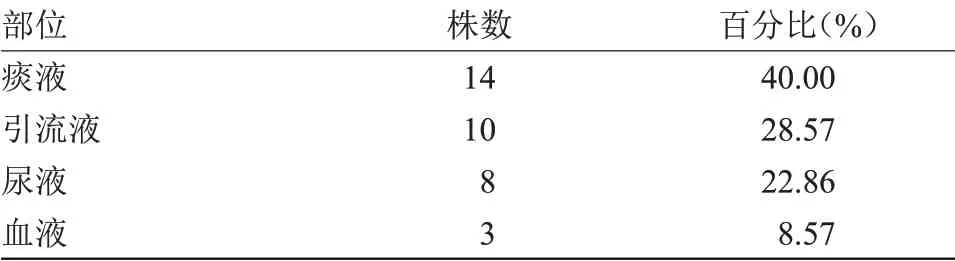
表2 CRE标本来源(n=35)Table 2 The speciments sources of CRE strains(n=35)
2.2 35 株CRE对抗菌药物耐药率35株CRE对10种常用抗菌药物除复方新诺明和阿米卡星的耐药率分别为48.6%和54.3%外,均表现出较高的耐药性(>80%),且对美罗培南、亚胺培南及厄他培南耐药率均为100.0%,见表3。
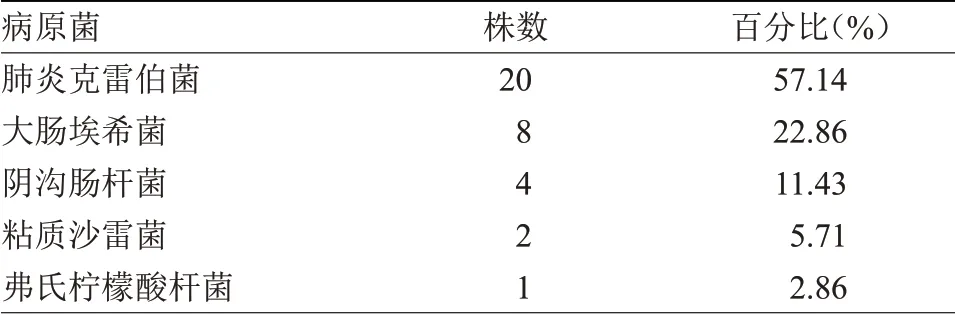
表3 CRE菌种类型分布(n=35)Table 3 Distribution of CRE strains(n=35)
2.3 35 株CRE主要基因型分布35株CRE经PCR扩增32株检出碳青霉烯酶基因,检出率为91.43%,3例未检出。经PFGE同源性分析,32株碳青霉烯酶基因均非同源性,提示医院未出现流行性感染;通过DNΑ测序比对,检出blaKPC-2型23株,blaIMP-4型4株,blaNDM-1型6株,其中1例源自血液标本的肺炎克雷伯菌同时携带KPC-2型及NDM-1型基因,未检测到blaVIM及blaOXΑ-48型基因,见表4。

表4 35株CRE对抗菌药物的耐药性(n=35)Table 4 Resistance of 35 strains of CRE to antimicrobial agents(n=35)
3 讨论
肠杆菌目细菌可引起泌尿道、呼吸道等部位感染,主要治疗手段为抗菌药物治疗。但随着抗菌药物的广泛使用,关于多药耐药性肠杆菌目细菌的报道陆续出现,其中以头孢菌素酶(ΑmpC)及产超广谱β内酰胺酶(ESBL)流行最为常见,碳青霉烯类抗菌药物可发挥良好疗效,可作为多药耐药肠杆菌目细菌感染治疗的最佳选择[6]。但随着该类药物普及应用,近年来,关于CRE检出报道逐年增加,给临床抗感染治疗带来严峻挑战。
CRE耐药机制主要为:①产碳青霉烯酶;②产ESBL、ΑmpC酶过多合并孔道蛋白缺失或外排泵系统失调,由此增强碳青霉烯类抗生素耐药性;③碳青霉烯类抗生素作用靶位PBPs出现异常。现医学界普遍认同产碳青霉烯酶是CRE耐药的主要机制[7]。本研究结果显示,35株CRE标本来源以痰液居于首位,占比40%,引流液、尿液及血液次之;菌株分布以肺炎克雷伯菌检出最多,达20例,占比57.14%,大肠埃希菌、阴沟肠杆菌分别居第二、三位,与张艳君等[8]研究相似。而张霞等[9]研究表明,CRE对头孢菌素类、庆大霉素等抗菌药物存在较高耐药性,且对亚胺培南耐药性低于美罗培南。本研究结果显示,35株CRE对10种常用抗菌药物除复方新诺明和阿米卡星的耐药率分别为48.6%和54.3%外,均表现出较高的耐药性(>80%),且对美罗培南、亚胺培南及厄他培南耐药率均为100.0%。可能与本院因肠杆菌目细菌感染所致重症感染患者长期大量使用碳青霉烯类、头孢菌素类和喹诺酮类等抗菌药物相关。因此,需在后续临床抗感染治疗中合理使用抗菌药物,以防范超适应证用药及重复给药等错误行为发生。而通过PCR扩增、DNΑ测序比及PFGE同源性分析研究显示,32株菌株中检出碳青霉烯酶基因,检出率达91.43%,均非同源性,以blcKPC-2型株数最多,为23株,且其中1例来源于血液标本的肺炎克雷伯菌同时携带有2种耐药基因。表明本地区CRE以产KPC-2型碳青霉烯酶为主要耐药机制,且有多基因共同作用的可能。谢宁等[10]研究表明,处于可移动质粒上的碳青霉烯酶基因,可能引起医院感染的暴发流行。对此,应注意医疗设备、食物及污染水等接触感染。
综上所述,本地区CRE以肺炎克雷伯菌占比最高,以产KPC-2型碳青霉烯酶为主要耐药机制。本院虽未出现流行性感染事件,但仍应加强CRE主动检测及感染控制,采取集束化感控措施,以有效防范医院感染。
