乳腺癌细胞与巨噬细胞融合对PI3K/AKT和MAPK/ERK信号通路的影响
2021-12-20张丽娜张迪迪顾宇轩孙霄麟
张丽娜, 张迪迪, 赵 雷, 顾宇轩, 孙霄麟
(北京工业大学 环境与生命学部 生命科学与化学学院,北京 100124)
乳腺癌是一种对全球妇女健康威胁最大的肿瘤,尤其在我国女性乳腺癌的发病率和死亡率呈显著增长趋势。目前认为乳腺癌的浸润和转移是导致乳腺癌患者死亡的主要原因,但关于乳腺癌转移的分子机制仍然不太清楚。上皮-间质转化(epithelial-mesenchymal transition,EMT)被认为是肿瘤转移的首要步骤[1]。近年来,细胞融合理论逐渐成为肿瘤转移的研究热点之一[2]。间充质干细胞和巨噬细胞是目前细胞融合研究经常选用的两种细胞类型,也被作为探索肿瘤生物治疗的靶向载体。多数研究已证实间充质干细胞可与肿瘤细胞融合,参与肿瘤的发生转移[3-7]。一些研究也表明巨噬细胞能同肿瘤细胞发生融合,促进肿瘤的发生转移[8-10]。因此,细胞融合被认为是肿瘤转移的一种新机制[11-12]。但目前关于细胞融合与肿瘤转移之间的关系及对其关键的分子调控机制仍不太清楚,这也阻碍了细胞融合在肿瘤临床治疗中的应用。
研究表明多条信号通路参与调控EMT过程[13],其中与肿瘤细胞增殖转移密切相关的PI3K/AKT和MAPK/ERK信号通路也参与EMT调控,这两条信号通路的异常活化与多种癌症的发生发展密切相关[14]。我们前期已经成功建立了小鼠乳腺癌细胞与巨噬细胞融合模型,结果表明融合细胞的恶性增殖和迁移侵袭能力明显增强,融合细胞获得了肿瘤细胞无限增殖和巨噬细胞易于迁移的特性,而且可能是通过激活Wnt/β-catenin信号通路诱导EMT促进乳腺癌增殖转移[9]。先前研究发现来源于乳腺上皮细胞和乳腺癌细胞融合形成的杂交细胞表现出不同的RAF-AKT信号通路之间的交叉对话[15],巨噬细胞与乳腺癌细胞融合是否也会影响PI3K/AKT和MAPK/ERK信号通路介导EMT促进乳腺癌增殖转移并不清楚。
为解决上述问题,本研究结合前期建立的融合细胞模型和所取得的实验结果,重点探索乳腺癌细胞与巨噬细胞融合对肿瘤增殖转移密切相关的PI3K/AKT和MAPK/ERK信号通路的影响,揭示乳腺癌细胞与巨噬细胞融合是否可以通过这两条信号通路介导EMT从而促进乳腺癌增殖转移,以期为阐明细胞融合在肿瘤转移中的分子机制提供新的视角和思路,也为干预细胞融合在肿瘤转移治疗中的应用提供理论基础。
1 材料和方法
1.1 材料
采用自建的小鼠乳腺癌细胞-巨噬细胞融合模型(N2O2-RAW264.7),融合细胞的具体构建方法详见本课题组前期发表论文[9]。其中小鼠乳腺癌细胞N2O2来自Dr. Joseph Lustgarten (Sidney Kimmel Cancer Center, San Diego, CA)实验室馈赠。
DMEM培养基、胎牛血清(fetal bovine serum, FBS)、PBS、100×青霉素-链霉素双抗和0.25% Trypsin-EDTA均为美国Hyclone公司产品;RIPA细胞裂解液、CCK-8细胞增殖检测试剂盒、BCA蛋白定量试剂盒、4×SDS蛋白上样缓冲液、PMSF、脱脂奶粉、4%多聚甲醛和SDS-PAGE凝胶配制试剂均购自北京鼎国昌盛生物技术有限责任公司;PVDF膜、ECL化学发光底物、Transwell穿透小室(24孔)为美国Millipore公司产品;Matrigel胶购自美国BD公司;结晶紫和DMSO购自美国Amresco公司;LY294002和PD98059抑制剂、β-actin、PI3K、p-PI3K(Tyr458)、AKT、p-AKT(Ser473)、ERK1/2和p-ERK1/2(Thr202/Tyr204)一抗均购自美国CST公司;HRP标记的山羊抗兔和抗鼠IgG二抗是美国ABGENT公司产品。其他化学试剂均为国产试剂。
1.2 方法
1.2.1 细胞培养
乳腺癌细胞和融合细胞置于含10%FBS和1×青霉素-链霉素双抗的DMEM培养基培养,待细胞生长至90%密度,用0.25% Trypsin-EDTA消化传代,放置于5% CO2、37 ℃培养箱培养。取状态良好的对数生长期细胞实验。LY294002和PD98059信号通路阻断剂用DMSO溶解,分别采用10 μmol/L终浓度处理细胞。
1.2.2 Western Blot实验
用0.25%胰酶消化细胞,加入RIPA裂解液,冰上裂解30 min,12 000 r/min于4 ℃离心30 min,取上清液转至1.5 mL EP管,用BCA蛋白定量试剂盒测定总蛋白浓度。然后加入4×SDS上样缓冲液,沸水浴煮10 min变性蛋白。配制10%聚丙烯酰胺凝胶,每孔上样40 μg总蛋白,100 V恒压电泳2 h,90 V恒压转膜1 h,5%脱脂牛奶室温封闭2 h。然后分别加入PI3K、p-PI3K、AKT、p-AKT、ERK1/2、p-ERK1/2(1∶1 000稀释)和β-actin(1∶5 000稀释),4℃孵育过夜。第2天回收一抗,TBST洗膜3次,然后加入HRP标记二抗(1∶6 000稀释),室温孵育1 h,TBST洗膜3次。最后加入ECL化学发光底物,利用Tanon 4200化学发光成像系统扫描图像。β-actin作为内参,每个Western Blot结果至少重复3次,选择代表性结果展示。
1.2.3 CCK-8细胞增殖实验
0.25%胰酶消化细胞并计数,96孔板每孔接种1×103个细胞,每组设4个复孔。分别培养24、48、72、96和120 h后,每孔更换100 μL新鲜培养基(同时设置只加培养基的空白对照),然后每孔加10 μL CCK-8溶液,37 ℃培养箱避光孵育1 h,用Bio-Tek酶标仪测定450 nm处吸光度。以培养时间为横坐标,450 nm处吸光度(OD450实验组-OD450空白对照)为纵坐标,绘制连续5 d的生长曲线。
1.2.4 细胞划痕实验
0.25%胰酶消化细胞接种至12孔板,待细胞贴壁汇合至80%密度时,用200 μL黄枪头在孔中央划一道横线,PBS清洗去掉脱落的细胞,更换为含5% FBS的DMEM培养基。分别在0、12和24 h通过倒置显微镜拍照记录细胞划痕变化,并计算细胞相对迁移率。
1.2.5 Transwell细胞迁移和侵袭实验
0.25%胰酶消化细胞并计数,迁移实验时,将细胞重悬于无血清DMEM培养基,以每孔5×104个细胞密度接种于24孔Transwell穿透小室。侵袭实验是预先在24孔Transwell小室铺Matrigel胶,每孔接种5×105个细胞。然后在24孔板加入含20%FBS的DMEM培养基,37 ℃孵育24 h后,用棉签刮掉小室内细胞,4%多聚甲醛固定,0.5%结晶紫染色,最后通过Olympus IX71倒置显微镜观察拍照。随机选取5个视野统计穿透膜的细胞数量。
1.3 统计学分析
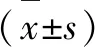
2 结果与分析
2.1 乳腺癌细胞与巨噬细胞融合对PI3K/AKT和MAPK/ERK信号通路的影响
为了确定乳腺癌细胞与巨噬细胞融合对PI3K/AKT和MAPK/ERK信号通路的影响,首先通过Western Blot实验检测这两条信号通路中关键标志蛋白的表达变化。结果表明,与对照组乳腺癌细胞相比,融合细胞中磷酸化的p-PI3K、p-AKT和p-ERK1/2表达水平显著升高,而非磷酸化的总PI3K、AKT和ERK1/2蛋白的表达则没有明显变化(图1)。该结果说明乳腺癌细胞与巨噬细胞融合可能会激活PI3K/AKT和MAPK/ERK信号通路,从而促进乳腺癌增殖转移。

图1 乳腺癌细胞与巨噬细胞融合对增殖转移相关的PI3K/AKT和MAPK/ERK信号通路关键蛋白的影响Figure 1 Effects of fusion between breast cancer cells and macrophages on the key proteins of PI3K/AKT and MAPK/ERK signaling pathways related to proliferation and metastasis
2.2 抑制剂阻断融合细胞中PI3K/AKT和MAPK/ERK通路效果检测
检测LY294002和PD98059特异性抑制剂处理对融合细胞中PI3K/AKT和MAPK/ERK信号通路的阻断效果。Western Blot实验结果表明,LY294002和PD98059抑制剂处理导致融合细胞中磷酸化的p-AKT和p-ERK1/2表达水平显著降低,而未磷酸化的AKT和ERK1/2表达则没有明显变化(图2)。该结果也进一步说明融合细胞中的PI3K/AKT和MAPK/ERK信号通路是处于被激活的状态。

图2 LY294002和PD98059抑制剂处理对融合细胞中PI3K/AKT和MAPK/ERK信号通路的影响Figure 2 Effects of LY294002 and PD98059 inhibitor treatment on PI3K/AKT and MAPK/ERK signaling pathways in the fused cells,respectively
2.3 抑制剂对融合细胞增殖的影响
通过CCK-8实验分析LY294002和PD98059抑制剂阻断PI3K/AKT和MAPK/ERK信号通路后细胞的增殖能力变化。从图3(a)和(b)中可以看出,对照乳腺癌N2O2细胞组在450 nm处的吸光值明显低于融合细胞组,说明融合细胞的增殖能力显著强于对照乳腺癌细胞,LY294002和PD98059抑制剂处理导致对照乳腺癌细胞和融合细胞的增殖能力均受到抑制,尤其对融合细胞的抑制效果更明显。

(a)对照乳腺癌细胞CCK-8实验结果;(b)融合细胞CCK-8实验结果。* P<0.05; ** P<0.01。图3 CCK-8实验分析抑制PI3K/AKT和MAPK/ERK信号通路对细胞增殖能力的影响Figure 3 Effects of inhibition of PI3K/AKT and MAPK/ERK signaling pathways on the cell proliferation ability by CCK-8 assay
2.4 抑制剂对融合细胞迁移能力的影响
通过划痕损伤实验分析LY294002和PD98059抑制剂处理后融合细胞的迁移能力变化。结果表明与未经抑制剂处理组相比,LY294002和PD98059抑制剂处理12 h和24 h组融合细胞的划痕明显愈合较慢,划痕也较宽一些[图4(a)]。通过定量分析发现LY294002和PD98059抑制剂处理组细胞的相对迁移率明显低于未处理对照组,抑制剂处理导致融合细胞的迁移显著受阻[图4(b)]。
此外,进一步通过Transwell实验分析LY294002和PD98059抑制剂处理后融合细胞的迁移能力变化,发现阻断PI3K/AKT和MAPK/ERK信号通路后,融合细胞的迁移能力显著被抑制[图5(a)和(b)]。
2.5 抑制剂对融合细胞侵袭能力的影响
通过Transwell侵袭实验分析LY294002和PD98059抑制剂处理后融合细胞的侵袭能力变化。结果如图6(a)和(b)所示,LY294002和PD98059抑制剂处理阻断PI3K/AKT和MAPK/ERK信号通路后,融合细胞的侵袭能力也明显被抑制。
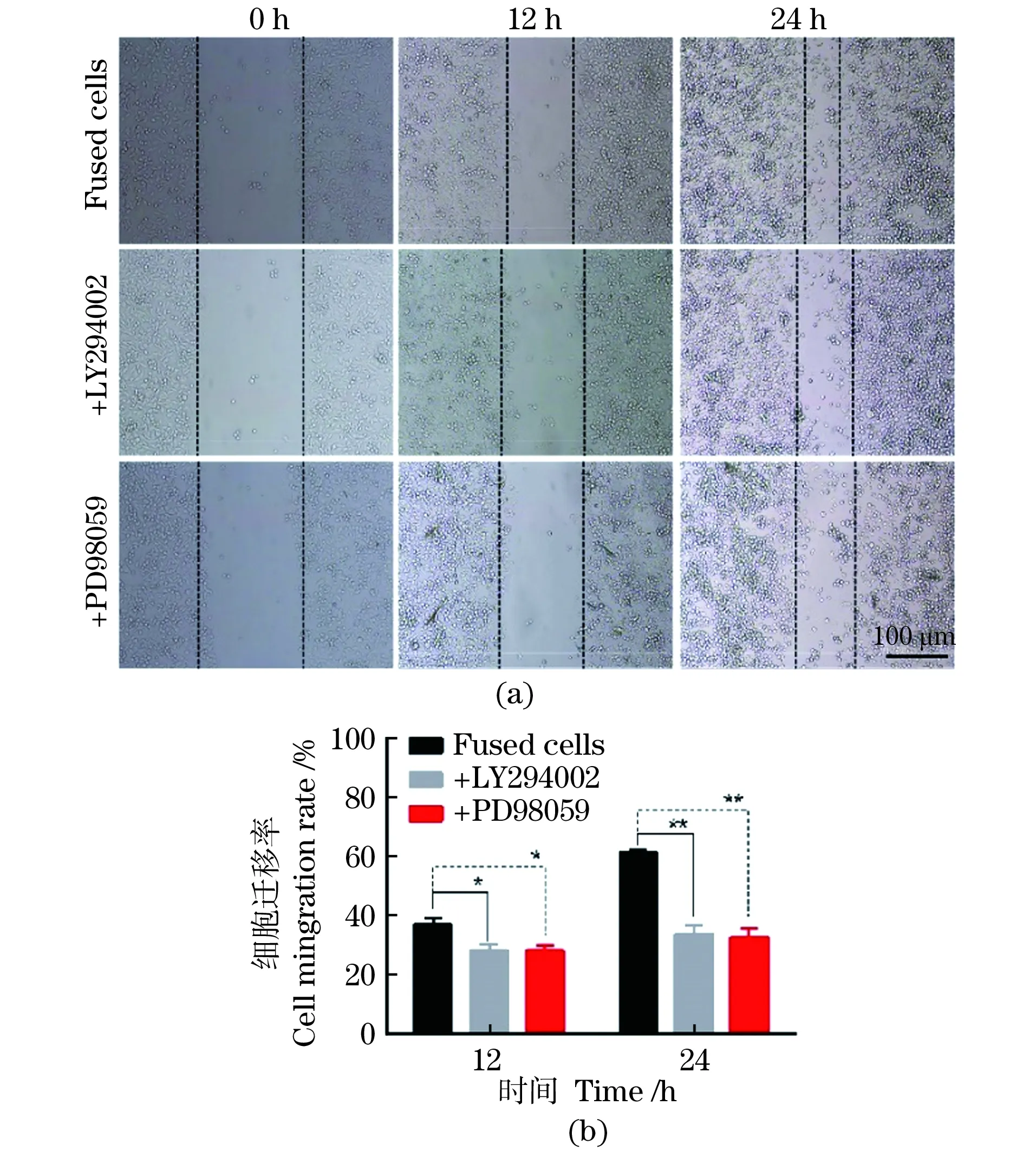
(a)细胞划痕损伤实验结果(标尺:100 μm);(b)细胞迁移能力的相对定量统计分析。* P<0.05; ** P<0.01。图4 划痕损伤实验分析抑制PI3K/AKT和MAPK/ERK信号通路对融合细胞迁移能力的影响Figure 4 Effects of inhibition PI3K/AKT and MAPK/ERK signaling pathways on the migration ability of the fused cells by wound healing assay

(a)Transwell迁移实验结果(×200);(b)Transwell迁移实验结果的定量统计分析(随机选取5个视野统计分析)。** P<0.01。图5 Transwell实验分析抑制PI3K/AKT和MAPK/ERK信号通路对融合细胞迁移能力的影响Figure 5 Effects of inhibition PI3K/AKT and MAPK/ERK signaling pathways on the migration ability of the fused cells by Transwell migration assay

(a)Transwell侵袭实验结果(×200);(b)Transwell侵袭实验结果的定量统计分析(随机选取5个视野统计分析)。* P<0.05; ** P<0.01。图6 Transwell实验分析抑制PI3K/AKT和MAPK/ERK信号通路对融合细胞侵袭能力的影响Figure 6 Effects of inhibition PI3K/AKT and MAPK/ERK signaling pathways on the migration ability of the fused cells by Transwell invasion assay
3 讨论与结论
细胞融合是肿瘤发生发展过程中的一种常见现象,研究表明肿瘤细胞同其他正常细胞形成的融合细胞往往表现出比亲代肿瘤细胞更恶性的特征,包括形成异倍体,增殖转移能力增强,获得耐药性及干细胞样特性等[2,16-19]。肿瘤细胞融合理论目前也被认为是肿瘤转移的一种新机制[11-12,20]。通过对肿瘤细胞与间充质干细胞融合研究发现,不同的肿瘤细胞与间充质干细胞融合对肿瘤的生长转移存在一定争议。多数研究认为间充质干细胞融合促进肿瘤生长转移[4,16,21];还有一些研究认为间充质干细胞融合抑制肿瘤生长转移[22-23]。巨噬细胞作为肿瘤微环境中重要的免疫细胞,也是细胞融合研究经常选用的细胞类型。我们前期通过建立小鼠乳腺癌细胞与巨噬细胞融合模型研究发现融合细胞的恶性增殖和迁移侵袭能力明显增强,巨噬细胞融合会促进乳腺癌增殖转移[9]。
研究表明肿瘤细胞与间充质干细胞融合是通过诱导EMT促进肿瘤转移[24-25]。我们前期研究发现乳腺癌细胞与巨噬细胞融合也会诱发EMT促进乳腺癌增殖转移[9]。经典的TGF-β、Wnt/β-catenin、Notch等信号通路均被证实参与EMT调控[13]。此外,与增殖转移密切相关的PI3K/AKT和MAPK/ERK信号通路也与EMT调控相关[26-27]。EMT相关信号通路的异常活化则促进肿瘤发生转移。已有研究表明细胞融合可通过不同的信号通路调控肿瘤发生转移。Ozel等[15]发现乳腺上皮细胞和乳腺癌细胞融合形成的杂交细胞表现出RAF-AKT信号通路的交叉对话。Fu等[28]发现巨噬细胞可通过分泌IL-8激活JAK2/STAT3/Snail信号通路,从而诱导肝癌细胞发生EMT促进肝癌转移。我们前期结果表明乳腺癌细胞与巨噬细胞融合是通过激活Wnt/β-catenin信号通路诱发EMT促进乳腺癌增殖转移[9]。
本研究重点分析乳腺癌细胞与巨噬细胞融合对增殖转移密切相关的PI3K/AKT和MAPK/ERK信号通路的影响。结果表明:与对照乳腺癌细胞相比,融合细胞中这两条通路的标志蛋白即磷酸化的p-PI3K、p-AKT和p-ERK1/2表达水平显著升高,而总PI3K、AKT和ERK1/2表达没有变化;LY294002和PD98059抑制剂阻断PI3K/AKT和MAPK/ERK信号通路后,融合细胞中p-AKT和p-ERK1/2表达明显降低,而且融合细胞的增殖、迁移和侵袭能力均显著被抑制。结果初步表明乳腺癌细胞与巨噬细胞融合可能通过激活PI3K/AKT和MAPK/ERK信号通路诱导EMT从而促进乳腺癌增殖转移。
在本研究基础上,再结合前期研究结果,进一步提示乳腺癌细胞与巨噬细胞融合可能会通过激活多条EMT相关的信号通路诱导EMT从而促进乳腺癌增殖转移。由此推断,调控细胞融合与肿瘤转移的信号通路是复杂多样的,细胞融合可能会导致多条EMT相关信号通路的改变协同调控肿瘤的发生转移。因此,关于细胞融合、信号通路调控与肿瘤发生转移之间的具体作用机制仍有待深入研究。
