扎龙湿地10个不同居群芦苇的ITS序列分析
2021-12-20杨晓杰付学鹏
杨 卓,杨晓杰,付学鹏
(1.齐齐哈尔市药品检验中心,黑龙江 齐齐哈尔 1610001;2.齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006)
芦苇属(Phragmites)植物是禾本科多年生草本植物,是湿地广泛分布的重要物种。芦苇湿地在抵御洪水、调节径流、防风固沙、净化水质及维持物种多样性等方面具有很高的生态价值[1-2]。在世界范围内芦苇有10个种,中国有3个种,即卡开苇[P.karka(Retz.) Trin. ex Steud](大芦)、日本苇(P.japonicaSteud.)和普通芦苇[P.australis(Cav.) Trin. ex Steud.][3],普通芦苇适应性广,在淡水、轻盐性、碱性的湿地及干旱沙丘中均有分布。在长期的演化过程中,芦苇为了适应不同的生境,变异成不同的生态型,且不同生态型芦苇在形态、生理等方面的特征均表现出较大的差异。黑龙江省地处我国东北部,湿地芦苇资源主要分布在松嫩平原、兴凯湖平原、三江平原等低湿积水地带[4]。大面积的芦苇湿地现主要分布在扎龙自然保护区、三江自然保护区、洪河自然保护区、七星河自然保护区、兴凯湖自然保护区等地。
对芦苇的研究较多,如芦苇对水、盐及重金属的响应[5-9]、芦苇群落退化[10]及UV-B辐射对芦苇的影响[5-8]等。笔者在扎龙湿地自然保护区前期的考察研究中发现,同一生境中存在两种不同表型芦苇,其中一种是常见的普通芦苇(P.australis),另一种茎秆的分节处颜色为棕红色,区别于普通芦苇的绿色,当地人称之为“铁秆芦苇”,这两种不同表型芦苇在形态、经济价值等方面的差异较大。前人对芦苇的生态型及形态变异的研究多为分布在不同生境中的芦苇[7,9],为探明普通芦苇和“铁秆芦苇”两型芦苇的分子基础差异,本试验对分布在扎龙湿地10个不同居群两型芦苇的ITS序列差异进行分析,拟阐明普通芦苇与铁秆芦苇的ITS序列差异,为挖掘扎龙湿地优异的芦苇资源及探讨芦苇的种内关系提供依据。
1 材料和方法
1.1 取 材
在扎龙湿地自然保护区选择10个不同居群的芦苇,其中居群4、8为铁秆芦苇,其余居群为普通芦苇。在2016年5月,取芦苇幼嫩的茎尖部分,置于冰袋盒中,带回实验室用液氮处理后放置在-80 ℃冰箱中保存,用于DNA的提取。
1.2 实验方法
1.2.1DNA提取
用DNA试剂盒(上海生工SK 8224)常规方法提取芦苇茎尖DNA。
1.2.2PCR引物设计
根据NCBI查找普通芦苇的ITS序列AF 019810作为芦苇ITS序列的PCR扩增引物。引物序列为ITS 4:5′-TCCTCCGCTTATTGATATGC-3′、TTS 5:5′-GGAAGTAAAAGTCGTAACAAGG-3′。
1.2.3PCR扩增反应
PCR反应体系:1 μL DNA模板,正反向引物各0.5 μL,0.5 μL dNTP,0.2 μLTaq酶,2.5 μLTaqBuffer,19.8 μL水。扩增程序:95 ℃ 3 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共计35个循环;72 ℃延伸10 min。纯化后的PCR产物送至上海生工生物工程公司进行测序。
1.2.4序列分析
将测得的序列用DNASTAR和MEGA软件构建进化树及遗传距离的计算。
2 结果与分析
2.1 PCR 扩增结果
扎龙湿地10个不同居群芦苇PCR扩增电泳结果见图1。

图1 扎龙湿地10个不同居群芦苇的PCR电泳图Fig.1 PCR electrophoretic of 10 different populations of P. australis in Zhalong wetland
2.2 ITS序列碱基含量
扎龙湿地10个不同居群芦苇ITS序列碱基含量见表1,图2。

表1 扎龙湿地10个不同居群芦苇ITS序列长度及G+C含量Table 1 ITS sequence length and G+C content in 10 populations of P. australis in Zhalong wetland
由图2可知,A碱基含量在1、2、3、5、6、7、9、10居群中相近,在17.0%~17.8%之间,富含A/T;在居群4和居群8中A碱基含量为12.3%,A/T含量较少;显示铁秆芦苇与普通芦苇的碱基含量具有明显差异。10个不同居群芦苇中,ITS序列长度在648~685 bp之间,存在一定的保守性,不同居群间存在一定的差异,见表1。

图2 扎龙湿地10个不同居群芦苇ITS序列碱基含量Fig.2 Base contents of ITS sequences in 10 populations of P. australis in Zhalong wetland
芦苇10个不同居群中,G+C含量最高的是居群5,为71.1%;最低的为居群10,为69.2%。两型芦苇的G+C含量范围在69.2%~71.1%之间,其中铁秆芦苇与普通芦苇间的G+C含量差异不大。
2.3 ITS序列遗传距离及变异位点分析
扎龙湿地10个不同群居芦苇ITS序列遗传距离见表2。
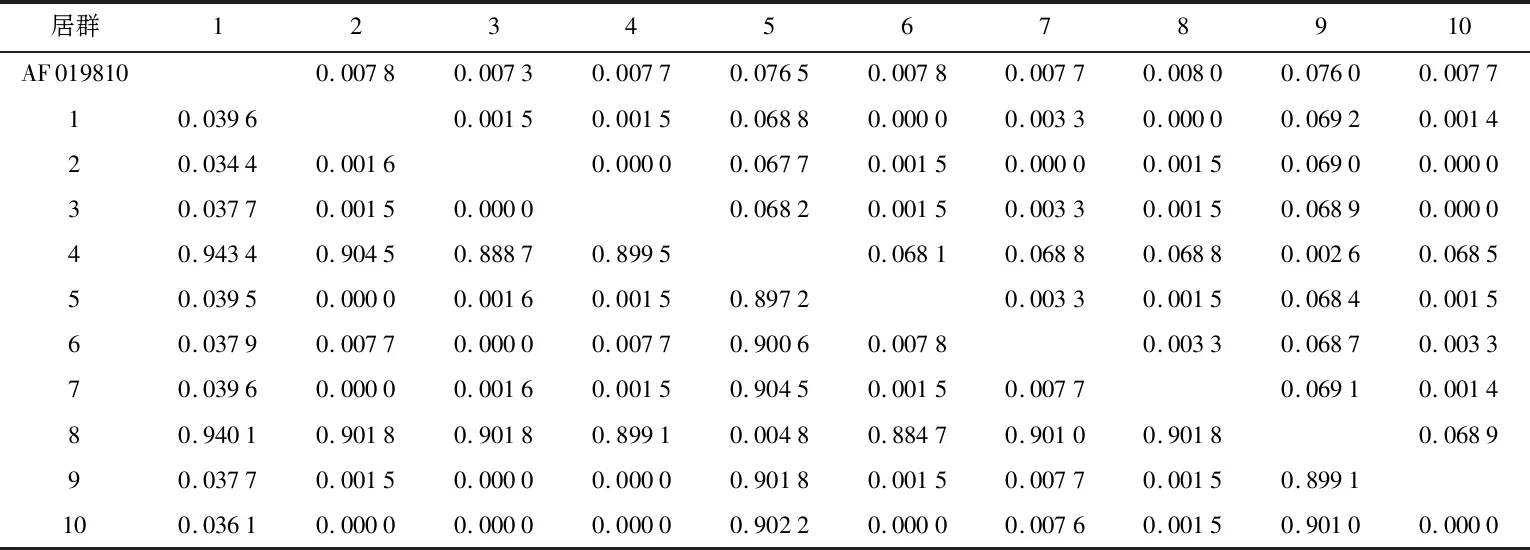
表2 扎龙湿地10个不同居群芦苇ITS序列遗传距离Table 2 Genetic distances of ITS sequences in 10 populations of P. australis in Zhalong wetland
10个不同居群芦苇的平均遗传距离为0.302 6,两型芦苇遗传距离0.905 7~0.909 0。普通芦苇与铁秆芦苇之间遗传距离较远,同型芦苇之间遗传距离差异不明显。
扎龙湿地10个不同群居芦苇ITS序列位点差异见表3。
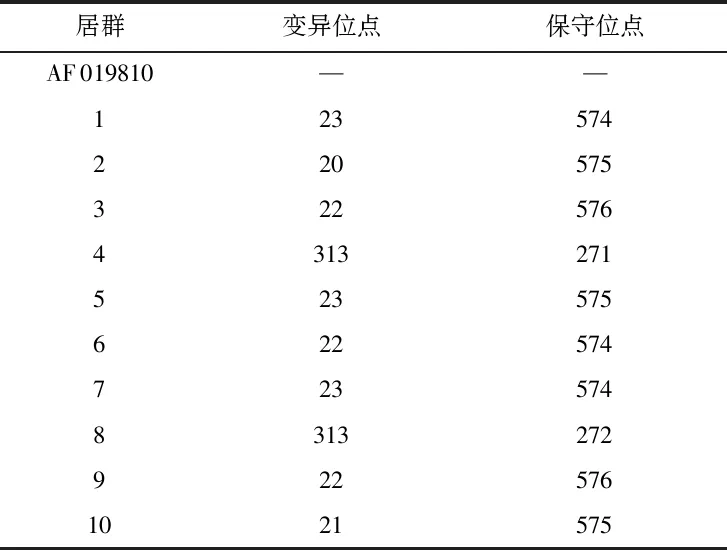
表3 扎龙湿地10个不同居群芦苇ITS序列位点差异Table 3 Differences of ITS sequence loci among 10 populations of P. australis in Zhalong wetland
通过MEGA软件内变异位点的分析,比对序列全长704 bp,铁秆芦苇居群较普通芦苇居群存在287~290个变异位点,所研究居群普通芦苇只存在3个变异位点,序列较为保守;铁秆芦苇与普通芦苇相比变异较大。
2.4 发育系统树构建
扎龙湿地10个不同群居芦苇系统发育树构建见图3、图4。

图3 基于ITS序列构建的系统发育MP树Table 3 Phylogenetic MP tree based on ITS sequence

图4 基于ITS序列构建的系统发育NJ树Table 4 Phylogenetic NJ tree based on ITS sequence
由图3、图4可知,10个不同居群的芦苇ITS序列构建的MP树和NJ树结果一致,居群 4与居群8属于同一支,属铁秆芦苇,居群1、2、3、5、6、7、9、10属于同一支,属普通芦苇。
3 结论与讨论
ITS序列是5.8~28 s rDNA的一段介于600~800 bp之间的序列,这段序列承受压力很小,同时包含保守和变异位点,在属内相近的种甚至种内都可以鉴别出差别,并且植物、真菌等的亲缘关系、分类鉴定等方面得到了广泛的应用[10-15]。
本实验结果表明,铁秆芦苇较普通芦苇碱基含量差异较大,两型芦苇的G+C含量范围在69.2%~71.1%之间,都属于较高水平,表明所测定的芦苇DNA密度高且遗传信息稳定。通过变异位点的分析,比对序列全长704 bp,铁秆芦苇居群存在287~290个变异位点,普通芦苇居群只存在3个变异位点,序列较为保守;通过发育系统树的构建之后分析其亲缘关系,可以看出居群4与居群8同属铁秆芦苇同一支,居群 1、2、3、5、6、7、9、10同属普通芦苇,所构建的MP树和NJ树结果一致。Lele等[16]研究证明,表观遗传变异与遗传变异的相互关联有关,由序列分析及系统树的构建可见两种不同表现型的芦苇其遗传信息有所差别且遗传距离较远,证明芦苇居群在相似的生境下既保持着遗传信息的相对稳定性,又通过发生基因的变异而演化出了新的生态型。目前尚未有学者对铁秆芦苇进行过相关研究,综上分析可知,铁秆芦苇与普通芦苇存在较大遗传差异,结合之前测定形态结构及生理生化指标的差异分析,发现铁秆芦苇在纤维特性上更优于普通芦苇,可以作为优质的造纸资源加以利用,对于改良芦苇种质资源结构,提高芦苇对环境的适应性更为有利。
