不同处理对喜马拉雅紫茉莉种子萌发和幼苗生长的影响
2021-12-20兰小中
袁 芳,王 靖,兰小中
(1.西藏农牧学院食品科学学院,西藏 林芝 860000;2.西藏农牧学院食品科学学院西藏特色农牧资源协同创新中心,西藏 林芝 860000)
藏药“五根”之一的喜马拉雅紫茉莉(Mirabilishimalaica(Edgew.) Heimerl)是西藏Ⅰ级濒危藏药材之一,藏文音译“巴朱”[1]。《中国植物志》将其归入紫茉莉科(Nyctaginaceae)山紫茉莉属(Oxybaphus),新拟名为山紫茉莉(O.himalaicusEdgew.)和变种中华山紫茉莉(O.himalaicusEdgew. var.chinensis),主产于西藏东部及喜马拉雅山区[2]。以根入药,具有温肾益肾、滋补生肌、利尿排石等功效,可消炎、止痛,是二十五味儿茶丸、红花如意丸、十四味羚牛角丸和热巴罗布膏等30余种藏药成方制剂的主要原料之一[3-4]。从该种植物中分离得到的黄酮类化合物、生物碱类化合物、三萜类化合物以及多糖类化合物,具有抗病毒、抗癌、降血糖等活性[5-8]。
喜马拉雅紫茉莉人工驯化与栽培处于初始阶段,种植规模不大,规范化种植技术尚不完善,采挖野生药材的现象仍然存在[9]。随着藏药工业化生产速度加快、市场开拓力度加强,对喜马拉雅紫茉莉药理作用及其药用范围的不断深化拓展,对其原料药的需求量越来越大。目前,喜马拉雅紫茉莉野生资源已经处于匮乏状态。开展藏药材野生驯化及人工种植是保护藏药材野生资源并解决市场资源紧缺问题的有效途径。
喜马拉雅紫茉莉以种子繁殖为主[10-11],研究其种子萌发特性,最大程度地提高种子的发芽率对实现其人工规模化种植至关重要,但是目前有关此方面的研究鲜有报道。兰小中等[10]研究表明,喜马拉雅紫茉莉的种子采收后在室温下贮藏1~4年皆可萌发,但随着贮藏年限的延长,种子会出现褪变现象,黑暗有利于种子萌发。卢骁等[11]研究表明,喜马拉雅紫茉莉的成熟种子有分泌粘液的特性,有粘液种子的发芽率比去掉粘液种子的发芽率高8.3%左右。虽然国内学者开展了一些喜马拉雅紫茉莉种子质量及萌发特性的研究,但仍不足以阐明喜马拉雅紫茉莉种子的萌发特性。
因此,本研究以喜马拉雅紫茉莉的种子为试验材料,探讨不同消毒方法、浸种时间以及植物生长调节剂处理对喜马拉雅紫茉莉种子萌发和幼苗生长的影响,旨在为这一珍贵药用植物资源的保护和栽培提供理论依据。
1 材料和方法
1.1 供试材料
喜马拉雅紫茉莉种子于2019年9月采自西藏林芝市西藏农牧学院藏药材种质资源圃。种子自然干燥后在通风、干燥、避光的室内存储。于2020年5月开展实验。种子千粒重为14.457 g。
1.2 试验方法
1.2.1种子消毒与浸种时间处理
将种子用流水冲洗5 min后转入超净工作台,分别进行如下处理: 1) 只用无菌水冲洗种子5次后接种到无菌萌发纸上,将该处理作为对照。 2) 用75%乙醇消毒1 min,无菌水冲洗3次,然后用0.1% HgCl2消毒2 min,无菌水冲洗3次。 3) 用75%乙醇消毒1 min,无菌水冲洗3次,然后用3% H2O2消毒3 min,无菌水冲洗3次。种子经各种方法消毒后,分别用无菌水经不同时间的浸种,然后接种于无菌萌发纸上。浸种时间设置为不浸种、浸种12 h、24 h、36 h、48 h、60 h和72 h共7个处理。以上消毒和浸种时间各处理均设3次重复,每个重复1个培养皿。
1.2.2植物生长调节剂处理
根据1.2.1的试验结果,种子用最适消毒方法消毒后用无菌水浸泡适当时间,然后滤去多余的水分,用不同种类和浓度的植物生长调节剂浸种5 min。根据预试验结果,选用6-苄氨基腺嘌呤(6-BA)、萘乙酸(NAA)、吲哚-3-乙酸(IAA)、吲哚丁酸(IBA)、2,4-二氯苯氧乙酸(2,4-D)和赤霉素(GA3)6种植物生长调节剂,浓度分别设置为6-BA(2、4、6、8、10 mg·L-1),NAA(2、4、6、8、10 mg·L-1),IAA(2、 4、6、8、10 mg·L-1),IBA(2、4、6、8、10 mg·L-1),2,4-D(2、4、6、8、10 mg·L-1),GA3(20、50、100、150、200、250、300、400 mg·L-1)。每个处理设3次重复,每个重复1个培养皿。
上述试验采用培养皿纸床发芽法,将两层PhytoTC种子萌发纸铺在培养皿中高温高压灭菌后烘干备用。所用试剂均用无菌水配制,植物生长调节剂母液抽滤灭菌。将培养皿内的萌发纸用4 mL无菌水(消毒与浸种时间处理)或植物生长调节剂溶液(植物生长调节剂处理)浸湿,种子均匀接种在萌发纸上,并用Parafilm封口膜进行封口。在培养箱中于20 ℃、全黑暗环境下培养。每14 d向各处理培养皿中加入4 mL无菌水。
1.2.3测定指标与计算公式
从处理当天开始,每24 h记录各培养皿中萌发的种子数,胚根露出种孔3 mm视为种子萌发。连续7 d对照组和试验组的种子萌发数不变时视为种子萌发进程结束,并测定幼苗的根长、茎长、鲜重和干重。
发芽启动时间,即萌发时滞,指从萌发试验开始到第1粒种子开始萌发所持续的天数;发芽持续时间,即种子开始萌发到最后1粒种子萌发的总天数;
带菌率(%)=(污染种子数/供试种子总数)×100%;
发芽率(%)=(种子发芽总数/供试种子总数)×100%;
发芽势(%)=(发芽初期(前4 d)正常发芽种子数/供试种子总数)×100%;
发芽指数=∑(Gt/Dt),
式中:Gt为t日内的发芽数,Dt为相应的发芽日数;
活力指数=S×GI,
式中:S为幼苗平均鲜质量,GI为发芽指数[12-13]。
1.2.4数据处理
采用Excel 2010软件进行整理和作图,SPSS 19.0软件进行差异显著性分析(p<0.05)。
2 结果与分析
2.1 不同消毒方法与浸种时间处理对喜马拉雅紫茉莉种子萌发的影响
由表1可知,所试的21种处理下,只有10种处理的种子有少数萌发。从污染情况来看,75%乙醇1 min+0.1% HgCl22 min的消毒效果最好,75%乙醇1 min+3% H2O23 min次之,只用无菌水冲洗5次的种子污染较严重,但带菌率均低于27%;另外,各消毒方法处理下的种子随着浸种时间的延长带菌率呈升高趋势。从种子的萌发情况来看,只用无菌水冲洗5次的种子总体发芽情况较好,75%乙醇1 min+3% H2O23 min次之,75%乙醇1 min+0.1% HgCl22 min处理下的种子发芽率最低,并且各消毒处理下的种子随着浸种时间的延长,发芽率显著下降。将种子用无菌水冲洗5次后,不经过浸泡直接接种到无菌萌发纸上进行培养,虽然种子带菌率为3.74%,但是种子的发芽率最高,为30.64%。
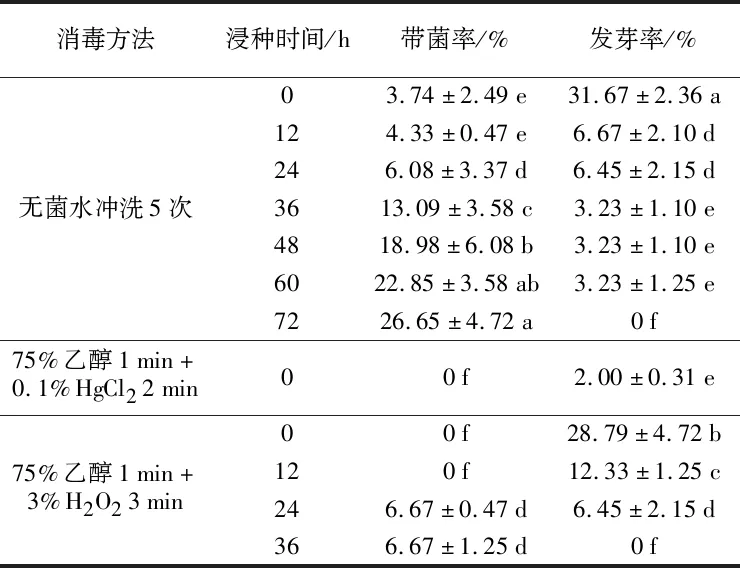
表1 不同消毒方法与浸种时间处理对喜马拉雅紫茉莉种子萌发的影响Table 1 Effects of different disinfection treatments and seed-soaking time on seed germination of M. himalaica
2.2 不同浓度植物生长调节剂对喜马拉雅紫茉莉种子萌发的影响
2.2.1不同浓度IBA对喜马拉雅紫茉莉种子萌发的影响
由表2可知,IBA 2~10 mg·L-1时对种子萌发有一定的抑制作用。与对照相比较,种子发芽启动时间和发芽持续时间呈延长趋势,发芽率、发芽势和发芽指数均呈下降趋势,活力指数则高于对照。综上可知,IBA不利于种子萌发,但是可以促进幼苗生长增加鲜重。

表2 不同浓度IBA对喜马拉雅紫茉莉种子萌发的影响Table 2 Effects of different concentrations of IBA on seed germination of M. himalaica
2.2.2不同浓度6-BA对喜马拉雅紫茉莉种子萌发的影响
由表3可知,6-BA 2~10 mg·L-1时均可适当缩短发芽启动时间;在发芽持续时间方面,2 mg·L-1处理与对照无显著差异,4 mg·L-1、6 mg·L-1、8 mg·L-1和10 mg·L-1处理比对照延长。2~10 mg·L-1处理下,发芽率、发芽势、发芽指数和活力指数均显著高于对照;其中10 mg·L-1处理下,发芽率、发芽势、发芽指数和活力指数最高,比对照分别提高33.03%、31.36%、10.24和1.21。综上可知,在试验设定的不同浓度6-BA处理中,浓度为10 mg·L-1浸种效果最好。

表3 不同浓度6-BA对喜马拉雅紫茉莉种子萌发的影响Table 3 Effects of different concentrations of 6-BA on seed germination of M. himalaica
2.2.3不同浓度2,4-D对喜马拉雅紫茉莉种子萌发的影响
由表4可知,2,4-D 2~10 mg·L-1时对种子萌发表现为一定的抑制作用。发芽启动时间比对照显著延长;发芽率、发芽势和发芽指数也显著低于对照;从活力指数显示,2,4-D 2~4 mg·L-1可以促进幼苗生长,6~10 mg·L-1则显著抑制幼苗生长。

表4 不同浓度2,4-D对喜马拉雅紫茉莉种子萌发的影响Table 4 Effects of different concentrations of 2,4-D on seed germination of M. himalaica
2.2.4不同浓度IAA对喜马拉雅紫茉莉种子萌发的影响
由表5可知,IAA 2、6、8、10 mg·L-1处理的种子发芽率、发芽势和发芽指数低于对照,4 mg·L-1处理的种子发芽率、发芽指数和活力指数最高,比对照分别提高2.29%、2.98和0.86,发芽启动时间比对照提前1.33 d,发芽持续时间则比对照延长4.67 d。综上可知,IAA 4 mg·L-1对种子萌发和幼苗生长有一定的促进作用。

表5 不同浓度IAA对喜马拉雅紫茉莉种子萌发的影响Table 5 Effects of different concentrations of IAA on seed germination of M. himalaica
2.2.5不同浓度NAA对喜马拉雅紫茉莉种子萌发的影响
由表6可知,NAA不同浓度处理对种子萌发表现为一定的抑制作用,发芽率、发芽势和发芽指数均显著低于对照;当NAA浓度大于4 mg·L-1时,不利于幼苗的生长。

表6 不同浓度NAA对喜马拉雅紫茉莉种子萌发的影响Table 6 Effects of different concentrations of NAA on seed germination of M. himalaica
2.2.6不同浓度GA3对喜马拉雅紫茉莉种子萌发的影响
由表7可知,不同浓度的GA3处理对种子萌发表现为一定的促进作用,并且对延迟发芽持续时间也有一定的作用。在各处理下,种子的发芽率、发芽势、发芽指数和活力指数均明显高于对照;其中,在300 mg·L-1处理下,发芽率、发芽势和活力指数最高,比对照分别提高22.49%、22.49%和1.16,发芽指数也比对照提高8.22。综上可知,在试验设定的不同浓度GA3处理中,浓度为300 mg·L-1浸种效果最好。

表7 不同浓度GA3对喜马拉雅紫茉莉种子萌发的影响Table 7 Effects of different concentrations of GA3 on seed germination of M. himalaica
2.2.76-BA、IAA和GA3最优处理的比较分析
对2.2.1~2.2.6所试的不同种类和浓度的植物生长调节剂处理进行综合比较分析,结果发现,IBA、2,4-D和NAA在浓度为2~10 mg·L-1时,对喜马拉雅紫茉莉种子的萌发均表现出一定的抑制作用,主要表现为种子发芽率、发芽势和发芽指数均低于对照。IAA对种子萌发也有一定的抑制作用,但在浓度为4 mg·L-1时,种子发芽率、发芽指数和活力指数则高于对照。试验设定的6-BA和GA3各浓度处理均可促进喜马拉雅紫茉莉种子的萌发。
对6-BA、IAA和GA3的最优浓度处理进行比较分析。由图1可知,用6-BA 10 mg·L-1和GA3300 mg·L-1处理的种子各项发芽指标均显著高于对照;IAA 4 mg·L-1处理的种子除了发芽势低于对照外,其余指标均高于对照,但差异不明显;3种最优浓度处理中,6-BA 10 mg·L-1处理的种子发芽率、发芽势、发芽指数和活力指数最高,分别为63.67%、62.00%、16.47和1.43,与对照相比较,发芽率提高了1.01倍,发芽势提高了0.96倍,发芽指数提高了1.65倍,活力指数提高了5.50倍。

图1 6-BA、IAA和GA3处理对喜马拉雅紫茉莉种子萌发的影响Fig.1 Effects of the treatments with 6-BA, IAA and GA3 on seed germination of M. himalaica
综上可知,6-BA 10 mg·L-1对喜马拉雅紫茉莉种子萌发的促进作用最显著。
2.3 不同浓度植物生长调节剂对喜马拉雅紫茉莉幼苗生长的影响
由表8可知,不同浓度的植物生长调节剂处理对喜马拉雅紫茉莉种子幼苗的生长影响不同。IBA 2~10 mg·L-1处理,随着浓度的增大,幼苗的根长、茎长、鲜重和干重呈先升高后降低的趋势,但是鲜重增长较明显;在IBA 4 mg·L-1时,根长、茎长、鲜重和干重均高于对照,其中茎长和鲜重达到所有处理的最大值,分别为71.52 mm和137.10 mg。在6-BA 2~10 mg·L-1处理中,随着浓度的增大,根长、茎长和鲜重呈升高的趋势;6-BA 2 mg·L-1对根伸长生长有明显的促进作用,根长达93.50 mm;6-BA 8~10 mg·L-1处理有利于幼苗干物质的积累。2,4-D 2~10 mg·L-1对根长、茎长、鲜重和干重有一定的抑制作用。IAA 2~10 mg·L-1处理的种子与对照相比较,其幼苗的根长、茎长和鲜重都有不同程度的升高,其中在IAA 8 mg·L-1时根长达到所有处理的最大值,为111.69 mg;干重仅在IAA 2 mg·L-1处理时高于对照,其余处理均低于对照。NAA 2~10 mg·L-1处理下幼苗根长均低于对照;茎长和鲜重随着NAA浓度增大呈先升高后降低的趋势;对幼苗干物质的积累总体上表现为抑制作用。在GA320~400 mg·L-1处理下,幼苗的茎长、鲜重和干重均高于对照,其中GA3250~400 mg·L-1处理下,干重达到所有处理的最大值,平均干重大于8.00 mg;GA3浓度大于300 mg·L-1时会抑制根的伸长生长。

表8 不同浓度植物生长调节剂对喜马拉雅紫茉莉幼苗生长的影响Table 8 Effects of different concentrations of plant growth regulators on seedling growth of M. himalaica
3 结论与讨论
种子活力的保持和成功萌发成苗决定着植物种群的繁衍和生存,也决定植物进入自然和农业生态系统的时间[14]。因此,种子萌发具有重要的经济和生态意义。影响种子萌发的因素有很多,包括外部生态因素和内部生理因素,对不同植物来说,影响种子萌发的主要因子也有差异[14-15]。
种子带菌会引起种苗病害。本试验中所试的2种消毒方法(75%乙醇1 min+0.1% HgCl22 min和75%乙醇1 min+3% H2O23 min)均能达到较好的消毒效果,但是发芽率显著低于对照。其原因可能是,HgCl2易在种子上残留,不易分解,从而对种子产生持续的毒害,降低种子发芽率;H2O2有一定的腐蚀性,消毒时间较长则可能破坏了种子结构。只用无菌水冲洗5次后直接接种的种子,虽然带菌率为3.74%,但是种子发芽率显著高于消毒处理。另外在浸种时间试验中发现,随着时间的延长,种子污染情况愈发严重,并且严重影响到种子发芽和幼苗生长。喜马拉雅紫茉莉种子在遇水后很快在种子表面出现白色的黏液。种子黏液是在种皮外层细胞的高尔基体内产生并分泌到胞腔内或细胞壁层的吸湿膨胀的果胶类多糖物质[10-11]。种子黏液不利于消毒剂充分接触被消毒材料,并且给一些微生物提供了“藏身之所”。
外源激素法是揭示种子休眠和萌发的激素调控机理的重要研究方法,已被广泛应用于种子萌发特性研究,使用植物生长调节剂浸种可以打破种子休眠,破坏妨碍种子萌发的活性物质,从而促进种子胚的发育和种子发芽[14]。本试验中,IBA、2,4-D、NAA和IAA对喜马拉雅紫茉莉种子的萌发主要表现为抑制作用,一定浓度的6-BA和GA3可以促进种子萌发。6-BA具有促进细胞分裂、种子发芽、诱导休眠芽生长,以及抑制或促进茎、叶和根的生长等生理作用[16]。GA3具有促进细胞伸长,解除种子、块茎的休眠并促进萌发等生理作用[17]。本试验中,6-BA 10 mg·L-1对喜马拉雅紫茉莉种子萌发的促进作用最显著,其次是GA3300 mg·L-1。
植物生长调节剂对幼苗生长也有巨大的影响[16,18]。在本试验设定的浓度范围内,6-BA、GA3、IBA和IAA对喜马拉雅紫茉莉幼苗生长有明显的促进作用,NAA和2,4-D不利于幼苗干物质的累积。
