ⅠB期子宫颈癌国际妇产科联盟2018新分期的合理性验证及评估
2021-12-20吴玉梅
刘 洋 吴玉梅 何 玥 樊 蓓 王 雁 赵 辉 王 明
(首都医科大学附属北京妇产医院 北京妇幼保健院妇瘤科,北京 100006)
美国癌症学会官方期刊发表的统计数据[1]显示,子宫颈癌全球每年新发病例56.9万,新增死亡病例31.1万,发病率居女性生殖道恶性肿瘤第一位。而我国子宫颈癌发病率高居世界第二位,死亡例数约占全球10%,是威胁我国女性健康的主要恶性肿瘤之一[2]。准确分期将更好地分层管理,制定个体化治疗方案,有助于改善患者预后[3]。子宫颈癌国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2018年新分期于2018年10月14日在第22届世界妇产科大会上公布,此次修订新增ⅠB3期[4]。随后于2019年11月又在《国际妇产科杂志》上刊登发布了更正版,将肿瘤大小“=”临界值的分期由采用较高分期更正为采用较低分期,更正后的版本根据肿瘤大小(肿瘤最大径线)将ⅠB期细分成为3个亚期:ⅠB1 期(≤2 cm)、ⅠB2期(>2 cm~≤4 cm),ⅠB3期(>4 cm),并允许初治患者术后根据病理结果更改分期,拉开了子宫颈癌分期由临床分期向临床结合手术-病理分期转变的序幕[5]。虽然美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)于2020年1月14日公布的《子宫颈癌临床实践指南2020年第1版》[6]首次采用更新后的子宫颈癌FIGO(2018年)分期标准,但新的分期系统是否能够提高子宫颈癌患者的生存率,改善患者预后,尚需更多的研究数据来验证。因此,本文将主要围绕改动较大的ⅠB期展开探讨,拟通过分析新旧分期下患者的临床病理特征、治疗方案的选择、生存状态等的差异,对新分期的可靠性和实用性进行验证,分析新分期对治疗决策的影响与意义,为新分期的临床应用提供循证医学证据。
1 对象与方法
1.1 研究对象及临床资料收集
收集2010年1月1日至2014年12月31日就诊于首都医科大学附属北京妇产医院,首选手术治疗,且按照子宫颈癌FIGO(2009年)分期标准首次诊断为ⅠA1~ⅡA2期的899例子宫颈癌患者,其中排除术前接受过放射治疗(以下简称放疗)、化学药物治疗(以下间称化疗)、罕见病理类型、合并其他原发恶性肿瘤、具有严重合并症、妊娠期宫颈癌以及临床随访资料不全的病例。将这部分患者按照子宫颈癌FIGO 2018年分期标准进行重新分期,最终选取427例ⅠB期子宫颈癌患者(ⅠB1期 195例、ⅠB2期 167例、ⅠB3期 65例)纳入研究进行回顾性分析。在符合纳入标准的病例中,统计临床病例信息包括年龄、肿瘤特征(组织学类型、分化程度、深部间质浸润、淋巴脉管间隙浸润情况、中危因素)、治疗方式(手术范围、术后辅助放化疗情况)和生存状态。本研究经首都医科大学附属北京妇产医院伦理委员会批准(批准文号:2019-KY-104-01)。
1.2 治疗和随访
2018年FIGO分期的ⅠB期患者共有427例,377例患者(88.3%)接受了C型根治性子宫切除(广泛性全子宫切除术)、23例患者(5.4%)接受了B型根治性子宫切除(次广泛性全子宫切除术)、18例患者(4.2%)接受了A型根治性子宫切除(筋膜外全子宫切除术)、9例患者(2.1%)接受了子宫颈冷刀锥形切除术。其中接受了B型、C型根治性子宫切除术的400例(93.7%)患者均接受了盆腔淋巴结清扫±腹主动脉旁淋巴结切除术。术后病理报告有中高危因素的患者术后给予辅助放疗同步化疗或放疗。随访方式为电话随访及查阅门诊复诊病历。随访内容包括一般情况、妇科检查、肿瘤标志物及影像学资料。如患者已死亡,询问其死亡时间及死亡原因。随访时间截至2020年1月30日,随访时间最短63个月,最长124个月,中位随访时间98个月,其中失访41例,总失访率9.6%。主要观察指标为总生存期,定义为从接受治疗开始至子宫颈癌导致的死亡的时间或到随访截止时间。
1.3 统计学方法
使用SPSS 22.0软件进行统计学分析。采用Chisquare检验、Mann-Whitney U检验和Kruskal-Wallis H检验进行组间比较,采用Kaplan-Meier方法构建生存曲线,采用Log rank检验曲线间的统计差异。采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 新旧标准分期变化
新旧FIGO分期相比,主要变化是增加了ⅠB3期、ⅢC期,本研究纳入的899例ⅠA1~ⅡA2期患者中有65例(7.2%)患者分期变化至ⅠB3期、106例(11.8%)患者因盆腔淋巴结和或腹主动脉旁淋巴结阳性升至ⅢC期。对2018年FIGO新分期中的ⅠB期分层变化做进一步分析如下(为方便区分新旧分期,此处2009年FIGO分期用“N′期”表示): FIGO新分期中的ⅠB1期由44例ⅠA1′期(22.56%)、8例ⅠA2′期(4.10%)、143例ⅠB1′期(73.33%)变化而来;ⅠB2期全部由167例ⅠB1′期变化而来;ⅠB3期由27例ⅠB1′期(41.54%)、38例ⅠB2′期(58.46%)变化而来,详见图1。
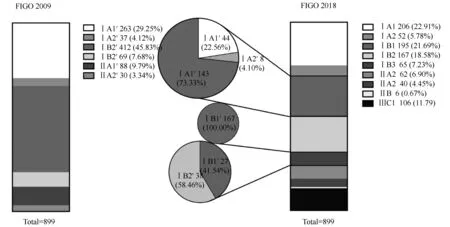
图1 新旧分期变化后ⅠB期各亚期组成Fig.1 Composition of substage in ⅠB after new and old stages changeFIGO: International Federation of Gynecology and Obstetrics.
2.2 ⅠB期患者临床病例特点分析
ⅠB期3个亚期(ⅠB1、ⅠB2、ⅠB3期)患者临床病例特点统计分析情况详见表1。结果显示,ⅠB1、ⅠB2、ⅠB3期患者平均年龄分别为45.2(29~70)岁、45.3(24~67)岁、45.2(28~63)岁,根据年龄段分组后在3个亚期之间发病年龄差异无统计学意义。病理类型、组织分化、深部间质浸润(浸润深度>1/2)、淋巴脉管间隙浸润(lymph-vascular space invasion,LVSI)以及术后辅助放化疗情况,差异均有统计学意义(P<0.001或0.05)。病理类型中鳞癌以ⅠB1期患者居多,而腺癌、腺鳞癌多见于ⅠB2、ⅠB3期患者,差异有统计学意义(P<0.001)。高-中分化癌以ⅠB1期患者居多,而低分化癌更易发生于ⅠB2、ⅠB3期患者,差异有统计学意义(P<0.001)。ⅠB2、ⅠB3期患者深部间质浸润率高于ⅠB1期患者(P<0.001)。ⅠB2、ⅠB3期患者LVSI阳性率高于ⅠB1期,差异有统计学意义(P<0.05)。ⅠB2、ⅠB3期患者术后补充放化疗的比例高于ⅠB1期,差异有统计学意义(P<0.001)。
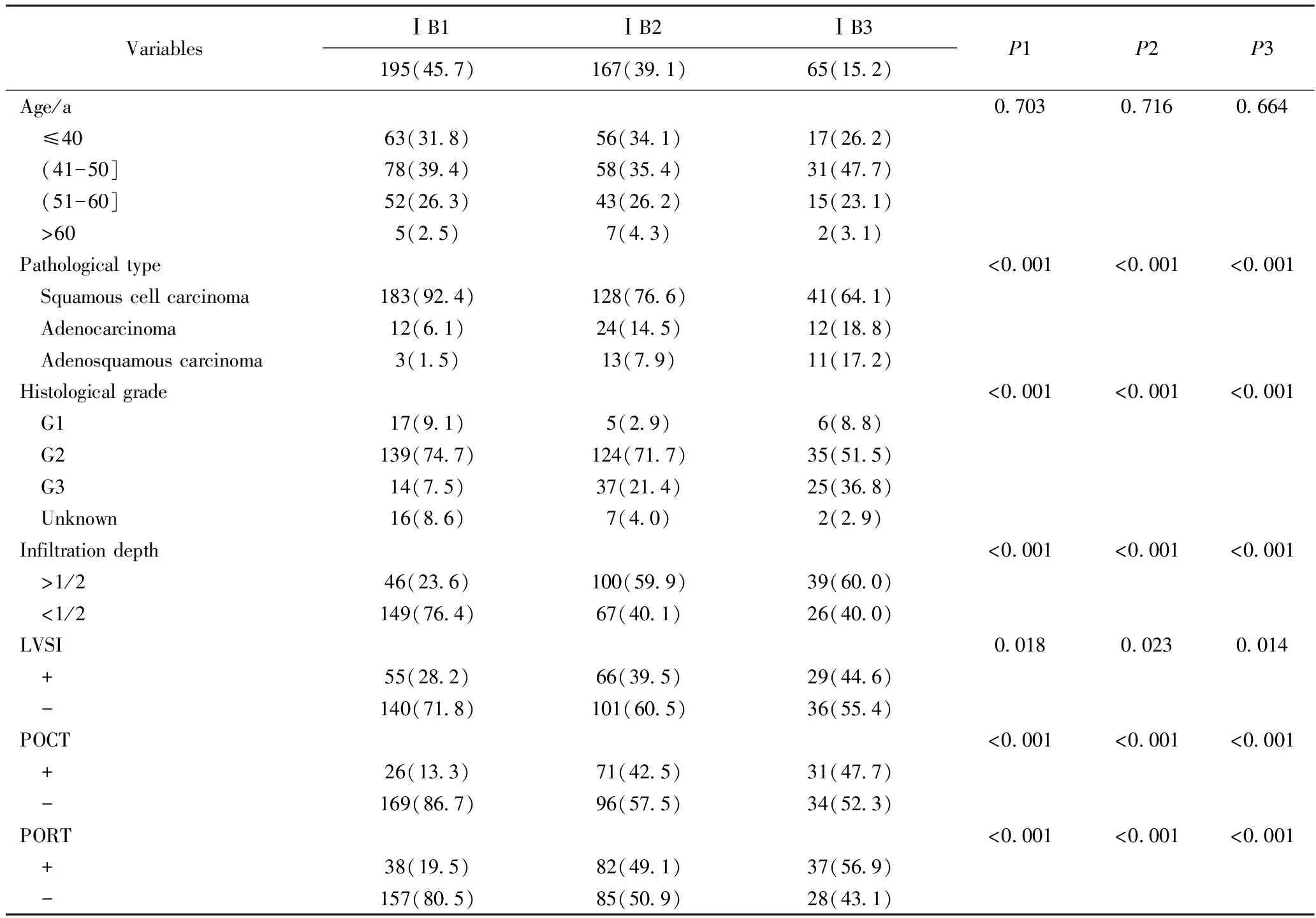
表1 ⅠB期宫颈癌患者临床病例特点
2.3 生存状态
共观察到子宫颈癌死亡病例29例,统计ⅠB期患者5年总生存率情况,其中,ⅠB1期为97.9%(191/195),ⅠB2期为93.4%(53/65),ⅠB3期为81.5%(154/167)(表2)。构建生存曲线如图2,各组生存曲线分离良好,差异有统计学意义(P<0.001)。
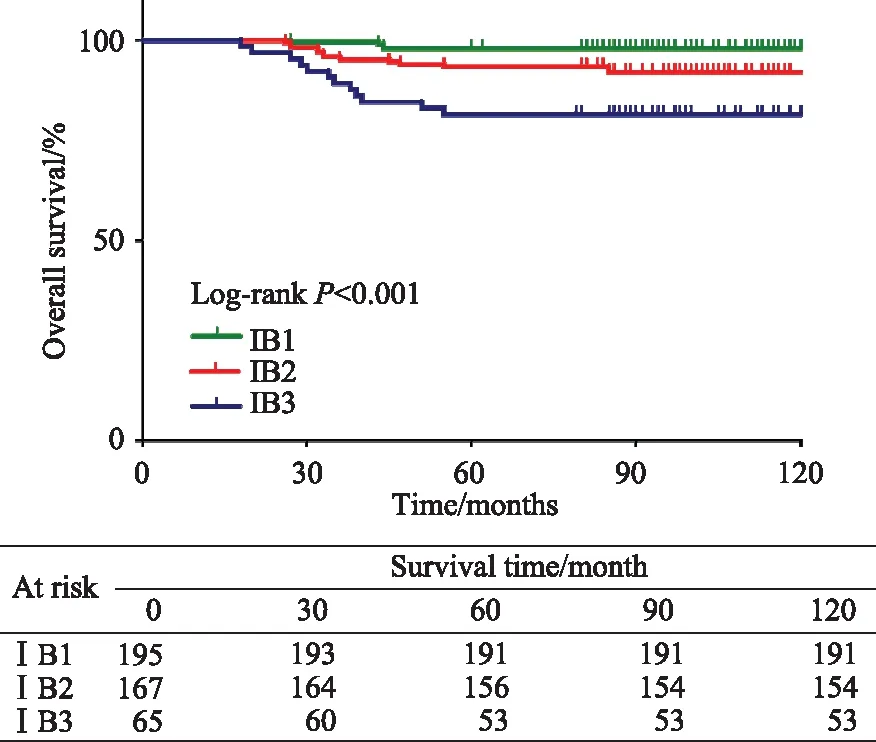
图2 宫颈癌ⅠB期患者生存曲线Fig.2 Survival curve of patients with stage ⅠB cervical cancer
2.4 单因素分析
影响ⅠB期患者预后的单因素分析结果详见表2。其中,临床期别增加、病理类型为腺癌/腺鳞癌、组织分化差的患者预后较差, 差异均有统计学意义(P<0.05),而与患者发病年龄、有无深部间质浸润及淋巴脉管间隙浸润无关。
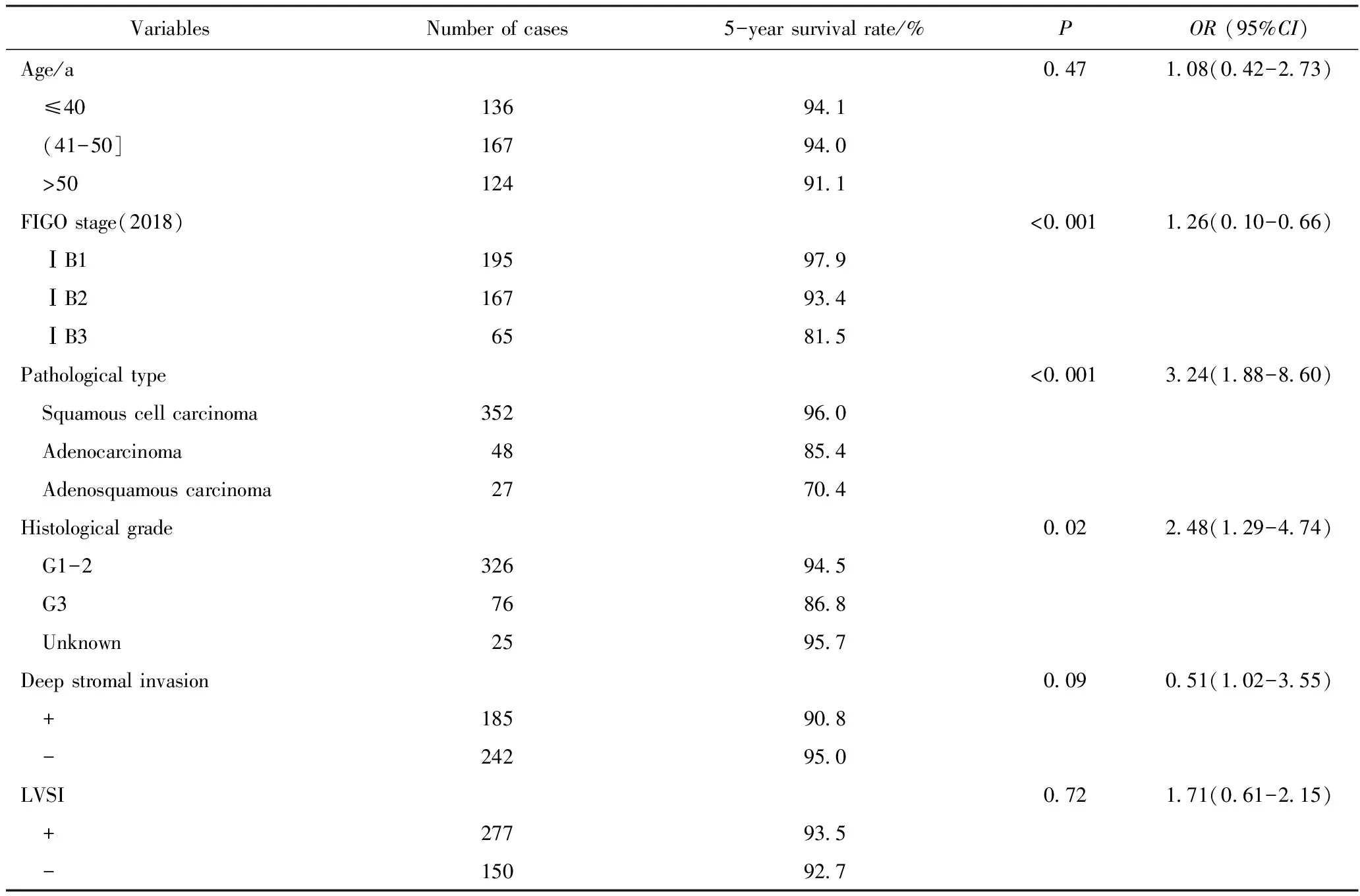
表2 影响ⅠB期宫颈癌患者5年总生存率的单因素分析
2.5 多因素分析
根据单因素分析结果,将差异有统计学意义(P<0.05)的变量代入Cox风险比例回归模型进行多因素分析,结果显示组织分化与预后的关系差异无统计学意义(P>0.05);而疾病分期、病理类型是影响ⅠB期患者预后的独立危险因素(P<0.05),数据详见表3。ⅠB2期患者的死亡风险是ⅠB1期患者的3.9倍(HR:3.90,95%CI:1.52~9.99,P<0.05),而ⅠB3期患者的死亡风险是ⅠB2期患者的2.5倍(HR:2.53,95%CI:1.31~4.89,P<0.05)。在ⅠB期宫颈癌患者中腺癌、腺鳞癌组的死亡风险增高,分别是鳞癌组的4倍和8.5倍(HR:4.02,95%CI:1.88~8.61,P<0.001;HR:8.51,95%CI:4.10~17.64,P<0.001)。
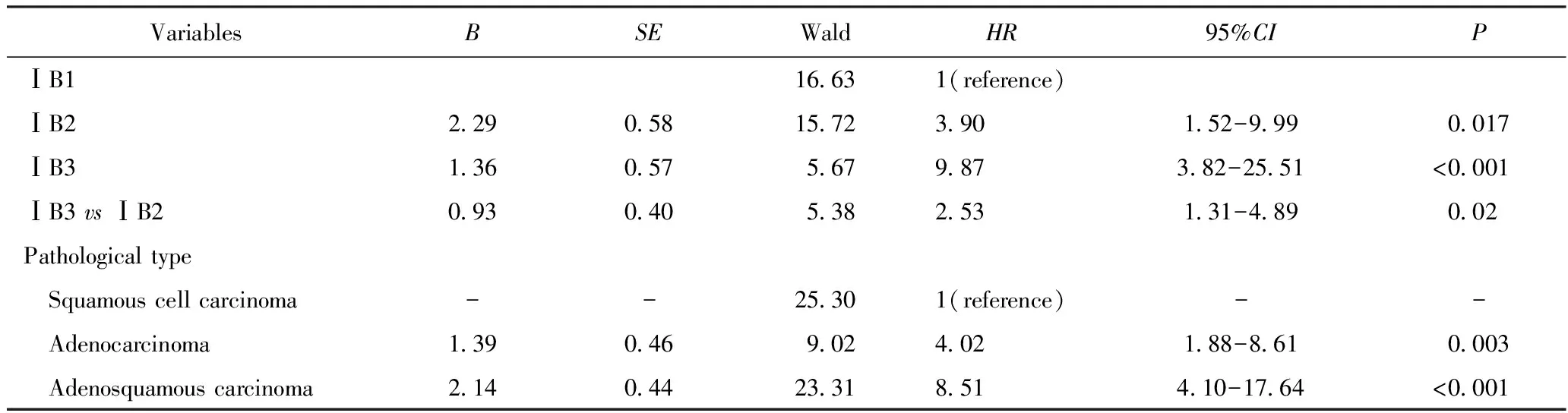
表3 ⅠB期宫颈癌患者的5年总生存率的危险因素的多因素分析Tab.3 Multivariate analysis of risk factors for 5-year overall survival in patients with stage ⅠB cervical cancer (n=427)
3 讨论
目前认为肿瘤大小是决定早期宫颈癌患者预后的重要因素之一[7-8]。新修订的2018年FIGO分期根据肿瘤大小,将ⅠB期重新分为3个亚组(ⅠB1≤2 cm、ⅠB2>2 cm~≤4 m,ⅠB3>4 cm)。新的分期系统体现着医学界对该肿瘤的更深入的认识及最新的研究成果,但新的分期系统的应用以及与之相适应的临床指南尚处于起步阶段,有些存在临床研究证据不足,其准确性以及如何应用于临床仍需要更多的研究证据来验证。
3.1 新分期有助于生存预测与疾病管理
新分期体系对于ⅠB期的重新定义,能够更准确地评价疾病严重程度和预测生存预后。Kubota等[9]研究者发现,在旧分期下的ⅠB期患者中,肿瘤最大径线>2 cm的患者相比肿瘤最大径线≤2 cm的患者发生深部间质浸润、淋巴脉管间隙浸润及盆腔淋巴结转移的风险更高。本研究结果显示,病理类型、分化程度相对较好的宫颈癌多见于ⅠB1期患者,这一期别的患者发生深部间质浸润、淋巴脉管间隙浸润以及术后接受辅助放化疗的比例也较低,而ⅠB2、ⅠB3期患者则恰好相反。Matsuo等[10]的一项基于美国国立癌症研究所数据库(Surveillance, Epidemiology, and End Results, SEER)的有关FIGO 2018年新分期验证的回顾性研究表明,疾病分期是影响预后的独立危险因素,ⅠB2期患者相比ⅠB1期的死亡风险增加了1.98倍,而ⅠB3期患者的死亡风险则相比ⅠB2期增加了2.11倍。另有Wright等[11]的回顾性研究显示,新分期后的ⅠB1、ⅠB2、ⅠB3期的5年生存率分别为91.6%、83.3%、76.1%。本研究显示,ⅠB1、ⅠB2、ⅠB3期的5年生存率依次为97.9%、93.4%、81.5%,构建的生存曲线亦显示3个亚期之间曲线分离良好,差异有统计学意义,究其原因可能是在本研究纳入病例的病理类型中,预后相对更好的鳞癌占比更大,从而表现出相对更好的预后。因此,2018年新分期增加肿瘤最大径线2 cm这一临界值,重新修订新分期为ⅠB1期(≤2 cm)、ⅠB2期(>2 cm~≤4 cm)和ⅠB3期(>4 cm)能够更精确地对疾病严重程度进行分层和评估预后,具有很好的临床指导意义。
3.2 新分期的临床应用仍需进一步探讨
本研究结果显示,ⅠB2、ⅠB3期患者术后补充放化疗的概率分别为49.1%、56.9%,显著高于ⅠB1期(19.5%),提示当肿瘤最大径线>2 cm时,术后接受辅助放化疗治疗的可能性显著升高。为避免手术与放疗对患者的双重损伤,目前NCCN指南[6]中,对于ⅠB1期宫颈癌的治疗首选根治性手术,ⅠB2期可选择手术或全疗程放疗,而ⅠB3期则首选放疗。对于有保留生育要求的肿瘤最大径线≤2 cm(ⅠB1期)及肿瘤最大径线>2~≤4 cm(ⅠB2期)的宫颈癌患者(非特殊病理类型),可选择行根治性子宫颈切除术+盆腔淋巴结切除±腹主动脉旁淋巴结切除。然而,目前的证据仅对于肿瘤最大径线≤2 cm患者的术后获益较为明确[12],有关肿瘤最大径线>2~≤4 cm患者的证据不足[13]。结合本研究结果,当肿瘤最大径线>2 cm时,术后接受辅助放化疗的可能性显著升高,这将大大降低患者的生育能力,同时意味着保留生育功能复发的风险也会增加。因此,对于ⅠB2期患者的保留生育功能手术应十分慎重,术前应与患者及家属充分探讨患者的风险与获益。
对于特殊病理类型的宫颈癌,新的分期系统可能并不能很好地体现其疾病进展过程。最近有专家[14]提出,腺癌淋巴结转移的预测因素有别于鳞癌。在这类特殊病理类型的宫颈癌中,肿瘤侵犯宫颈间质的模式以及是否存在淋巴脉管间隙浸润,相比原发肿瘤大小能更好地预测淋巴结转移的风险[15]。本研究显示,病理类型是影响预后的独立危险因素,在ⅠB期宫颈癌患者中腺癌、腺鳞癌组的死亡风险显著增高,分别是鳞癌组的4倍和8.5倍,推测宫颈腺癌、腺鳞癌的恶性生物学行为很可能有别于鳞癌,从而导致其预后更差。目前,已经有专门针对腺癌的分类系统被提出,但有关这类系统的证据十分有限,还需要更多数据进一步验证。
此外,前哨淋巴结示踪及显影技术(sentinel lymph node biopsy, SLNB)有助于筛选早期低危患者,为其免除淋巴结清扫术,有助于减少并发症,提高生活质量。目前NCCN指南认为该技术可用于ⅠB2期及以下期别的患者。该技术在肿瘤最大径线≤2 cm(ⅠB1期)的患者中的敏感性和准确性更高[16-17]。本研究结果显示,新分期 ⅠB1期中有一部分是由镜下浸润癌而来的,且这一期别发生深部间质浸润、淋巴脉管间隙浸润的风险显著低于ⅠB2期,因此认为SLNB应用于ⅠB1期早期宫颈癌患者较为安全。而对于ⅠB2期患者,本研究显示其术后补充放化疗的概率显著上升,若对ⅠB2期的患者施行SLNB有导致手术范围不足的风险,SLNB的适用范围还有待探讨。
综上,2018年FIGO新的分期系统可使临床医生更准确地预测患者的预后。本次研究为新分期的分层管理提供了数据支持,并指出了现有临床指南可能存在的不足,但仍处于初步探究阶段。如何制定出适用于不同分组的宫颈癌患者标准化的治疗方案,实现提高患者生存的最终目标,还需要通过更多的数据来进一步验证。
