主要促进因子超家族成员MFSD2A对肝癌细胞增殖、凋亡和侵袭的影响
2021-12-20安松林
安松林 马 玲 赵 月 李 雁*
(1.首都医科大学附属北京世纪坛医院肿瘤外科,北京 100038; 2. 北京电力医院普通外科,北京 100073)
主要促进因子超家族蛋白2A(major facilitator superfamily domain containing 2A,MFSD2A)是一种膜蛋白,于2008年被Angers确认为主要促进因子超家族(major facilitator superfamily,MFS)的新成员[1]。MFSD2A在胚胎发育、脂代谢、炎症、再生和血-脑脊液屏障中均具有重要作用[2]。肿瘤相关的研究[3]显示,MFSD2A在肺癌中发挥抑癌基因的功能,但MFSD2A在肝细胞肝癌中的研究尚未见报道。本研究通过构建慢病毒载体转染肝癌细胞,干扰MFSD2A在肝癌细胞中的表达,探索其对细胞增殖、凋亡和侵袭能力的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系
肝癌细胞系HepG2和SMMC-7721从美国模式培养集存库(American Type Culture Collection,ATCC)购得。
1.1.2 主要试剂
DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,Plv-EGFP载体购自中国赛亚生物科技有限公司,感受态细胞Stbl3和切胶回收试剂盒购自中国康为世纪生物科技有限公司,限制性内切和T4 DNA连接酶和SYBR Premix Ex Taq购自日本Takara公司;单克隆片段重组酶试剂盒购自中国南京诺唯赞生物科技有限公司,抗-MFSD2A抗体(ab105399)购自英国Abcam公司,Cell Counting Kit-8(CCK-8)购自日本Dojindo公司,PE Annexin V Apoptosis Detection Kit I购自美国BD Pharmingen公司,Transwell小室及Matrigel基质胶购自美国Corning公司。
1.2 方法
1.2.1 细胞培养
肝癌细胞系HepG2和SMMC-7721均由DMEM培养液混合10%(体积分数)FBS,100 μg/mL 链霉素和100 U/mL青霉素在37 ℃、5%(体积分数) CO2细胞培养箱中培养。
1.2.2 构建稳定高表达MFSD2A的肝癌细胞株
根据MFSD2A基因[美国国家生物信息中心(National Center for Biotechnology Information, NCBI) Reference Sequence: NM_001136493.2]序列分析的结果及质粒上基因的插入位点,分别进行DNA的设计及合成;线性化Plv-EGFP载体;切胶回收线性化载体并检测浓度;通过同源重组的方式将合成的DNA片段连接到线性化载体上;提取质粒,测序验证重组克隆中插入序列是否与要求一致。按照预实验中确定最佳的感染条件和感染复数(multiplicity of infection,MOI),对肝癌细胞HepG2和SMMC-7721进行转染,通过qPCR和Western blotting检测MFSD2A的上调效果。
1.2.3 构建稳定低表达MFSD2A的细胞株
根据靶基因MFSD2A设计3条shRNA,选取的靶位点如下:5′AGCCGGAACGTGTCAAGTTTACTCGAGTAAACTTGACACGTTCCGGCT-3,5′-ATCATGCTCTCGGCCA- CTTTACTCGAGTAAAGTGGCCGAGAGCATGAT-3,5′-CCAT- GCTGCCTGATGTCATTGCTCGAGCAATGACATC-AGGCAGCATGG-3′;根据载体上靶基因插入位点设计合成shRNA Oligos,通过退火的方式合成双链DNA;提取质粒,测序验证重组克隆中插入序列是否与要求一致。按照预实验确定最佳的感染条件和MOI,对肝癌细胞HepG2和SMMC-7721进行转染,通过qPCR和Western blotting检测MFSD2A的下调效果。
1.2.4 CCK-8法检测细胞活力
收集处于对数生长期的转染后HepG2和SMMC-7721细胞,三羟甲基氨基甲烷-乙二胺四乙酸(Tris-ethylenediaminetetraacetic acid,Tris-EDTA)缓冲液消化后用磷酸盐缓冲液(phosphate buffer solution, PBS)重悬,细胞计数,制作浓度为1×105个/mL的细胞悬液,在96孔板中接种细胞悬液,每孔100 μL,每组设置3个复孔。将96孔板置入37 ℃、5%(体积分数) CO2培养箱中培养,分别于6、12、24、36、48、72 h后收集细胞,吸去旧培养基,更换新鲜培养基,每孔加入10 μL CCK-8溶液,避免产生气泡影响度数;继续于细胞培养箱中孵育1.5 h显色(预实验证明孵育1.5 h显色效果最佳);酶标仪检测各孔450 nm处的吸光度。
1.2.5 流式细胞术检测细胞凋亡
收集处于对数生长期的转染后HepG2和SMMC-7721细胞,用不含乙二胺四乙酸(EDTA)的胰酶消化细胞,PBS清洗两次;加入500 μL的Binding Buffer悬浮细胞,加入5 μL的Annexin V-APC,轻柔吹打混匀,加入5 μL的PI染液,轻柔吹打混匀;室温条件下,避光孵育15 min;在1 h内上流式细胞仪检测。
1.2.6 Transwell小室细胞侵袭实验
在冰上将Matrigel基质胶稀释为300 μg/mL的工作液,加入Transwell小室的上室面,每孔100 μL,于37 ℃培养箱中静置1 h使基质胶凝固,凝固后小心弃去上层培养基,制成包被基底膜的Transwell小室;为处于对数生长期的细胞更换无血清培养基,饥饿12 h以去除血清对实验结果的影响;消化、重悬得到浓度为5×105/mL的细胞悬液,取200 μL加入Transwell小室的上室,500 μL含10%(体积分数) FBS的细胞培养基加入下室;在细胞培养箱中孵育24 h后用棉签小心擦去上室内的基质胶及未穿过基质胶的细胞,PBS清洗小室2遍,用预冷甲醇固定30 min;风干小室,用0.1%(体积分数)的结晶紫染色20 min,PBS清洗3遍,将小室底膜固定于载玻片上;倒置显微镜下观察,每张选取10个视野拍照,统计侵袭细胞的数量。
1.3 统计学方法
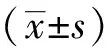
2 结果
2.1 差异表达MFSD2A的肝癌细胞株构建
通过转染慢病毒载体后成功构建稳定高表达及低表达MFSD2A的细胞株HepG2及SMMC-7721(图1A),使用qPCR(图1B)及Western blotting(图1C及1D)对转染效率进行验证后发现,MFSD2A的转染效率均符合预期。
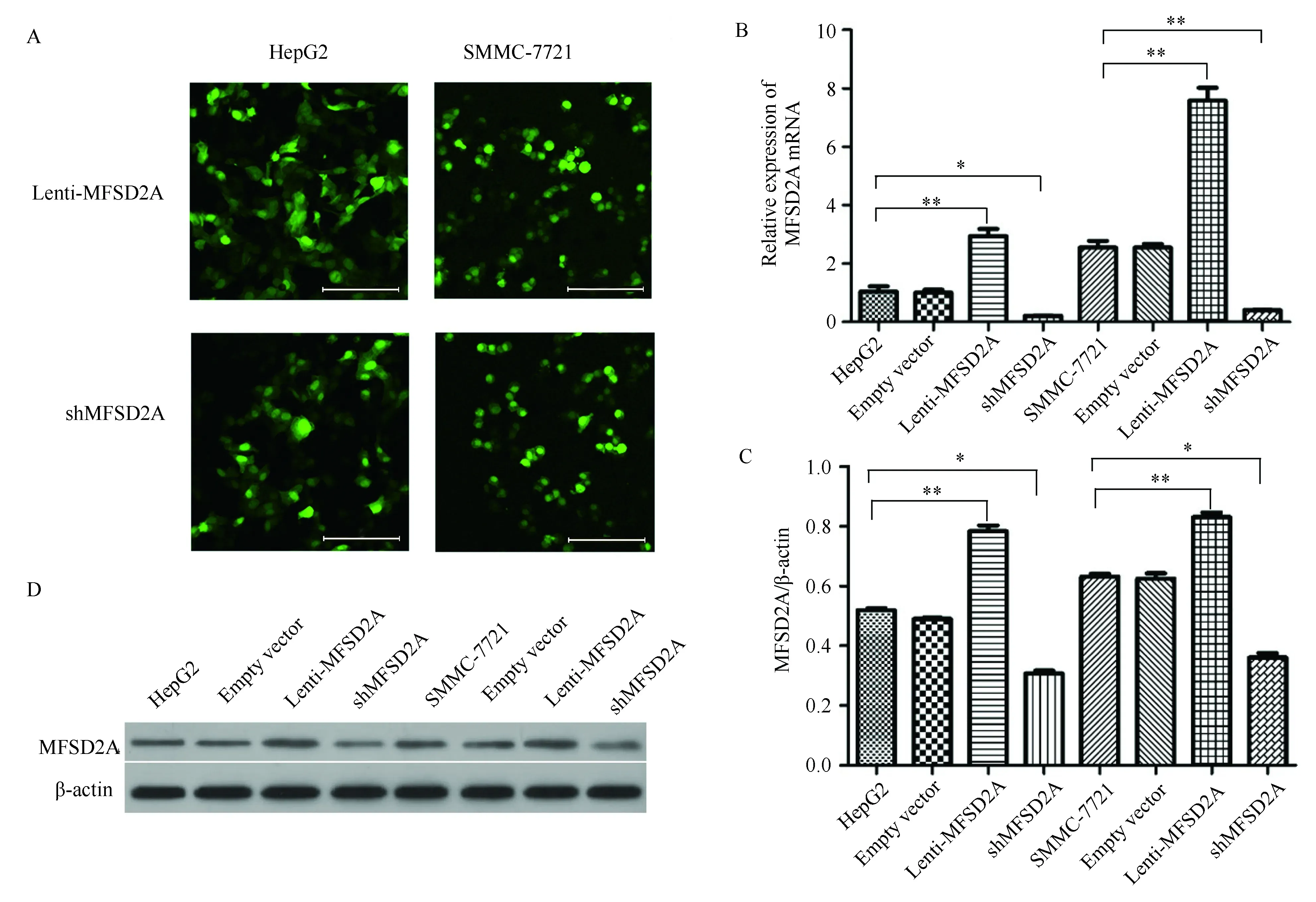
图1 成功构建稳定高表达和稳定低表达MFSD2A的肝癌细胞株Fig.1 The stable high expression and low expression of MFSD2A were successfully constructedA: The expression of MFSD2A was observed by fluorescence microscope; Scale bar=200 μm. B: The mRNA expression of MFSD2A was detected by qPCR; C: The protein expression of MFSD2A was detected by qPCR; D: Western blotting. *P<0.05, **P<0.01, n=3; MFSD2A: major facilitator superfamily domain containing 2A.
2.2 MFSD2A对肝癌细胞增殖的影响
运用CCK-8法分别于12、24、36、48和72 h对转染后肝癌细胞的增殖能力进行检测后发现,与对照组相比,上调MFSD2A表达可抑制HepG2(图2A)和SMMC-7721(图2B)细胞的活力,细胞增殖速率明显下降(P<0.05),而下调MFSD2A表达对HepG2和SMMC-7721的细胞增殖无明显影响(P>0.05)(图2A、2B)。
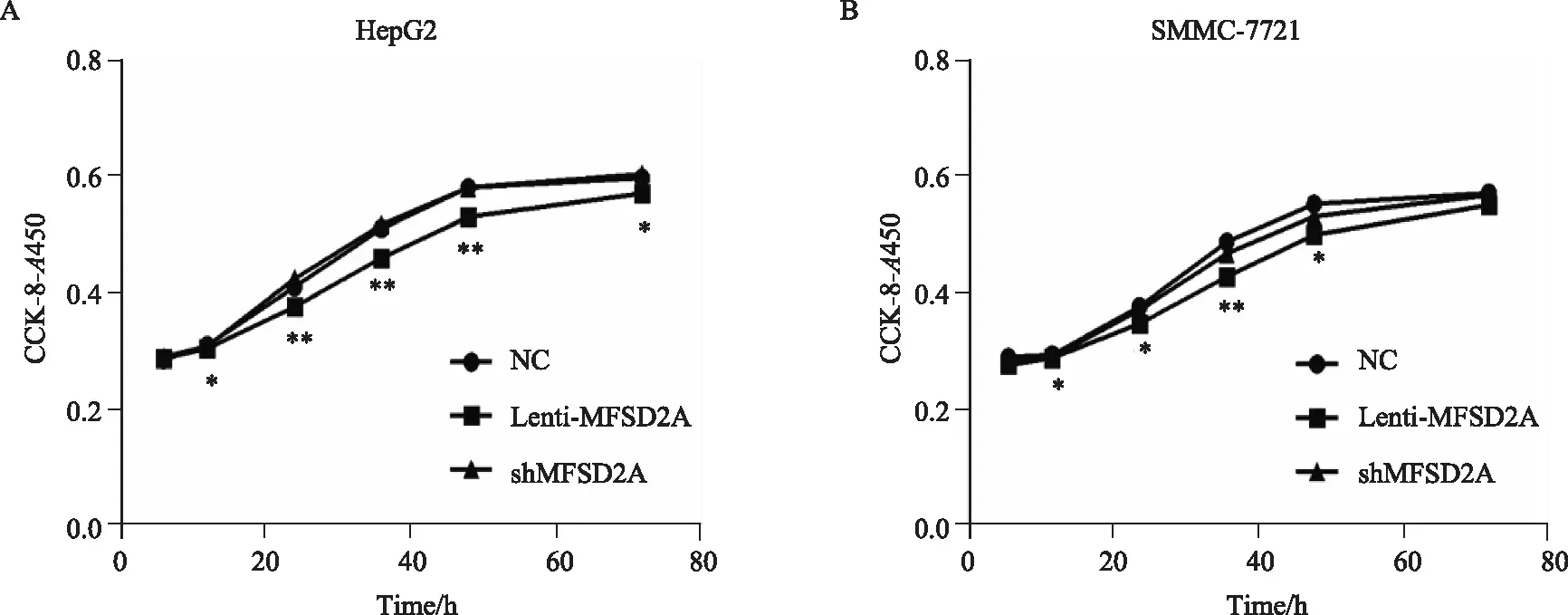
图2 CCK-8法绘制转染后肝癌细胞的生长曲线变化Fig.2 CCK-8 method was used to draw the growth curve of hepatocellular carcinoma cell lines after transfectionA: The growth curve of HepG2 cells after differential expression of MFSD2A; B: The growth curve of SMMC-7721 cells after differential expression of MFSD2A. *P<0.05, **P<0.01 vs NC group, n=3; MFSD2A: major facilitator superfamily domain containing 2A; NC: normal control.
2.3 MFSD2A对肝癌细胞凋亡的影响
运用流式细胞术对细胞凋亡进行分析后发现,与对照组相比,上调MFSD2A表达的HepG2(图3A)和SMMC-7721细胞(图3B)的基础凋亡率明显升高;而下调MFSD2A表达的HepG2和SMMC-7721细胞的基础凋亡率均有明显下降(P<0.05)。
图3 流式细胞术检测转染后肝癌细胞的细胞凋亡变化Fig.3 Flow cytometry was used to detect the apoptosis of hepatocellular carcinoma cell lines after transfectionA: The changes of apoptosis and the comparison of basic apoptosis rate of HepG2 cells after differential expression of MFSD2A; B: The changes of apoptosis of SMMC-7721 cells after MFSD2A differential expression. *P<0.05, **P<0.01 vs NC group, n=3; MFSD2A: major facilitator superfamily domain containing 2A; NC: normal control.
2.4 MFSD2A对肝癌细胞侵袭的影响
运用Transwell小室侵袭实验对细胞侵袭能力进行检测后发现,与对照组相比,下调MFSD2A表达的HepG2和SMMC-7721细胞穿透基质胶的细胞数显著增多,细胞侵袭能力升高;上调MFSD2A表达的HepG2和SMMC-7721细胞穿透基质胶的细胞数显著减少,细胞侵袭能力降低(P<0.05)(图4)。
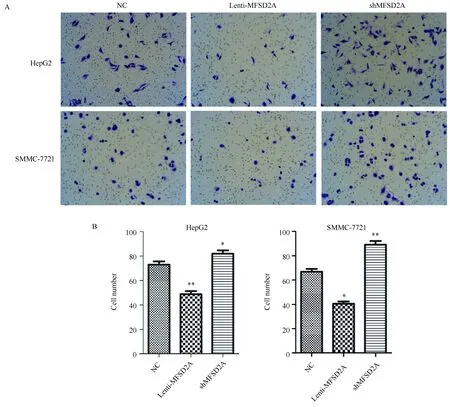
图4 Transwell小室侵袭实验检测转染后肝癌细胞的侵袭能力变化Fig.4 Transwell chamber invasion assay was used to detect the invasion ability of transfected hepatocellular carcinoma cell linesA: Cell crystal violet staining through the matrix gel of Transwell chamber(100×); B: Comparison of the number of cells penetrating the matrix gel of Transwell chamber; *P<0.05, **P<0.01 vs NC group, n=3; MFSD2A: major facilitator superfamily domain containing 2A; NC: normal control.
3 讨论
2008年,MFSD2A被确认为膜蛋白促进调解蛋白超家族的新成员,其定位于细胞膜、内质网膜和细胞质,在脑、小肠、肝、肾、肺、乳腺、前列腺、胎盘以及棕色脂肪组织内含量丰富[1, 4]。MFSD2A与体质量增长、运动机能和棕色脂肪产热过程相关[5]。研究[6]显示,MFSD2A在血-脑脊液屏障的内皮细胞中高表达,是调控血-脑脊液屏障发育和功能的关键因子,具有抑制水泡样胞吞转运的作用,将MFSD2A基因敲除,水泡样胞吞转运作用增强,导致从胚胎到成年所有阶段的血-脑脊液屏障破坏。MFSD2A还是ω-3脂肪酸二十二碳六烯酸(omega-3 fatty acid docosahexaenoic acid,DHA)的转运蛋白,是胎儿大脑和成年人大脑摄取DHA的主要途径[7]。
根据目前的文献[3,8-9]报道,MFSD2A在肿瘤中可能扮演着抑癌基因的角色。Spinola所在的研究团队[8]对MFSD2A在肺癌中的表达和功能进行了系统研究,发现1个106 kb连锁不平衡(1inkage disequilibrium,LD)区域含有与肺腺癌生存紧密相关的遗传组件,这个区域位于1号染色体p34区,其中包含MFSD2A基因[8];在肺腺癌和非小细胞肺癌检测了MFSD2A的表达水平,发现癌组织较癌旁正常组织中MFSD2A的mRNA水平下调了80倍[9];体外研究[3]显示,在肺癌细胞中过表达MFSD2A,可导致G1期阻断与S期DNA合成减少、细胞黏附与体外迁移受阻;用甲基转移酶抑制剂和去甲基化试剂处理MFSD2A过表达的细胞后,MFSD2A的表达得以恢复,表明甲基化在MFSD2A表达抑制中具有一定作用,但其具体机制仍不明确。本研究显示在肝癌细胞中过表达MFSD2A,细胞黏附与体外迁移受阻,诱导凋亡,与上述研究结果相似。
中国人群的一项单核苷酸多态性(single nucleotide polymorphisms,SNP)分析[10]显示,MFSD2A rs4233508 T>C CC基因型可增加年轻胃癌以及中高分化肠型胃癌的发病风险。通过免疫组化方法研究MFSD2A的蛋白表达,发现MFSD2A在胃癌组织中表达低于癌旁正常组织;MFSD2A阴性胃癌组织的微血管密度高于MFSD2A阳性者;MFSD2A在中高分化胃癌组织中的表达水平高于低分化胃癌,在早期胃癌组织中的表达高于进展期胃癌;以上结果提示,MFSD2A可能影响肿瘤血管生成,抑制胃癌的发生和进展[11]。细胞黏附介导的耐药性是血液系统恶性肿瘤耐药和复发的机制之一,Arvidsson等[12]通过体外实验发现,MFSD2A可能在套细胞淋巴瘤、慢性淋巴细胞白血病中参与了细胞黏附介导的微环境信号传递过程。
Pu等[13]发现MFSD2A在肝损伤和再生过程中发挥了重要作用,MFSD2A表达阳性的细胞群在肝脏内稳态中减少,肝部分切除诱导的肝脏再生能显著刺激门静脉周围MFSD2A阳性肝细胞的扩增;在慢性肝损伤中,MFSD2A阳性的肝细胞群体明显扩张;而研究[14-18]显示,80%以上的肝细胞肝癌是在慢性肝损伤的基础上发生的。因此,MFSD2A促进慢性肝损伤修复,可能延缓了慢性肝损伤发展为肝细胞肝癌的进程。
Xing等[19]研究发现,MFSD2A在肝癌组织中表达低于正常组织;肝癌患者MFSD2A血浆浓度低于健康人;MFSD2A表达水平较低的肝癌患者预后较差;多因素分析显示,MFSD2A是肝癌患者预后差的独立预后因素(P=0.027)。
本研究显示,在肝癌细胞中过表达MFSD2A,可显著抑制细胞活力,诱导基础凋亡,并在一定程度上导致细胞黏附与体外迁移受阻;而下调MFSD2A则导致相反的促肿瘤效应。与上述研究结果相似,MFSD2A在肝癌的肿瘤进程中发挥抑癌基因的保护性功能,其异常下调可促进肝癌的发生发展,但其具体机制仍待后续深入研究。
