光电与微生物结合的生物杂化光合体系生产聚β-羟基丁酸酯的研究进展
2021-12-18王君婷许梦莹
张 甜,王君婷,许梦莹
(1.武汉理工大学化学化工与生命科学学院,武汉 430070;2.武汉理工大学材料科学与工程学院,武汉 430070)
近年来随着工业的迅速发展,塑料制品的需求量与日俱增,2014年全球塑料年产量已超过3亿吨[1].而化学合成塑料的自然降解耗时长、难度大.不恰当地焚烧、堆积或倾倒废弃塑料带来的空气、土壤和水污染问题日益严重.同时,化学合成塑料的原料大多来自不可再生的化石能源.根据有关报道,2018年全球一次能源消费增长率为2.9%,碳排放量增长了2.0%,是近7年来最快增速[2].CO2等温室气体的大量排放也在一定程度上导致了全球气候变暖.日益窘迫的环境污染与能源枯竭问题正受到全世界的关注,迫使人们不断寻求可持续发展的生物可降解塑料来代替传统塑料.
聚β-羟基丁酸酯,简称PHB,是一种线性高分子聚合物,作为一种储能物质广泛存在于微生物中[3].由于结构的高度立体规整性,PHB具有较高的结晶度(65%~75%),具有与聚丙烯相似的力学性能[4].此外,PHB还因其良好的生物相容性和可降解性,在众多领域取得广泛应用,特别是作为生物可降解塑料成为了研究关注的热点.目前,PHB主要通过微生物发酵合成[5-7].自然界中可用于生产PHB的菌株种类繁多,其中发酵水平较高且研究最多的菌株是真养产碱杆菌Ralstoniaeutropha,(又名Alcaligeneseutrophus、Cupriauidusnecator)[8].它是一种兼性化能无机自养型革兰氏阴性菌,既能通过ED途径(Entner-Doudoroff Pathway)利用果糖、葡萄糖酸以及其他有机酸等多种有机物异养生长,也能通过卡尔文循环(Calvin-Benson-Bassham,CBB)利用O2、CO2、H2等自养生长[9].
利用不可再生的化石能源生产合成塑料在一定程度上加剧了能源紧张局势,同时还会带来白色污染问题.太阳能作为一种可再生清洁能源,分布广泛,获取方便.因此,利用廉价的太阳光能通过光合作用将CO2还原为可降解材料为从根本上解决这些问题提供了一条有效途径.自然界中生物体主要通过光合作用将太阳能转化为化学能.与自然光合作用相比,包括高效光催化剂、固态光伏装置和光电化学电池在内的人工光合系统具有更高的光吸收效率[10].但利用人工光合系统一般合成的是一些小分子化合物,如一氧化碳[11]、甲烷[12]、甲醇[13]、甲酸[14]等.而生物系统因具有具备高特异性、自我复制与修复等优良特性的生物酶则可以合成大量具有高附加值的高分子化合物[15].因此,结合两者优点,进而构建一个人工光合系统与生物的杂化光合体系是一条具有良好发展前景的化合物合成路径.近年来,不少研究尝试利用生物杂化光合系统来生产生物可降解材料PHB.主要包括光催化剂协同微生物杂化光合系统和微生物电合成(microbial electrosynthesis,MES)系统.前者将具有良好生物相容性的光催化剂与特定微生物相结合,因不涉及电极、光伏电池及电解槽等设备,故其成本也相对较低;后者以CO2为底物,利用微生物实现了电能到化学能的高效转化,且具有较高的化学品生产特异性.其外加电源可由太阳能、风能、核能、水能等清洁能源驱动,来源广泛且可再生.将太阳光能收集装置与MES系统结合起来,既提高了生物固碳效率,又实现了太阳光能和电能的存储与转化[16].本文主要综述了利用该系统生产PHB的最新研究进展,以及存在的问题和发展方向.
1 光催化剂协同微生物杂化光合体系
该生物杂化光合体系由光催化剂与微生物组成,选用的光催化剂具有较高的光吸收效率,微生物在系统中是一种具有高选择性的“生物催化剂”.其作用原理为光催化剂接收大于或等于其禁带宽度的入射光子的能量后,其价带(valence band,VB)电子跃迁至导带(conduction band,CB)并通过某种机制直接或间接地转变为生物还原当量(reducing equivalents,Red),这些还原当量可以促进微生物代谢合成许多人工光合系统无法合成的复杂化合物[17].可用于生物杂化光合体系吸收太阳能的非生物系统还包括光伏电池与电解槽耦合的人工光合系统以及光电化学电池等.与之相比,该生物杂化光合体系结构简单,在实际应用中可能更具成本优势.
光催化剂参与的生物杂化光合作用是一个新兴的,多学科交叉的研究方向.在该领域最先发展起来的是光催化剂—酶杂化光合体系.起初,科学家的研究重点在于利用光催化剂—酶杂化光合体系产氢、进行人工固碳或固氮.例如,将无机材料与光系统Ι(PSΙ)或氢化酶相耦合可实现人工产氢[18-19];在此基础上,将氢化酶换成甲酸脱氢酶(FDH)、甲醛脱氢酶(FaldH)和醇脱氢酶等则可以进一步生产甲酸、甲醇等小分子化学品[20-21].但该体系同时也存在着酶的提取与保存困难、光催化剂与酶的结合可能会降低酶活性、产物简单,不能合成高附加值的长碳链分子化合物等问题[22].后来,科学家将具有特定代谢途径的微生物与光催化剂结合构建了光催化剂-微生物杂化光合体系.系统发展之初,杨培东课题组率先利用热醋穆尔氏菌(Moorellathermoacetica)与CdS结合构建了M.thermoacetica—CdS生物杂化光合体系,用以固定CO2生产乙酸[16].后来逐渐有科研工作者利用该生物杂化光合体系生产PHB.Wang等[23]构建了一个由沼泽红假单胞菌Rhodopseudomonaspalustris(ACCC 10649)和CdS纳米粒子组成的生物杂化光合体系来还原CO2合成PHB和类胡萝卜素.R.palustris是一种广泛分布于自然界中的厌氧菌,具有多种新陈代谢方式,可通过光合自养、光合异养、化学自养、化学异养等四种代谢模式进行生长.在Cd2+存在的条件下,R.palustris细胞内的半胱氨酸脱硫酶会催化半胱氨酸释放S2-至培养基中.随后S2-与Cd2+结合生成CdS包覆在细胞表面.通过这种方法形成的CdS与R.palustris细胞紧密结合,能有效提高体系细菌密度和PHB、类胡萝卜素的产量,且其作用效果与CdS纳米粒子的含量成正相关.同时,实验预先通过化学方法合成CdS,然后将其与天然R.palustris混合,结果发现其并不能有效提高最终的细胞密度,效果远不如Cd2+与S2-在R.palustris细胞表面原位组装形成的CdS—R.palustris生物杂化光合体系.由此可见,半导体-细胞界面是电子高效传递的关键.实验进一步探究了CdS—R.palustris生物杂化光合体系促进CO2还原的潜在作用机制(图1).在光照条件下,CdS纳米粒子受光激发产生光生电子,促进还原当量和ATP的形成,形成的还原当量和ATP随即参与细菌细胞内的CBB循环合成甘油醛3-磷酸,随后通过胞内代谢途径合成类胡萝卜素和PHB.最终,R.palustris的固体生物量、类胡萝卜素和PHB产量分别提高到了148%、122%和147%.
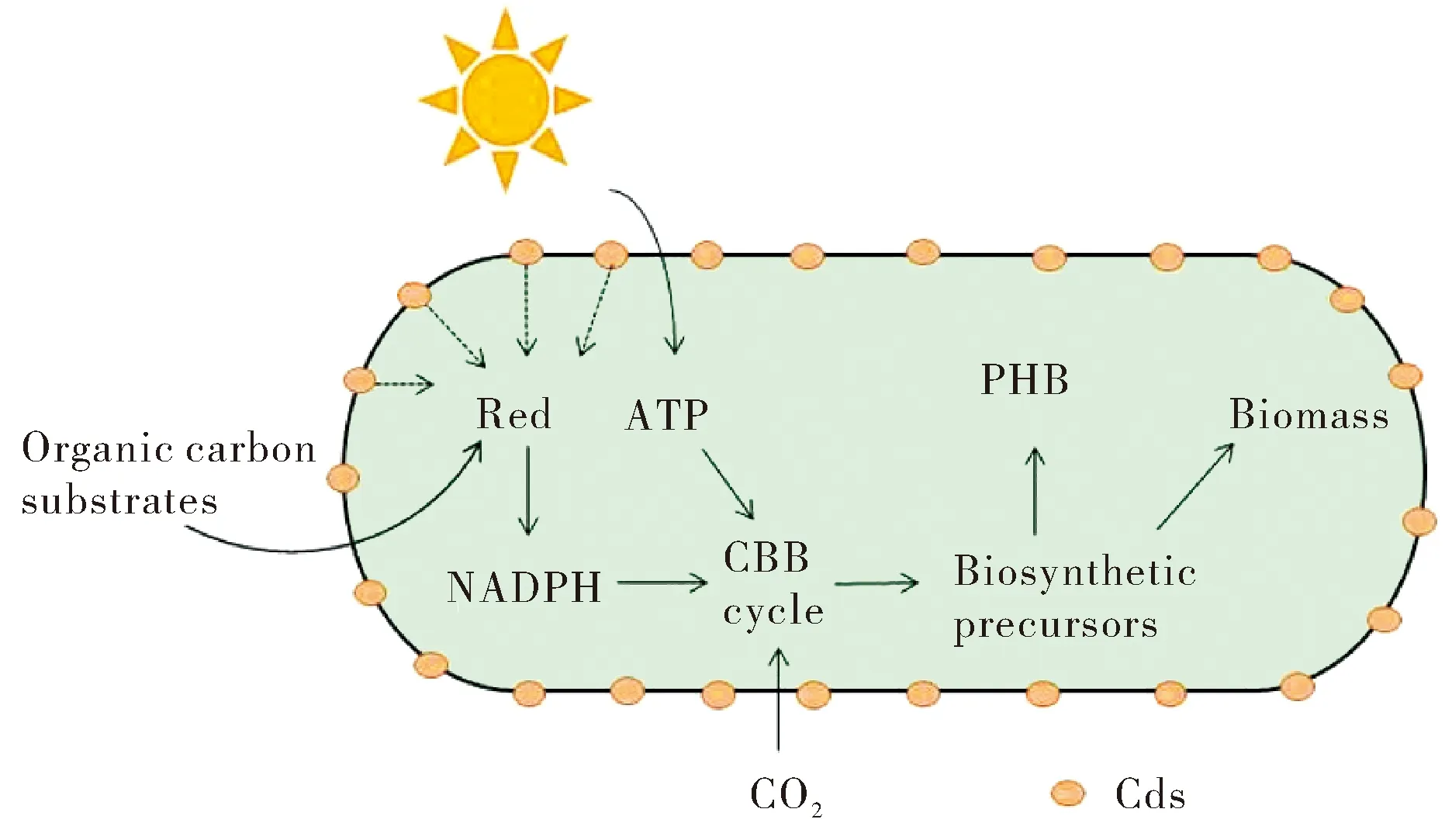
图1 CdS协同R. palustris生物杂化光合体系产PHBFig.1 PHB production by hybrid photosynthetic system coupled with CdS and R. palustris
最近,本课题组也开发了一种生产PHB的新型生物杂化光合体系(图2).该体系由石墨相氮化碳(g-C3N4)和真养产碱杆菌(Ralstoniaeutropha)组成[24].g-C3N4是一种非金属半导体聚合物,具有合适的禁带宽度(2.7 eV).与金属基光催化剂相比,其合成成本低、生物相容性好、化学和热稳定性高、且具有较高的比表面积[25].R.eutropha是目前最为常见的产PHB菌种,在营养均衡的条件下,菌株PHB积累量不及细胞干重的3%,而在碳源充足的条件下,适当限制氮源或磷源,可明显提高菌株PHB产量[26].g-C3N4受光激发产生的光生电子促进了还原当量的生成,进而促进R.eutropha体内NADPH的再生,NADPH不仅可以直接促进乙酰乙酰辅酶A向PHB的转化.同时,NADPH也可能参与胞内固定CO2的CBB循环,合成乙酰辅酶A.随后,乙酰辅酶A依次经β-酮硫解酶(PhaA)、乙酰乙酰辅酶A还原酶(PhaB)和PHB合成酶(PhaC)催化,最终生成PHB[24].研究结果显示,生物杂化光合体系中PHB产量是单独R.eutropha产量的1.2倍,向混合体系中加入电子供体三乙醇胺(TEOA)后可将PHB产量提高至1.4倍.并且实验检测到参与合成PHB的电子只有一小部分来自于g-C3N4光催化产生的H2.据此,猜测g-C3N4与细菌之间的电子传递可能并非以H2为传递介质.为了探究g-C3N4光催化促进R.eutropha产PHB的原因,课题组进一步构建了g-C3N4—Catalase体系,并将其与R.eutropha结合,与单独培养R.eutropha相比,在异养和自养的条件下,菌株的PHB产量均提高了约一倍[27].这主要是因为混合体系中Catalase通过分解附着在g-C3N4表面的H2O2,释放被H2O2占据的催化活性位点,进而促进H2和O2的生成,而H2和O2都是R.eutropha自养生长所需要的气体.实验还利用电化学阻抗谱法分析了光生电子的转移过程,结果表明g-C3N4与Catalase结合能有效降低光催化剂与微生物间的电荷转移电阻,进而促进R.eutropha生产PHB.这在一定程度上解释了g-C3N4—R.eutropha生物杂化光合体系提高PHB产量的原因.但目前,光生电子从g-C3N4到R.eutropha的转移途径仍不清晰,还需要更深入的探究.此外,实验探究了TEOA的浓度、g-C3N4浓度及培养基的初始pH值等实验条件对R.eutropha菌株PHB产量的影响,并对其进行了优化,最终确定其最佳实验条件分别为:TEOA浓度0.5%,g-C3N4浓度0.5 g·L-1,初始pH值6.8[24].

图2 g-C3N4协同R. eutropha生物杂化光合体系产PHBFig.2 PHB production by hybrid photosynthetic system coupled with g-C3N4 and R. eutropha
基于该体系发展现状,一方面可通过材料改性进一步提高材料的光催化性能,具体包括:形貌和结构调控[28-29]、元素掺杂[30-32]、贵金属沉积[33-34]、构建异质结复合材料[35-36]等.另一方面,可通过基因工程提高产PHB菌株的生产能力、进一步优化产PHB菌株的培养条件等途径来提高PHB产量.
2 微生物电合成体系
微生物电合成(microbial electrosynthesis,MES)是近10年来逐渐发展起来的一种生物电化学技术.常见的MES系统主要由阳极室和阴极室构成,两电极浸入电解质溶液中,中间由离子交换膜(ion-exchange membrane,IEM)或盐桥隔开.在外源电能输入的情况下,微生物通过直接或间接的方式从电极吸收电子还原CO2合成燃料和化学品[37].MES系统由外部电源驱动,而外部电源可利用太阳能、风能等可再生能源发电.目前微生物电合成的产品以甲烷[38]、甲酸[39]、乙醇[40]、乙酸[41]、丁酸[42]等低分子化合物为主,商业价值不高.除此之外,电极与微生物之间较低的电子传递效率也成为了限制该技术工业化发展的瓶颈之一[43].近年来,越来越多的科学家将人工光电转化装置应用于微生物电合成技术生产包括PHB在内的各种化学品,取得了良好成效.
2.1 光伏电池驱动的微生物电合成
与生物的光合作用相比,太阳能光伏电池板具有很高的能量转化效率.目前,太阳能光伏电池板光能-电能转化效率约为18%,并且最新研究有望将其提高至40%[44].将光伏电池与MES系统相耦合,能大大提高光能到化学能的转化效率,具有很好的能源效益.
Liu等[45]构建了一个多晶硅太阳能电池驱动的MES系统来生产PHB和C3~C5液态杂醇(图3).实验选用菌株同样为R.eutropha,阳极和阴极材料分别为CoPi、Co-P合金.在外接电源的条件下,阳极水分解产生H+,e-和O2,电子通过导线从阳极流向阴极,质子则通过电解液迁移到阴极,接着H+被Co-P阴极还原为H2.当有连续CO2鼓入时,阴极处的R.eutropha捕获H2产生还原当量,用于还原CO2.实验过程中阴极Co-P合金电极浸出的Co2+被阳极电催化氧化为Co3+重新沉积在CoPi阳极上,进而使电解液中的Co2+的浓度始终稳定保持在较低水平,这极大地降低了金属离子Co2+对R.eutropha的毒害作用.同时,该系统中水分解的过电位及阴极活性氧含量都得以降低.这就使得该生物杂化光合系统具有较高的能量利用效率和良好的生物相容性.用能量转化效率为18%的太阳能电池来驱动该MES系统生产PHB,其能量利用效率可达7.6%.
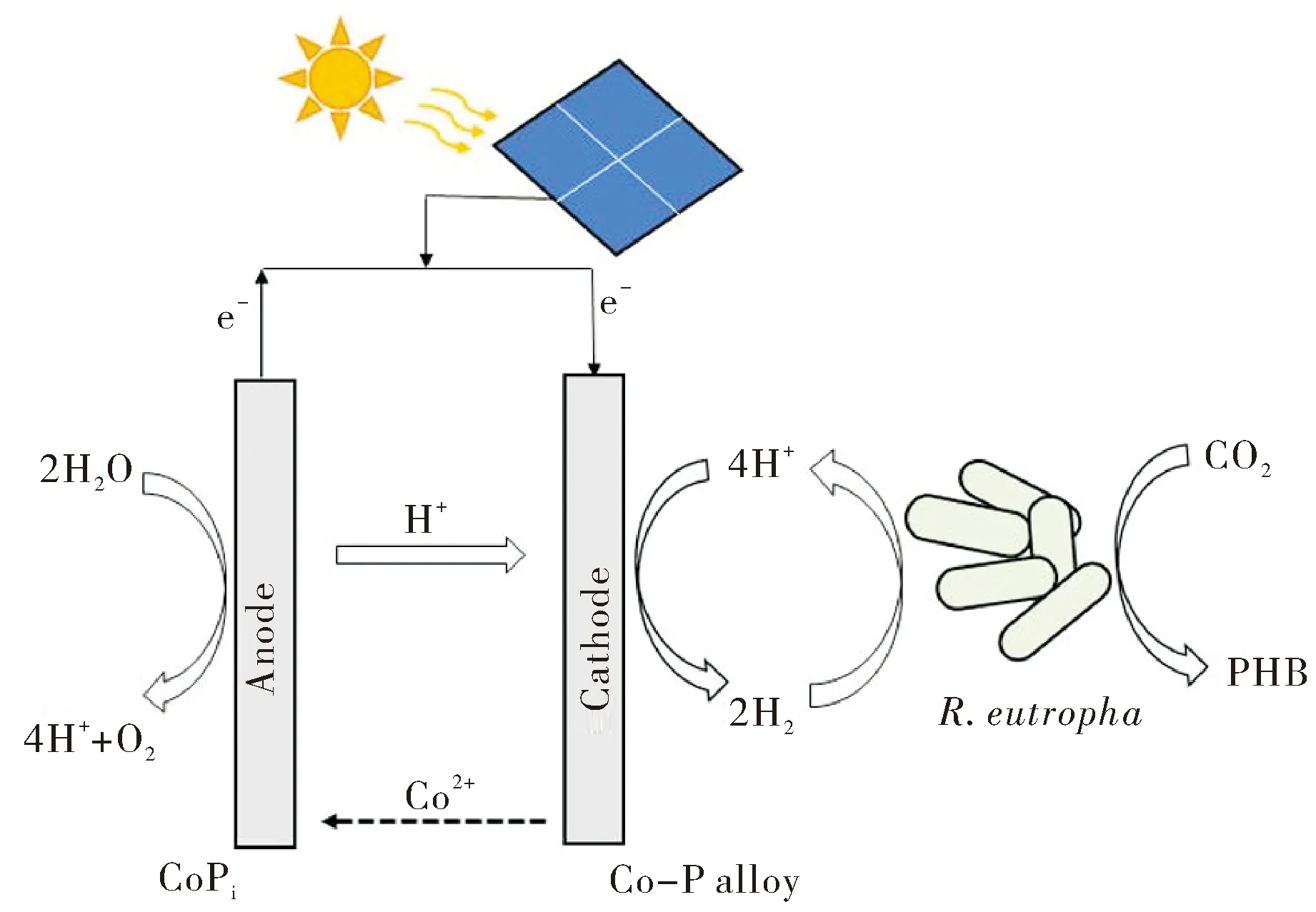
图3 光伏电池驱动微生物电合成PHBFig.3 PHB production by photovoltaic cell-driven microbial electrosynthesis
光伏电池驱动的MES系统中,光吸收装置与微生物电合成反应器被分隔开来,有效避免了光吸收系统与微生物细胞的兼容性问题.
2.2 微生物光电化学池驱动的微生物电合成
将光催化材料引入微生物电化学系统,构建微生物光电化学池用于驱动微生物电合成是实现光能到化学能转化的另一种途径.在该系统中,半导体材料吸收光能促进水分解,为阴极反应提供还原当量.微生物光电化学池的结构与光电化学电池相似,均包括光阳极或光阴极又或者两者兼而有之,区别在于微生物光电化学池含有微生物细胞,并将其作为生物催化剂用于还原CO2合成化合物,而光电化学池则不包含微生物,主要用于产氢储能[46-50].
利用微生物光电化学池驱动微生物电合成生产化合物是一个全新的领域,Liu等[51]首次构建了一个串联微生物光电化学池用以生产PHB(图4).在该系统中,光阳极材料为二氧化钛纳米线,光阴极材料为硅纳米线,中间由离子交换膜隔开,阴阳两极共同构成了一个光吸收单元.阴极和光阳极均置于光照条件下,具有高比表面积的硅纳米线阵列吸收光能为厌氧菌Sporomusaovata提供还原当量生产乙酸,由此产生的乙酸随后被经过基因改造的大肠杆菌Escherichiacoli利用来生产PHB.值得注意的一点是,光电极纳米阵列的存在为厌氧菌S.ovata创造了一个局部厌氧环境,使得S.ovata在有氧条件下仍然能够正常生长并继续还原CO2,这一点对于该系统的推广和应用具有重要意义.同时,通过调整大肠杆菌基因改造方案,该系统还可以用来生产更多种类的化学品.实验结果证明该系统具有低于200 mV较低的过电势、高达90%的法拉第效率,长达200 h的稳定性,产物PHB的目标分子产率高达52%.
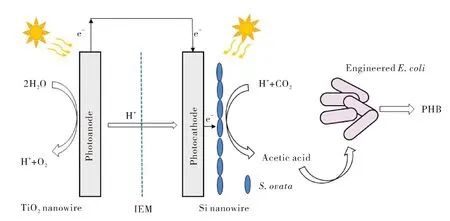
图4 微生物光电化学池驱动微生物电合成PHBFig.4 PHB production by microbial electrosynthesis driven by microbial photoelectrochemical cell
一方面,微生物光电化学池驱动的微生物电合成在没有外加电源的条件下利用光能还原CO2生产化学品,降低了电能输入,具有极高的能源效益,为微生物电合成PHB提供了一条新的途径.而通过外加电压,则可以进一步提高光电极光生电子和空穴的分离效率,提高该系统光电催化活性[52-53].同时,应将外加电压控制在适当范围内,因为电势过高会破坏微生物的细胞膜,对其产生不利影响[54];电势过低则会导致电子在电极与微生物之间传递缓慢,从而降低化学品生产速率和产量[55].另一方面,利用微生物光电化学池生产化合物还处在研究初期,仍然存在生产力及光能到化学能转化效率较低等问题,如何提高该系统中的光电转化效率以及如何降低系统优化对系统内部微生物带来的不利影响是科学家仍需进一步探究的课题.
3 总结与展望
生物杂化光合体系提供了一个清洁、可持续、经济高效的化学合成平台.将该体系应用于化学品的合成是近几年才逐渐发展起来的一项新兴技术,目前有关利用生物杂化光合体系生产PHB的研究并不多.文中提到的光催化剂协同微生物杂化光合体系和MES体系实现了生物杂化光合体系生产PHB的初步探索,但要达到实际应用仍面临着诸多挑战.
首先,材料与生物间的能量和电荷转移问题制约了生物杂化光合体系的进一步发展.材料与微生物间的电子传递机制主要有直接电子传递和间接电子传递两种.直接电子传递即微生物直接从材料表面获得电子,间接电子传递则通过电子载体将电子传递给微生物细胞[56].电子载体通常是小的氧化还原介质,如H2、甲酸、NH3及Fe2+等[57].光催化剂协同微生物杂化光合体系以直接电子传递为主.Kornienko等[58]利用光谱分析法揭示了Moorellathermoacetica-CdS生物杂化光合体系生产乙酸过程中的两种电子转移途径.第一种电子转移途径中,CdS受光激发产生的光电子先被膜结合的产氢酶吸收用于H2的生成,H2随后被氧化为细胞代谢提供还原当量;第二种转移途径中,光电子直接通过电子转运蛋白进入胞内参与相关酶促还原反应.鉴于电子传递涉及反应众多,过程繁杂,包括R.palustris和R.eutropha在内的许多微生物与光催化剂间的电子转移机制仍未知,需要科研人员继续探索.MES系统中电极材料与微生物间的电子传递机制包括直接和间接电子传递两种.电极与细胞间的直接电子传递一般需要膜结合的氧化还原蛋白的参与.目前,关于其电子传递机制的报道以对硫还原地杆菌Geobactersulfurreducens和奥奈达希瓦氏菌ShewanellaoneidensisMR-1的研究最为透彻.G.sulfurreducens和S.oneidensisMR-1均通过细胞膜上的色素蛋白实现双向电子传递.通过对双向电子传递过程中色素蛋白基因表达水平的对比分析,科学家发现电子从G.sulfurreducens到电极和从电极到G.sulfurreducens的传递过程可能是两条完全不同的路径[59].与之相反,对S.oneidensisMR-1的研究则表明,电子从S.oneidensis到电极和从电极到S.oneidensis可能互为逆过程[60].直接电子传递过程中电极与微生物细胞紧密接触,这在一定程度上限制了底物和产物的扩散.同时,电极与细胞间的电子传递效率受限于电极表面积大小,阻碍了其工业化进程.但与间接电子传递相比,直接电子传递过程具有较低的过电势,因而可实现较高的电流效率.包括S.ovata和M.thermoacetica在内的大多数产乙酸菌都能与电极进行直接电子转移,电合成过程电子回收率可达80%[61].而R.eutropha和E.coli等已建立基因组编辑方法且具有更多样代谢途径的细菌只能通过电子媒介间接地从阴极吸收电子,电极与微生物细胞间的电子转移效率较低.针对这一问题,可以通过酶的加入来构造新的电子转移途径,进而提高微生物细胞外电子转移效率,提高目标产物产量.例如,Chen等[62]将甲酸脱氢酶(Formate dehydrogenase,FDH)与中性红(NR)介导的MES系统结合,构建了一种酶辅助的电合成系统.在该系统中,中性红和酶催化产生的甲酸均作为电子载体为细胞提供还原当量,这极大地提高了电极与微生物细胞间的电子传递速度,并且有效降低了微生物电合成系统的过电势,节约了电能.同时,研究微生物与光催化材料或电极间的电子转移机制,也便于科学家通过生物工程技术构建新的更高效的电子转移路径.
另一方面,针对光催化剂光生电子-空穴对复合率高、表面活性位点有限,电极材料金属离子浸出率高,活性氧含量过高等问题,需要对现有催化剂进行优化改性或开发出催化性能更加优良、生物相容性更好的新材料.例如,Li等[63]将Ni纳米颗粒嵌入N掺杂的碳纳米管合成了一种新型电催化剂Ni@N-C,将其用于MES系统作阴极电极材料,可以驱动阴极的析氢反应,进而促进R.eutrophaH16还原CO2生产PHB,改性后的材料具有更好的稳定性和生物相容性.此外,还可以通过调节pH,温度、盐浓度等对系统进行优化.MES系统中,盐可以增强电解质溶液的导电性,降低溶液电阻,从而减少所需能量.最后,可利用合成生物学技术改进微生物本身的性质进而提高生物杂化光合系统的性能和效率、降低生产成本.如,通过对微生物进行基因工程改造引入新的代谢途径,进而实现利用低成本底物合成所需产物[64-65];或者通过调控微生物代谢途径中的基因表达来提高产量[66-67];还可以精简基因组进而改变微生物生长方式,提高细胞生长速率、缩短生产周期等[68].合成生物学技术的快速发展为设计和构建优良PHB生产菌株打下了坚实的基础,为利用生物杂化光合系统提高特定化学品产量、生产更多种类的化学品提供了一条具有良好前景的发展方向.
