胃癌术前外周血NLR、PLR、FIB 与术后发生卵巢转移时间的相关性分析
2021-12-18吴书胜罗会芹陈文菊李梦鸽曹路路何义富
杨 许,吴书胜,闫 滢,罗会芹,陈文菊,李梦鸽,曹路路,何义富,
(1.新乡医学院附属省立医院肿瘤化疗科,河南 新乡 453000;2.中国科学技术大学附属第一医院西区/安徽省肿瘤医院肿瘤内科一病区,安徽 合肥 230000)
胃癌(gastric cancer)是全球第5 位常见癌症,虽然在过去的几十年中,其病死率逐渐下降,但其目前仍是癌症死亡的第4 大原因[1]。胃癌常见转移部位有肝脏、脑、骨、卵巢以及淋巴等,卵巢继发性肿瘤占所有卵巢肿瘤的10%~25%,krukenberg 瘤是卵巢继发性恶性肿瘤,约占卵巢继发性肿瘤的5%~20%[2],其原发灶包括胃、结直肠、乳房等。报道显示[3],约76%的Krukenberg 瘤来自胃,11%来自结肠直肠,4%来自乳房,3%来自阑尾,3%来自胆道系统其余,另外3%来自其他部位。有研究显示[4],治疗前血浆纤维蛋白原水平(FIB)水平会影响胃癌的肝转移;另有研究指出[5],外周血中性粒细胞/淋巴细胞比值(NLR)及血小板与淋巴细胞比值(PLR)可作为胃癌的预后因子。目前暂无文献报道FIB、NLR、PLR 与胃癌术后卵巢转移是否相关。为此,本研究回顾性收集49 例胃癌术后发生卵巢转移患者的临床资料,对其临床病理特征及卵巢转移相关性进行分析,探讨上述指标与患者发生卵巢转移的关系,现报道如下。
1 资料与方法
1.1 一般资料 收集2016 年1 月-2019 年9 月安徽省立医院收治的49 例胃癌术后发生卵巢转移患者的临床病理资料。纳入标准:①均行胃癌手术,包括胃全切术、部分切除术;②术前未行化疗、化疗或放化疗联合治疗;③术后病理证实为胃腺癌;④胃癌手术时无卵巢转移证据;⑤在随后治疗或随诊过程中发现卵巢转移;⑥卵巢转移癌均经术后组织病理学证实;⑦既往或手术时不伴随其他类型肿瘤;⑧无血液系统疾病;⑨术前无感染性疾病;⑩术前1 周内未接受过抗炎治疗;○11 术前1 周内完善血常规及凝血象检查;○12 临床及病理资料完整。排除标准:①手术时发现卵巢转移;②围手术期死亡者;③临床病理数据或随访资料不完整。
1.2 方法 通过查阅患者住院及既往资料、实验室检验及辅助检查结果、手术病理资料、门诊及电话随访资料,记录患者的年龄,月经状态、原发灶的部位,原发灶手术方式,原发灶大小,Lauren 分型,T 分期,N分期,确诊胃癌至发生卵巢转移时间等资料,通过住院、门诊或电话随访所有患者的生存期,记录在格式统一的调查表中。收集患者术前1 周内的血小板计数、中性粒细胞计数、淋巴细胞计数及血浆纤维蛋白原水平。
1.3 NLR、PLR、FIB 计算及其他指标升高临界值的判定 利用安徽省立医院病历检索系统搜索每位患者术前1 周内的血常规及凝血象检查,收集中性粒细胞计数、淋巴细胞计数、血小板计数及纤维蛋白原水平,并计算出NLR、PLR。查阅文献,根据文献报道,将NLR>2.5 定义为升高,PLR>245 定义为升高[6],FIB≥350 mg/dl 定义为升高[6,7,CEA>6.5 ng/ml 定义为升高,CA199>37 ng/ml 定义为升高。
1.4 统计学分析 利用SPSS 21.0 软件对所有临床病理资料进行统计分析。不同临床特征组之间NLR、PLR 及FIB 的比较采用χ2检验,如样本量<40 或理论频数<5 则用Fisher 确切概率法。采用Kaplan-Meier 法计算不同特征组胃癌术后发生卵巢转移的时间差异,利用COX 回归对各个临床病理因素对胃癌患者术后发生卵巢转移的时间进行多因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 临床与病理特征 49 患者胃癌术后均发生卵巢转移,其年龄20~70 岁,中位年龄46 岁,各临床病理特征分布见表1。
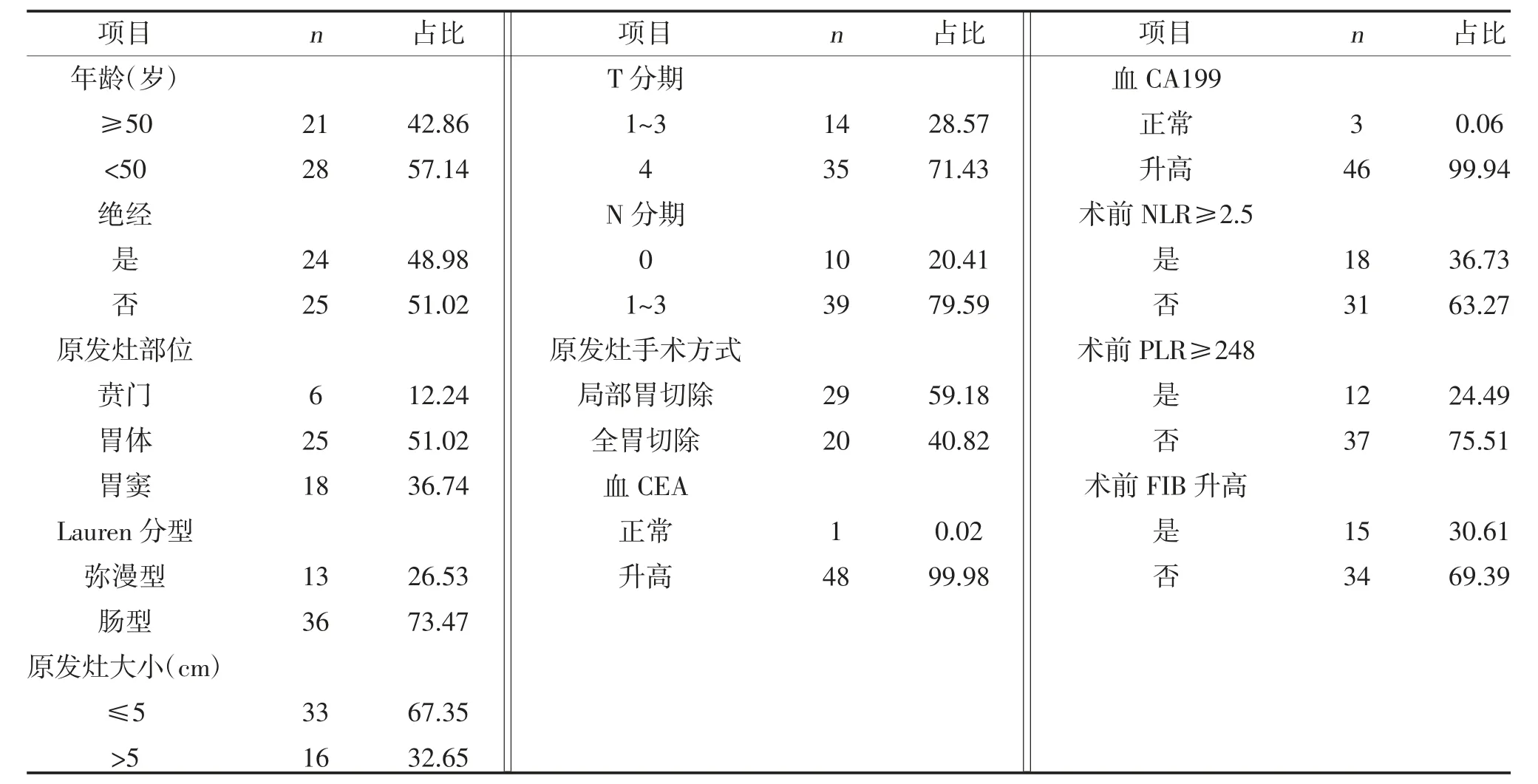
表1 胃癌卵巢转移患者的临床病理特征(n,%)
2.2 术后发生卵巢转移时间与临床特征的关系Kaplan-Meier 分析显示,不同年龄、原发灶部位(贲门、胃体或胃窦)、原发灶大小(≤5 cm 或>5 cm)、T分期(T1~3或T4)、N 分期(N0或N1~3)、原发灶手术方式(部分切或全胃切除)、术前PLR 的中位卵巢转移时间比较,差异无统计学意义(P>0.05);弥漫型胃癌、术前高NLR、术前高FIB 水平的患者手术至卵巢转移时间短于肠型胃癌、术前低NLR、术前低FIB水平的患者,差异有统计学意义(P<0.05),见表2、图1。

图1 FIB、NLR 及Lauren 分型对胃癌手术后发生卵巢转移时间的影响

表2 胃癌卵巢转移时间与临床特征的关系
2.3 胃癌术后发生卵巢转移时间的多因素分析 将原发灶Lauren 分型、术前NLR、术前FIB 与胃癌手术至发生卵巢转移时间进行Cox 多因素分析,结果显示原发灶Lauren 分型及术前NLR 是影响胃癌术后发生卵巢转移时间的独立影响因素,见表3。
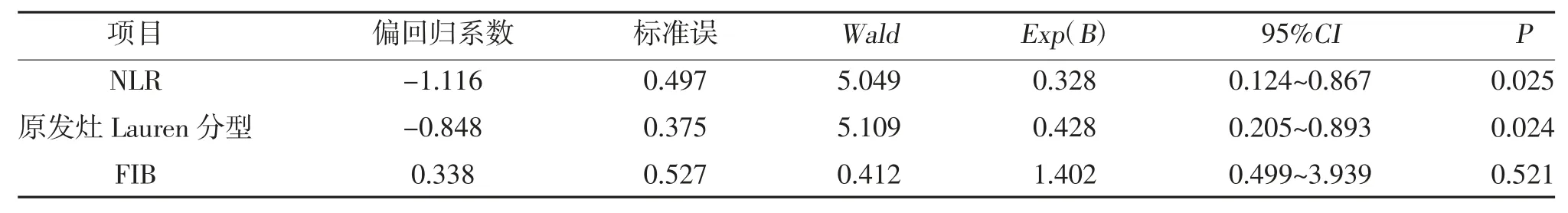
表3 胃癌术后发生卵巢转移时间的多因素分析
3 讨论
胃癌卵巢转移常见的临床症状包括腹胀、腹痛、盆腔坠痛,并可伴有卵巢原发性肿瘤表现以及胃肠道症状,如恶心、呕吐、厌食和非特异性全身表现,如贫血和体重减轻。胃癌卵巢转移确诊时已经处于肿瘤晚期,预后较差,因此早期诊断、治疗对患者的预后有重要指导意义[8]。卵巢转移的胃癌作为一种特殊类型的胃癌,在临床上较常见,但目前对可能预测患者发生卵巢转移风险及转移发生时间的高危因素研究较少。故本研究重点对胃癌患者手术后的临床病理特征进行分析,试图寻找可以预测患者发生卵巢转移的指标。本研究回顾性分析了49 例胃癌术后发生卵巢转移患者的临床特征,分析患者术前1周外周血NLR、PLR、FIB 水平对卵巢转移时间的影响,并结合年龄、月经状态及原发灶Lauren 分型、原发灶大小、原发灶手术方式、T 分期、N 分期及血清CEA、CA199 等临床病理因素,旨在探寻胃癌术后影响卵巢转移时间的临床指标,以期为临床医生提供参考。
本研究显示,术前PLR 与胃癌患者发生卵巢转移的时间无相关性。Zhao G 等[9]研究收集了110 例转移性胃癌患者进行回顾性分析,结果显示高NLR和高PLR 的患者总体生存率低于低NLR 和低PLR的患者,其中高NLR 组患者的中位总生存期为8.37个月,低NLR 组的中位总生存期为17.47 个月;而高PLR 组和低PLR 组的中位总生存期分别为9.60和15.10 个月。该研究还发现,较高的NLR 和PLR被认为是总生存期的不良预后因素,且高NLR 是影响患者总生存率的独立预后因素,而PLR 不是独立预后因素。另有研究显示[10],治疗前PLR 升高与患者总生存率显著相关,与患者发生淋巴结转移及浆膜浸润相关。本次研究结果显示,胃癌手术前外周血PLR 与患者术后发生卵巢转移的时间无相关性,可能是本研究样本量较少,统计存在误差相关。也可能是因为胃癌卵巢转移作为一种特殊类型的存在,与其他转移模式不同,最终导致本研究结果与既往研究存在差异。
Yamashita H 等[11]研究发现,胃癌患者术前纤维蛋白原水平>310 mg/dl 与淋巴结转移显著相关,且高纤维蛋白原血症与淋巴结转移独立相关(OR=2.004,95%CI:1.140~3.521,P=0.0157),进一步分析发现血浆纤维蛋白原水平仅与肠型胃癌淋巴结转移相关。术前高纤维蛋白原血症可能为癌细胞通过淋巴系统转移提供了有利条件,术前血浆纤维蛋白原水平可作为胃癌淋巴转移的预测指标。本次研究结果显示,术前高FIB 的患者术后卵巢中位转移时间更短,提示术前高FIB 与卵巢转移有一定的相关性。胃癌发生卵巢转移大致分为3 种途径:血行转移、种植转移、淋巴转移。纤维蛋白原是一种具有多种整合素或非整合素结合基序的二聚体分子,恶性肿瘤细胞通常高水平表达纤维蛋白原受体,纤维蛋白原与内皮细胞上的受体结合,会促进肿瘤细胞与靶器官内皮细胞的稳定粘附,肿瘤细胞和血小板可以通过与纤维蛋白原结合形成大的聚集体。这些聚集体有效地在靶器官中形成微栓子,可以保护肿瘤细胞免受天然免疫系统的侵害,因此认为胃癌患者高FIB水平会促进癌细胞转移至卵巢,但此假设仍需进一步实验研究证实。另外,胃癌术后Lauren 分型可决定其侵袭程度,弥漫型胃癌侵袭能力更强[12],也更容易发生远处器官转移。本次研究结果均提示弥漫型胃癌患者可在更短的时间内发生卵巢转移癌,而肠型胃癌发生卵巢转移的时间较晚。
Williams KA 等[13]研究发现,高NLR(>3.6)组的卵巢肿瘤分期较晚、分级更差且与双侧卵巢癌相关,该研究发现高NLR 预示着较差的生存率。另有研究表明[14],治疗(化疗及放疗)前的高NLR 与PLR 胃癌患者预后明显差于低NLR 与PLR 的胃癌患者。上述两项研究均表明治疗前NLR 升高的恶性肿瘤侵袭性更强,患者预后更差。本研究发现,胃癌术前高NLR 相较于低NLR 发生卵巢转移的时间更短,提示胃癌术前高NLR 的肿瘤侵袭性强,容易发生早期转移。但是其具体作用机制仍不明确,可能与炎症因素相关。肿瘤细胞产生与癌症相关的炎症介质,如肿瘤坏死因子-α(TNF-α)、白细胞介素-3(IL-3)和白细胞介素-6(IL-6),这些炎症介质可能导致相对的中性粒细胞增多、淋巴细胞减少。在NLR 高的患者中,肿瘤生长可能受到中性粒细胞衍生的细胞因子(如血管内皮生长因子、白细胞介素-18 和基质金属蛋白酶)影响。此外,肿瘤周围中性粒细胞数量的增加可能会抑制自然杀伤细胞和活化的T 细胞的抗肿瘤免疫反应。同时,淋巴细胞数量的减少可能会削弱淋巴细胞介导的抗肿瘤细胞免疫反应[15]。因此,中性粒细胞增加和淋巴细胞减少的共同作用可能导致高NLR,从而促进血管生成和抑制抗肿瘤反应性。中性粒细胞可以抑制免疫效应细胞(如自然杀伤细胞和淋巴细胞)的活性,从而抑制免疫系统[16];同时中性粒细胞可以通过产生血管内皮生长因子和基质金属蛋白酶-9 来促进肿瘤的形成和发展。淋巴细胞主要有T 淋巴细胞、B 淋巴细胞、NK 细胞等。在肿瘤微环境中浸润的淋巴细胞称为肿瘤浸润淋巴细胞(TIL),在浸润的炎症细胞中,TIL 是宿主对肿瘤细胞产生免疫应答的主要决定因素。TIL 浸润的程度被认为与控制肿瘤的生长、进展和转移有关。因此,中性粒细胞的增加、淋巴细胞的减少可导致NLR 升高,而高NLR 又促进了肿瘤的侵袭和转移,导致胃癌转移至卵巢的时间缩短。
本研究的不足之处:本研究为回顾性研究,且样本量较小,能否将研究结果推广至胃癌卵巢转移患者的总体仍需进一步验证。另外,本研究截止随访结束仍有一部分患者存活,因此未对总生存时间进行分析。同时,本研究并未设置同期胃癌手术未发生卵巢转移的患者作为对照组进行研究。
综上所述,弥漫型胃癌、术前外周血高FIB、高NLR 的患者发生卵巢转移的时间可能更短,且胃癌术后Lauren 分型、术前NLR 可能是影响胃癌术后发生卵巢转移时间的独立影响因素。
