重组大肠杆菌发酵合成广藿香醇
2021-12-17王禹锡程萍李若萱王沁周哲敏周丽
王禹锡,程萍,李若萱,王沁,周哲敏,周丽
(江南大学 生物工程学院,江苏 无锡,214122)
广藿香醇是一种天然的三环倍半萜化合物,是广藿香油的主要成分[1]。广藿香油在日化品领域应用广泛,可用于香水、精油的制作[2],也常被用于食品、药品的分析[3]。广藿香醇具有抗菌消炎止痛的作用,在治疗抑郁症方面也有一定功效,具有潜在的药用价值[4-6]。随着消费意识的提升,人们对广藿香醇的需求量逐年递增[7-8]。
目前有3类方法可以合成广藿香醇,即植物提取法、化学合成法和微生物发酵合成法。其中,植物提取法是目前生产广藿香醇的主要方法,然而此种方法需要大量广藿香植株作为原料,占用农用耕地;广藿香醇的产量和品质受地理位置、气候环境和植株品质影响较大;另外,提取广藿香醇的过程耗能巨大,不利于环保[8]。化学合成法虽可以合成纯度较高的广藿香醇,但是步骤繁多,操作复杂,合成成本高,产率却很低[9],无法应用于大规模的工业生产。
利用微生物发酵合成广藿香醇,具有成本低、利于保护环境和创造经济效益等优势。目前多数采用酿酒酵母或者谷氨酸棒杆菌作为宿主菌[8-10]。但截止目前,所有发酵法合成广藿香醇的研究仍处于实验室探索阶段,其产量均无法达到工业化生产的要求。酵母菌内含有麦角固醇和类胡萝卜素合成代谢途径,竞争利用广藿香醇前体物质法尼基焦磷酸(farnesyl pyrophosphate,FPP),对广藿香醇产量和纯度不利。而大肠杆菌中没有此类代谢途径[2,11-12],同时,大肠杆菌遗传背景清晰,基因操作简便,营养需求简单,生长迅速,可通过分批补料方式实现高密度发酵[13],已广泛应用于工业发酵生产中,有望最大化地实现广藿香醇发酵合成。AGUILAR等[2]将甲羟戊酸途径和广藿香醇合酶(patchoulol synthase,PTS)在大肠杆菌中进行表达,并优化发酵条件和产物提取条件,首次报道了大肠杆菌广藿香醇发酵合成。然而,他们没有对PTS或者广藿香醇合成代谢途径进行深入改造,相关研究将对解析广藿香醇合成机制以及促进广藿香醇的大规模应用具有重要意义。
PTS的表达水平和催化能力是影响广藿香醇合成的重要因素。然而,PTS在大肠杆菌内可溶性表达量很低[14],严重影响广藿香醇的发酵合成。添加可以增强蛋白溶解性的多肽标签是提高外源蛋白在大肠杆菌中表达水平的一种策略[15],然而目前尚无利用相关策略提高广藿香醇发酵合成的报道。同时,目前仍没有PTS的晶体结构,因此其催化机制并非完全清晰。根据其他倍半萜合酶的晶体结构推测,PTS的活性中心主要由DDXXD和NSE/DTE基序组成。DDXXD基序与Mg2+结合,协助底物形成正确取向;NSE/DTE基序位于DDXXD基序对面,结合另一Mg2+,影响PTS的底物谱[14,16]。截止目前,仍未有对PTS分子改造获得催化能力增强的突变酶。
本研究采用大肠杆菌作为宿主菌合成广藿香醇,在PTS2上添加5种促溶标签,筛选到1种可以增强PTS2可溶表达且增加广藿香醇产量的标签。对广藿香醇合酶PTS2进行了同源比对和序列分析,分子改造获得突变株,确定了影响酶活力的关键位点。通过对FPP供体代谢途径进行改造,增强了广藿香醇合成过程中的底物供应。将筛选获得的最优标签与改造后的底物供体途径组合,获得1株最优的重组菌。本结果为以大肠杆菌为宿主合成广藿香醇提供了一定参考。
1 材料与方法
1.1 菌株、质粒与引物
菌株E.coliBL21(DE3)、E.coliDH5α为本实验室保藏菌株。质粒pBbA5c-MevT(CO)-MBIS(CO,ispA)[17](本文简写为pMev),Addgene;pET28a-PTS2质粒为本实验室前期构建。本实验中所用引物如表1所示。

表1 本研究所用引物Table 1 Primers used in this study

续表1
1.2 主要试剂与培养基
Prime Star Max DNA聚合酶、ExTaqDNA聚合酶、In-Fusion组装试剂盒、DNA Marker、Protein Marker(Broad),宝生物工程(大连)公司;质粒小提试剂盒、纯化试剂盒、卡那霉素、氯霉素,生工生物工程(上海)股份有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、十二烷,上海阿拉丁生化科技股份有限公司。
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。
M9培养基(g/L):Na2HPO46,KH2PO43,NaCl 0.3,NH4Cl 1,葡萄糖 5,MgSO42.0 mmol/L,微量元素液0.1%(体积分数)。
微量元素(g/L):MnSO4·4H2O 0.5,FeSO4·7H2O 10,CaCl22,(NH4)Mo7O240.1,CuSO4·5H2O 3,Na2B4O7·10H2O 0.2,ZnSO4·7H2O 5.25,溶于0.1 mol/L HCl溶液。
根据需要,向培养基中添加卡那霉素至终质量浓度为50 mg/L、氯霉素至终质量浓度为37 mg/L。
1.3 仪器与设备
PCR仪、凝胶成像仪、蛋白电泳仪,BIO RAD公司;UV 1800 PC型紫外可见分光光度计,上海美普达有限公司;pH计,梅特勒-托利多仪器(上海)有限公司;生物传感分析仪,深圳市西尔曼科技有限公司;气相色谱质谱联用仪,日立(HITACHI)公司。
1.4 重组质粒的构建
1.4.1 融合标签改造重组质粒的构建
以pET28a-PTS2质粒为模板,使用表1中所列T7AF+T7AR等引物,全质粒PCR,产物转化至E.coliDH5α感受态细胞中,挑选阳性转化子进行测序验证,得到重组质粒pET28a-PTS2/T7A、pET28a-PTS2/T7A2、pET28a-PTS2/T7A3、pET28a-PTS2/NT11、pET-28a-PTS2/SKIK。
1.4.2 广藿香醇合酶分子改造重组质粒的构建
以pET28a-PTS2质粒为模板,以I438VF和I438VR为上下游引物全质粒PCR扩增,构建重组质粒pET-PTS2/I438V(简写为I438V)。分别以pET-28a-PTS2质粒为模板,用表1所示相应上下游引物进行全质粒PCR扩增,构建突变体质粒,重组质粒分别简写为K28R、K57R、K91R、K102R、K131R、K136R、K191R、K226R、K230R、K333R、K343R、K358R、K389R、K391R、K395R、K399R、K425R、K475R、K478R。
1.4.3 FPP合成途径的改造重组质粒的构建
以本实验室保藏的pT7P-T7T质粒为模板,使用表1中引物T7TF和T7PR,PCR扩增T7 terminator-T7 promoter片段;以pMev质粒为模板,用引物T7T-tHMGRR和T7P-MKF,PCR扩增质粒骨架,将两片段使用In-Fusion试剂盒组装连接,构建重组质粒pMev-T7M2。以pMev-T7M2质粒为模板,用T7T-pBbA5CR和T7P-atoBF引物,PCR扩增质粒骨架,与已获得的T7 terminator-T7 promoter基因片段In-Fusion组装连接,构建重组质粒pMev-T7M1M2。
1.5 重组菌株发酵合成广藿香醇方法
将pMev质粒化学转化入E.coliBL21(DE3)感受态中,涂布于氯霉素抗性的平板,筛选出阳性转化子,挑取单菌落转接至摇瓶中,培养至OD6000.3~0.4,收集菌体,1 800 V、0.5 ms电击转化pET28a-PTS2质粒。将菌液涂布于卡那霉素和氯霉素双抗性的平板,挑取阳性转化菌株,获得供发酵验证的重组菌株E.coliBL21(DE3)/pMev+pET28a-PTS2。
含有双质粒的菌株在含有卡那霉素和氯霉素的平板上划线活化,挑取单菌落接种于50 mL LB培养基中,培养10~12 h。种子液以4%(体积分数)接种量转接到50 mL M9培养基中,37 ℃、200 r/min培养至OD600为2,补加质量浓度为500 g/L葡萄糖溶液3 mL、十二烷10 mL,并补加IPTG至终浓度为0.5 mmol/L,在20 ℃、200 r/min继续培养至96 h,其间每12 h检测一次发酵液残糖含量,并补加葡萄糖,维持糖质量浓度大于10 g/L,并用氨水调节发酵液pH至7.0左右。
1.6 广藿香醇的检测方法
离心收集发酵液上层十二烷,用乙酸乙酯适度稀释,并用无水Na2SO4除水,使用气相色谱质谱联用仪检测。
色谱分离条件:初始柱温为50 ℃,恒温1 min;以10 ℃/min的升温速度升至200 ℃;再以20 ℃/min的升温速度升至280 ℃,恒温持续3 min。
质谱条件:选择扫描m/z为35~300的离子,进样口温度为280 ℃,流速为1.2 mL/min,离子源温度为280 ℃,电离模式为电子电离(60 eV),选择分流进样模式,分流比为4.2,进样量为1 μL,用选择性反应监测进行定量分析。定量母离子m/z为138.2,子离子m/z分别为110.1、95.1和123.1,碰撞能量分别为8、14和10。
2 结果与分析
2.1 广藿香醇合酶可溶性表达改造
PTS2在大肠杆菌内可溶性表达很低[14],严重限制了广藿香醇的产量。添加可以增强蛋白溶解性的多肽标签是提高外源蛋白在大肠杆菌中表达水平的一种策略[15]。在此,我们利用5种短的融合标签(图1-a)来提高PTS2的可溶性表达和广藿香醇的产量。
虽然有研究表明NT11和SKIK标签能够有效地促进难以表达的蛋白质在大肠杆菌中表达[18-19],本研究在PTS2的N端添加这2种标签都未能进一步提高广藿香醇的合成量(图1-b)。而在C端添加T7A、T7A1、T7A3标签,明显减少了PTS2包涵体的形成(图1-c),并在一定程度上提高了PTS2的可溶性表达。同时,T7A-T7A3标签的酸性越强,PTS2的可溶性表达量越高。然而,广藿香醇的产量随着标签的酸性增强而逐渐减少(图1-b),这表明过多的负电荷会降低PTS2的催化活性。与原始PTS2相比,将T7A标签融合到PTS2上,可有效地将广藿香醇合成量提高39.74%。

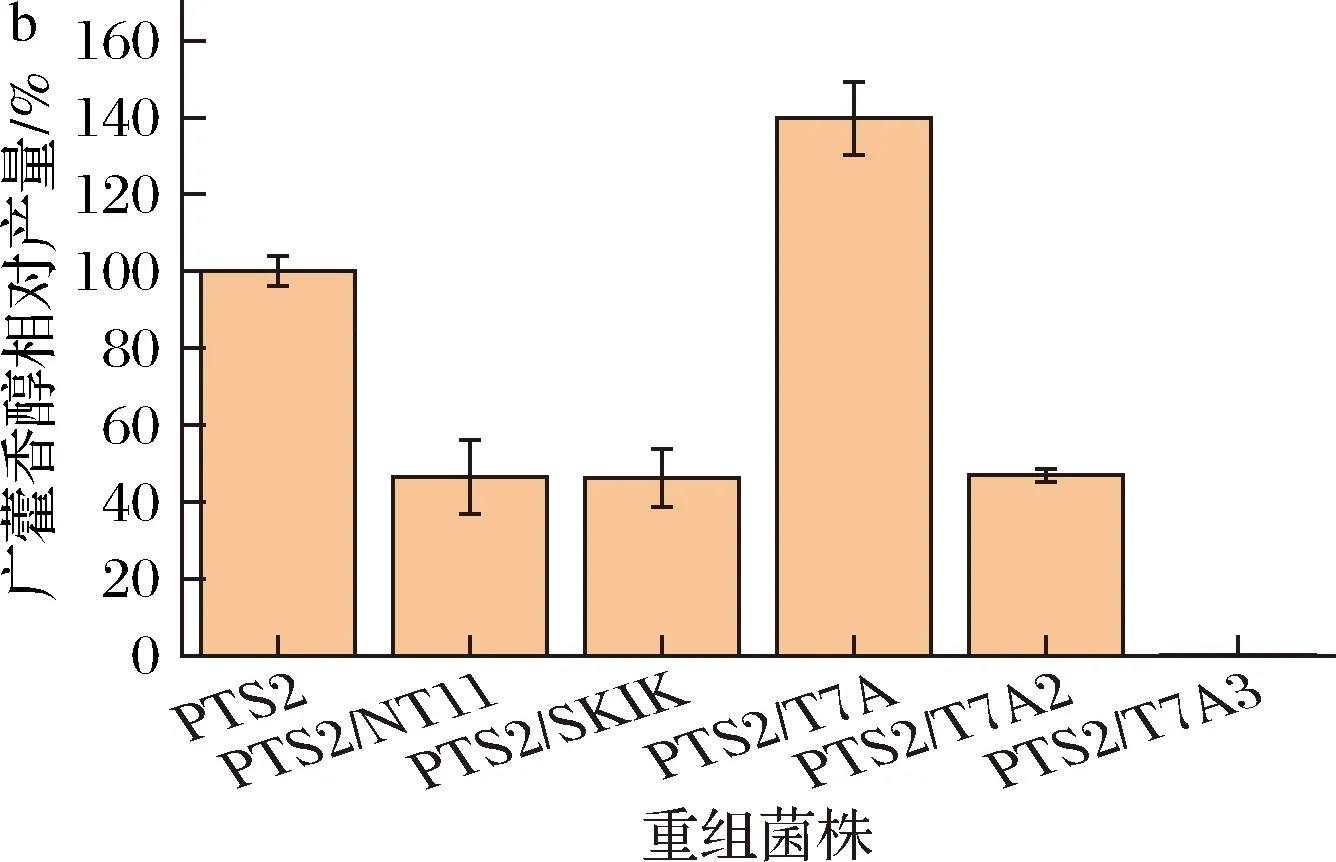

a-不同标签融合策略;b-融合不同标签对广藿香醇合成的影响;c-广藿香醇合酶融合T7A-T73标签SDS-PAGE图谱M-标准蛋白质Marker;S-细胞破碎上清液;P-细胞破碎沉淀图1 融合标签对广藿香醇合成的影响Fig.1 The effects of fusion tags on patchoulol synthesis
目前研究中,仅HARTWIG等[14]利用长多肽融合标签将PTS在大肠杆菌中的可溶性表达提高了40%,然而长多肽标签往往干扰目的蛋白的功能,需要在表达后切除。本研究表明,仅有22个氨基酸的短肽T7A标签也能有效提高PTS2的可溶性表达以及广藿香醇发酵合成产量。同时,将T7A标签融合到PTS2的C端,便于在N端进一步融合其他促溶蛋白质。该结果为提高PTS可溶表达以及进一步组合多种改造策略提高广藿香醇发酵合成水平提供了借鉴。
2.2 广藿香醇合酶分子改造
2.2.1 基于序列同源性分析的分子改造
目前尚无PTS晶体结构的报道,其催化机制尚不清晰,因此通过理性设计对PTS进行分子改造较为困难,导致关于PTS分子改造也很少有文献报道,尚未获得催化活性增强的突变体。然而,具有不同催化活性的PTS自然变异体,可为其分子改造提供素材。例如,广藿香醇合酶PTS1与PTS2分别来源于广藿香(Pogostemoncablin)的不同植株,它们的氨基酸序列相似性为96.2%。本课题组前期研究结果显示PTS2合成广藿香醇的能力要明显高于PTS1。



a-氨基酸序列同源比对结果;b-PTS2三维结构;c-PTS2突变体菌株的广藿香醇产量图2 I438V和E457A氨基酸突变对广藿香醇合成的影响Fig.2 The effects of amino acid mutations of I438V and E457A on patchoulol synthesis
利用BLAST软件搜索与PTS2氨基酸序列相似性高的酶,与PTS1、PTS2氨基酸序列进行比对(图2-a)。并用SWISS-MODEL在线服务器(https://swissmodel.expasy.org/),以黄花蒿(Artemisiaannua)来源的倍半萜合酶晶体结构为模板(PDB:4fjq.1),对PTS2进行分子建模(图2-b,广藿香醇合酶PTS2与A.annua来源的倍半萜合成酶氨基酸序列同源性达到43.12%,表明模拟的模型可信度较高)。分析活性中心附近、氨基酸序列不一致的位点。其中,438位的异亮氨酸(Ile,I)在其他倍半萜合酶对应位置均为缬氨酸(Val,V),因此构建相应I438V突变体,验证其对广藿香醇合成的作用。此外,据推测457位的谷氨酸(Glu,E)可能参与结合Mg2+,Mg2+是辅助结合底物FPP的金属阳离子,是影响催化活性的关键位点,而在有些倍半萜合酶中该位点突变为不带电荷的甘氨酸(Gly,G),将会影响Mg2+的结合能力,因此将其突变为丙氨酸(Ala,A)进行验证。
发酵结果如图2-c所示,I438V突变导致重组菌E.coliBL21(DE3)/pMev+I438V广藿香醇产量降低为原始菌的38.72%。Ile和Val都为非极性氨基酸,但Val的侧链更短,表明Ile的长侧链有利于PTS2的酶活性。另一方面,457位Glu残基突变为Ala导致广藿香醇产量显著降低,表明457位点Glu参与结合Mg2+,突变为不带电荷的Ala,影响了与Mg2+的结合。因此,I438对PTS2活性有一定影响,而E457是其关键氨基酸位点。
2.2.2 基于表面赖氨酸残基替换的分子改造
本实验室前期研究中发现将酶分子表面的赖氨酸(Lys,K)残基替换为精氨酸(Arg,R),可以有效提高酶的热稳定性和酶活力[20-22]。本研究利用该策略对PTS2进行分子改造。将PTS的三维模型提交于GETAREA在线服务器(http://curie.utmb.edu/getarea.html),筛选到19个表面暴露比率大于50%的Lys残基,结果如表2和图3-a所示。将这些位点突变为Arg,重组菌株发酵结果如图3-b所示。

表2 PTS2表面赖氨酸残基预测Table 2 Prediction of surface lysine residue
所有表面Lys突变为Arg的突变体导致了广藿香醇产量不同程度下降,其中28、136、343位突变导致广藿香醇几乎不能合成。Lys和Arg同为碱性氨基酸,但Arg的侧链基团要大于Lys,氨基酸替换后的空间位阻改变可能是导致酶活下降的主要原因。28、136、343这3个PTS表面氨基酸位点虽然并不靠近活性中心,也不参与Mg2+的结合,却对PTS的催化活性有重要作用,后续实验可对这3个位点进行更深入的研究。上述结果为深入解析PTS催化机制奠定了基础。


a-广藿香醇合酶PTS2表面赖氨酸残基位置;b-PTS2突变体菌株的广藿香醇产量图3 广藿香醇合酶表面赖氨酸突变为精氨酸对广藿香醇合成的影响Fig.3 The effects of mutating surface lysine of PTS2 into arginine on patchoulol synthesis
2.3 FPP合成代谢途径的改造
大肠杆菌自身具有广藿香醇前体化合物——FPP的合成代谢途径,但该途径效率低。FRANCISCO等[2]通过引入pMev质粒,在大肠杆菌中过量表达甲羟戊酸代谢途径,提高了广藿香醇产量,表明该途径对广藿香醇发酵合成有重要作用。但他们并未对pMev质粒上的基因表达进行优化,相关研究将有利于进一步提高广藿香醇合成水平。
pMev质粒含有从乙酰-CoA合成FPP代谢途径的8个基因,以lacUV5启动子启动转录。单启动子后串联的编码基因较多,排序在后的基因可能表达效果较差,因此将pMev质粒上携带的8个基因划分为2个模块,增强其表达。前3个基因atoB、HMGS、tHMGR编码的酶将乙酰-CoA催化合成甲羟戊酸,将其划分为第一模块(简写为M1);MK、PMK、PMD编码的酶又将甲羟戊酸催化生产异戊二烯焦磷酸(isopentenylpyrophosphate,IPP),IDI将IPP异构化为二甲基烯丙基焦磷酸,1分子IPP和2分子二甲烯丙基二磷酸(dimethylallylpyrophosphate,DMAPP)在ISPA的催化下缩合形成FPP。将MK、PMK、PMD、idi和ispA划分为第二模块(简写为M2)。在模块1和模块2之间插入T7终止子和PT7启动子,用来终止模块1的转录,并增强模块2的表达,构建重组质粒pMev-T7M2(图4-a)。用引物YtHMGRF和YMKR 进行PCR验证,琼脂糖凝胶电泳验证图谱如图4-b所示,原始质粒应获得152 bp条带,整合后应为303 bp,表明成功获得了pMev-T7M2重组质粒。进一步,将pMev-T7M2质粒上模块1的启动子替换为T7强启动子,构建重组质粒pMev-T7M1M2(图4-a),用YpBbA5CF和YatoBR引物进行PCR验证,电泳验证图谱如图4-c所示,原始质粒应获得240 bp条带,整合后应为340 bp,表明成功获得了pMev-T7M1M2重组质粒。

a-插入强启动子策略;b-pMev-T7M2重组质粒PCR验证电泳图谱;c-pMev-T7M1M2重组质粒PCR验证电泳图谱M-DNA Marker;1-对照;2-模块2启动子替换;3-对照;4-模块1启动子替换图4 法尼基焦磷酸合成途径改造Fig.4 The modification of farnesyl pyrophosphate synthetic pathway
重组菌株E.coliBL21(DE3)/pMev-T7M2+pET28a-PTS2和E.coliBL21(DE3)/pMev-T7M1-T7M2+pET28a-PTS2广藿香醇发酵结果如图5所示,表明加强两个模块均使广藿香醇产量有不同程度的提高。两模块都使用T7启动子加强表达后,广藿香醇产量比出发菌株提高了55.95%,产量提升效果相较于单模块增强的重组菌株更为显著。说明增强FPP合成代谢途径相关基因的表达,以增加底物的供给,可有效促进广藿香醇发酵合成。该结果对发酵合成其他倍半萜化合物也有一定的借鉴意义。

图5 法尼基焦磷酸代谢途径改造对广藿香醇合成的影响Fig.5 The effects of improving synthetic pathway of farnesyl diphosphate on patchoulol synthesis
2.4 组合策略提高广藿香醇发酵合成
将筛选到的有效提高PTS2可溶性表达且能够增加广藿香醇产量的质粒pET28a-PTS2T7A与最优的FPP供体质粒pMev-T7M1-T7M2转化至E.coliBL21(DE3)中,发酵验证组合两种策略的最优结果对广藿香醇合成的作用。结果如图6所示,重组菌株E.coliBL21(DE3)/pMev-T7M1M2+pET28a-PTS2/T7A产量比出发菌株提升了72.22%,达到24.1 mg/L,表明两种策略的有益结果成功实现了叠加。该结果为组合多种策略提高倍半萜化合物在大肠杆菌中的发酵合成提供了借鉴。

图6 最优改造策略组合对广藿香醇合成的影响Fig.6 The effects of combining optimal strategies on patchoulol synthesis
3 结论
本研究在大肠杆菌中对PTS和合成FPP的外源代谢途径进行了改造。对广藿香醇合酶PTS2添加T7A促溶标签,可增强其可溶性表达,使广藿香醇产量提升39.74%。对构成PTS的氨基酸突变,发现28位、136位、343位的赖氨酸和457位的谷氨酸是影响酶活力的重要位点,为深入揭示PTS的催化机制提供了借鉴。对PTS的底物合成途径进行强化,使广藿香醇产量提升55.95%。进一步叠加促溶标签改造策略与底物合成途径强化策略,所获得的重组菌株比优化前的菌株产量提升72.22%。本研究相关改造策略对提高PTS催化能力、优化倍半萜化合物合成代谢途径和进一步提高广藿香醇产量提供了借鉴。
