镉诱导大鼠肝脏氧化损伤模型的建立
2021-12-17高温婷王金荣唐桂芬苏兰利乔汉桢张亚坤李林儒
高温婷,王金荣*,唐桂芬,苏兰利,乔汉桢,张亚坤,李林儒
(1.河南工业大学生物工程学院,河南郑州 450001;2.河南牧业经济学院动物科技学院,河南郑州 450011)
氧化应激是指动物机体在遭受各种有害刺激时,体内的氧化和抗氧化系统失衡,体内产生过量的高活性分子如活性氧(ROS)和活性氮(RNS),导致细胞和组织的氧化性损伤[1]。在现代化养殖生产中,饲养环境、饲喂方式、饲粮构成等都会导致畜禽机体氧化应激。由氧化应激引起的氧化损伤可直接导致畜禽机体免疫力低下、慢性炎症等疾病,降低生产性能,影响畜产品品质[2]。肝脏作为畜禽体内的主要代谢器官,且肝细胞内多达上千个线粒体,极易受到 ROS 攻击和产生氧化应激[3]。因此,建立肝脏氧化损伤模型对揭示动物氧化应激发生及预防的机制具有重要意义,为开发新型抗氧化功能性饲料,预防肝脏氧化损伤奠定基础。
镉是自然界中广泛存在的有毒重金属,其半衰期长,不易降解,国际癌症研究机构(IARC)在1993 年将其列为I 级致癌物[4]。镉对人和动物的几乎所有器官产生毒性,急性或慢性接触镉会导致肝、肾功能衰竭,骨骼坏死、睾丸萎缩等器官病变,甚至引发癌症和死亡,其中肝脏是镉主要的蓄积部位和靶器官[5]。镉能诱导ROS 产生以及降低抗氧化酶清除自由基的能力,导致组织氧化性损伤[6]。基于此,可以采用镉损伤方式建立动物氧化应激模型以用于动物抗氧化研究。Nemmiche 等[7]利用2 mg/kg 氯化镉(CdCl2)溶液皮下注射Wistar 大鼠10 d,发现肝脏指数显著上升,肝组织超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性显著下降,脂质过氧化产物丙二醛(MDA)水平显著上升。Bhattacharjee 等[8]采用3 mg/kg 的CdCl2溶液皮下注射Wistar 大鼠7 d,大鼠心脏组织形态改变,MDA 含量显著增加,出现氧化损伤。李晔等[9]用5 mg/kg CdCl2溶液连续腹腔注射5 d,大鼠体增重和胸腺指数显著下降,肝细胞部分肿胀、炎症细胞浸润。赵英政等[10]利用0.8 mg/kg CdCl2连续腹腔注射7 d 成功建立SD 大鼠肝脏氧化损伤模型。目前采用CdCl2构建动物肝脏损伤氧化模型的浓度、给药时间及损伤指标等方面的研究不尽相同,因此,本研究拟在国内外镉损伤模型建立研究的基础上,通过腹腔注射不同浓度的CdCl2溶液,构建大鼠肝脏氧化损伤模型,为揭示氧化应激机制和开发新型抗氧化饲料添加剂提供参考。
1 材料与方法
1.1 主要试剂与仪器 氯化镉(CdCl2·2.5H2O),分析纯,购自天津市科密欧化学试剂有限公司;蛋白定量(BCA)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、谷草转氨酶(AST)、谷丙转氨酶(ALT)检测试剂盒均购自南京建成生物工程研究所(生产批号依次为:20191225、20191129、20191128、20191127、20200620、20200618)。
高速冷冻离心机(ST16R)购自赛默飞世尔科技(中国)有限公司;正置倒置一体荧光显微镜(RVL-100-G)购自美国Echo 公司;多功能酶标仪(Spark10M)购自瑞士帝肯公司。
1.2 试验动物及饲养管理 试验用大鼠及日粮均购于河南省实验动物中心。6~8 周龄SPF 级SD 雄性大鼠20 只,体重160~180 g(生产许可证号:SCXK(豫)2017-0001)。自由采食和饮水,每天12 h 光照,相对湿度为40%~60%,温度20~25℃。
1.3 试验设计 将20 只雄性SD 大鼠适应性饲养7 d 后,随机分为4 个处理组,即对照组(0.9%的生理盐水)、1、2 和5 mg/kg BW 的CdCl2溶液组,每个处理5 个重复,每个重复1 只大鼠,单笼饲养。腹腔注射并持续注射1 周,末次注射后禁食24 h 后脱颈处死。
1.4 样品采集及指标测定
1.4.1 体增重和脏器指数 试验开始时记录大鼠初始体重,末次注射24 h 后,称量大鼠终末体重,脱颈处死,剖取肝脏、脾脏、胸腺放入生理盐水中清洗,用滤纸吸干后称取各脏器重量,计算脏器指数。
体增重=终末体重(g)-初始体重(g)
脏器指数=(脏器重量/体重)×100%
1.4.2 AST、ALT 活性 鼠摘眼球取血,采集好的血液放入无菌离心管中,使离心管在室温下呈45°角放置1 h;待血液凝固收缩后,3 500 r/min 离心10 min,取上清待测。AST、ALT 检测均严格按照AST、ALT 的试剂盒说明书操作。
1.4.3 肝组织氧化损伤指标 准确称取1g 肝脏组织,按照重量(g):体积(mL)为1:9 的比例加入9 倍体积的生理盐水,在冰水浴下匀浆组织,然后3500 r/min 离心15 min,取上清液即10% 匀浆上清液待测。BCA、MDA 含量和SOD、GSH-Px 及CAT 活性的检测均严格按照BCA、MDA、SOD、GSH-Px 和CAT 的试剂盒说明书操作。
1.4.4 肝组织形态学观察 取大鼠右叶肝脏组织,放入10%福尔马林溶液中浸泡进行固定,石蜡包埋,苏木精-伊红(HE)染色,封片后于显微镜下观察肝脏组织病理学变化。
1.4.5 统计分析 采用SAS 9.0 软件对试验数据进行单因素方差分析(One-way ANOVA),结果以平均值±标准差表示,P<0.05 为差异显著。
2 结果
2.1 CdCl2对体增重、脏器指数的影响 如表1 所示,腹腔注射CdCl2溶液导致大鼠的体增重降低,随着注射剂量增加大鼠的体增重降低,1、2 和5 mg/kg BW的CdCl2试验组的大鼠体增重比对照组分别下降7.21%(P>0.05)、12.23%(P<0.05)和41.81%(P<0.05)。与对照组相比,1、2 和5 mg/kg BW 的CdCl2试验组的肝脏指数分别提高了0.23%(P>0.05)、15.98%(P<0.05)、20.54%(P<0.05),2 和5 mg/kg CdCl2组的肝脏指数高于对照组和1 mg/kg CdCl2组(P<0.05)。5 mg/kg CdCl2组的胸腺指数较对照组下降53.84%(P<0.05)。1、2、5 mg/kg CdCl2组的脾脏指数较对照组分别下降了3.03%、6.06%、9.09%,其中,5 mg/kg CdCl2组低于其余各组(P<0.05)。
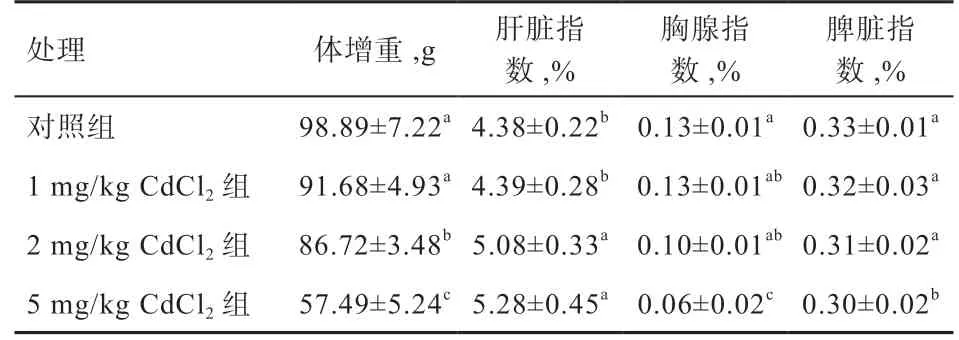
表1 CdCl2 对体增重、脏器指数的影响
2.2 CdCl2对大鼠血清AST、ALT 活性的影响 由表2 可知,腹腔注射CdCl2溶液导致大鼠血清的AST 和ALT 活性升高,1、2、5 mg/kg CdCl2组AST 活性分别较对照组升高11.84%(P>0.05)、48.34%(P<0.05)、82.45%(P<0.05),且5 mg/kg CdCl2组显著高于1mg/kg CdCl2组。1、2、5 mg/kg CdCl2组的ALT 活性较对照组分别升高18.03%(P>0.05)、45.33%(P<0.05)、65.23%(P<0.05),其中2、5 mg/kg CdCl2组显著高于1 mg/kg CdCl2组。

表2 大鼠血清中AST 和ALT 活性
2.3 CdCl2对大鼠肝组织MDA 和SOD、GSH-Px、CAT 活性的影响 由表3 可知,与对照组相比,1、2、5 mg/kg CdCl2组MDA 含量分别提高了7.33%(P>0.05)、17.33%(P<0.05)、52.00%(P<0.05),5 mg/kg CdCl2组显著高于其余各组。1、2、5 mg/kg CdCl2大鼠肝脏SOD 活性较对照组分别降低了2.38%(P>0.05)、11.38%(P<0.05)、15.32%(P<0.05),其中2 和5mg/kg CdCl2组均显著低于对照组和1mg/kg CdCl2组。1、2、5 mg/kg CdCl2组GSHPx 活性较对照组分别降低了9.15%(P>0.05)、18.63%(P<0.05)、28.47%(P<0.05),5 mg/kg CdCl2组显著低于其余各组。试验组CAT 活性差异均不显著。
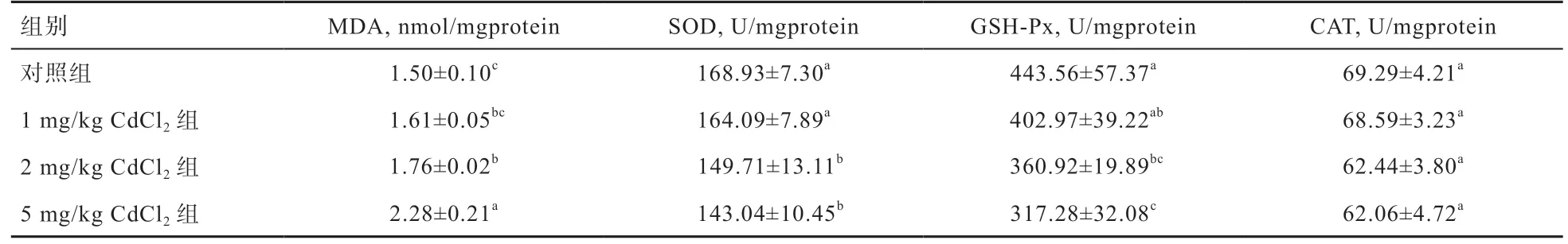
表3 肝组织MDA 含量和SOD、GSH-Px、CAT 活性
2.4 肝脏的组织形态学观察 图1 为肝脏组织的形态学观察结果。对照组肝脏组织形态结构完整,肝细胞索排列整齐呈放射状,肝细胞无坏死现象(图1-A)。1 mg/kg CdCl2组肝细胞形态结构无明显异样,肝细胞索排列较整齐(图1-B)。2 mg/kg CdCl2组肝组织形态结构异常,部分肝细胞浊肿,细胞核浓缩或溶解,肝细胞局部坏死以及炎症细胞浸润(图1-C)。5 mg/kg CdCl2组肝细胞结构破坏极其严重,细胞核大量浓缩或溶解,肝细胞大面积坏死,有大量炎症细胞浸润(图1-D)。
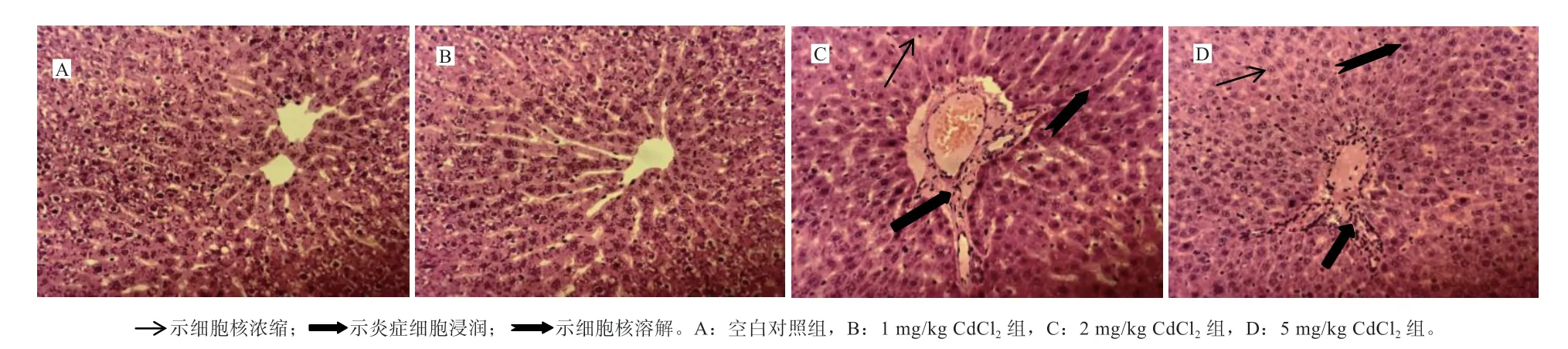
图1 大鼠肝脏组织形态(HE 染色,×200 观察)
3 讨 论
3.1 CdCl2对体增重、脏器指数的影响 镉对胃肠黏膜和胰腺具有直接的损伤作用,会造成胃肠黏膜脱落、浅表性坏死和抑制胰腺的分泌功能,影响肠道对营养物质的消化、吸收和利用,进而导致体重下降[11]。徐光翠等[12]研究发现,连续7 d 对大鼠进行腹腔注射1 mg/kg CdCl2,大鼠的体增重明显低于对照组。本试验中,腹腔注射1 mg/kg CdCl2的大鼠体增重与对照组没有显著差异,但注射2 和5 mg/kg CdCl2组的大鼠体增重则显著低于对照组和1 mg/kg CdCl2组,这可能是由于镉对大鼠的胃肠道造成损伤引起食欲下降,导致营养物质消化吸收受阻所致。
肝脏是机体的主要解毒器官,胸腺和脾脏是机体的主要免疫器官。脏器指数增加说明脏器充血、肿大,脏器指数减小则表明脏器萎缩、坏死等[13]。本试验结果显示,2 和5 mg/kg CdCl2组的肝脏指数显著高于对照组,这与汪纪仓等[14]的研究结果一致,分析认为可能是由于镉在肝脏内的大量蓄积引起肝脏充血、肿大导致的肝脏指数增加。免疫器官指数可反应免疫器官的发育水平和机体的免疫功能状态,在本研究条件下,胸腺、脾脏指数和镉的处理剂量呈负相关,在5 mg/kg CdCl2剂量时与对照组相比达到显著水平,说明镉对胸腺、脾脏产生了毒性并抑制了免疫器官的生长发育,且5 mg/kg CdCl2组的免疫功能受损最为严重,刘永琦等[15]也有相似报道。
3.2 CdCl2对大鼠血清AST、ALT 活性的影响 AST 和ALT 是检测肝功能最敏感的指标。正常生理状态下,AST 和ALT 主要存在于肝组织的细胞内,当肝脏受损时,肝细胞结构被破坏,细胞膜通透性增加,AST 和ALT 释放到血液中,血液中AST 和ALT 活力就会增加,血清中AST 和ALT 的活力与肝受损程度呈正相关[16]。有研究发现,镉中毒的小鼠血清中AST、ALT 活力是正常小鼠的2~4 倍,证明了镉对肝脏有很强的毒性作用[17]。本研究结果显示,试验组血清中AST 和ALT 活力与对照组相比不断升高,其中2 和5 mg/kg CdCl2组呈显著趋势,提示镉对大鼠肝脏造成损伤,且损伤程度与镉剂量呈量效关系。
3.3 CdCl2对大鼠肝组织MDA 含量和SOD、GSH-Px、CAT 活性的影响 MDA 是膜脂质过氧化的终产物,其水平一定程度上反应氧化应激损伤程度[18]。SOD、GSH-Px、CAT 是胞内第一道抗氧化酶防御系统,SOD是一种抗氧化金属酶,其能够催化超氧阴离子自由基转变成H2O2和O2,而H2O2比超氧阴离子具有更强的毒性,随后H2O2又在CAT 和GSH-Px 的作用下分解为H2O 和O2,因此该系统在清除自由基和缓解细胞遭受氧化应激损伤方面发挥着重要作用[19]。傅晗等[20]研究发现,给予SD 大鼠灌胃0.8 mg/ml CdCl2溶液20 d,镉处理组肝组织中MDA 水平显著高于对照组,SOD、GSH-Px 和CAT 活性显著低于对照组。Fang 等[21]采用5 mg/kg CdCl2溶液对SD 大鼠连续灌胃28 d,发现镉组大鼠肝组织中MDA 和ROS 水平较对照组显著升高,SOD、CAT、GSH-Px 活性显著下降。本研究中镉处理组大鼠肝脏MDA 含量增加,并且在2 和5 mg/kg CdCl2处理组中达到显著水平,且5 mg/kg CdCl2组显著高于2 mg/kg CdCl2组。但SOD、GSH-Px 和CAT 的活性与MDA 的水平呈现相反的趋势,随着镉处理剂量的增加,SOD、GSH-Px 和CAT 的活性降低,并在2和5 mg/kg CdCl2的处理组中达到显著水平。分析认为镉可降低肝脏的抗氧化水平导致氧化损伤,并且镉诱导的肝脏氧化损伤具有剂量依赖性。
3.4 CdCl2对大鼠肝脏组织形态的影响 肝组织结构的破坏是肝脏受损最直观的病理表现,本试验中肝组织HE 染色结果进一步证明了腹腔注射2 和5 mg/kg CdCl2可导致组肝组织形态结构紊乱,肝细胞浊肿、冲血,炎症细胞浸润。5 mg/kg CdCl2组肝细胞普遍浊肿,细胞核大量坏死,炎症细胞浸润加重,证明5 mg/kg CdCl2已经对大鼠肝脏造成不可逆损伤,这与本试验中血清AST 和ALT 活力升高的结果一致,也间接验证了肝脏肿大导致肝脏指数升高,此外肝脏中MDA 水平的升高和SOD、GSH-Px 活性的下降也预示了肝脏发生氧化损伤。
4 结 论
在本试验条件下,采用2 mg/kg BW 的CdCl2对大鼠连续腹腔注射7 d 显著降低了大鼠的体增重和肝组织SOD、GSH-Px 活性,肝脏指数、肝组织MDA 含量和血清中AST、ALT 水平显著提高,出现肝组织的形态结构破坏,引发炎症细胞浸润等病理损伤,符合肝脏氧化损伤模型的建立标准,表明成功建立了大鼠肝脏氧化损伤模型。
