HPLC-CAD法测定不同产地和花期闹羊花中闹羊花毒素II、III、V
2021-12-16冯靖雯郭小红刘友平陈鸿平
冯靖雯,郭小红,李 丹,胡 媛,刘友平,陈鸿平
HPLC-CAD法测定不同产地和花期闹羊花中闹羊花毒素II、III、V
冯靖雯,郭小红,李 丹,胡 媛,刘友平,陈鸿平*
成都中医药大学药学院 中药标准化教育部重点实验室 西南特色中药资源国家重点实验室(筹),四川 成都 611137
建立闹羊花中闹羊花毒素II、III、V的定量分析方法,并测定不同产地、花期闹羊花毒素含量,用于闹羊花药材的质量评价及产地、采收期的选择。采用Waters C18色谱柱(250 mm×4.6 mm,5 μm)色谱柱,甲醇(A)-水(B)流动相,建立高效液相色谱联合电雾式检测器(HPLC-CAD)方法,并进行方法学验证,对17批不同产地、5批不同花期药材中3种闹羊花毒素进行含量测定,并聚类分析。所建立的分析方法简便,准确度和精密度良好,能作为闹羊花药材常规定量评价方法;不同产地闹羊花药材可聚为3类,第1类(湖南永州、郴州、岳阳,湖北黄石及山东日照)闹羊花毒素V含量明显低于其他地区,第2类(江西上饶、抚州与2批购自湖北荷花池中药材市场,1批湖北随州)3种闹羊花毒素总含量低于其他2类,第3类(湖北随州和安徽岳西、霍山)3种成分含量均较高。不同花期闹羊花中闹羊花毒素II、III盛开末期达最高,闹羊花毒素V以半开期最高,3种闹羊花毒素总含量在花蕾期最低,盛开末期最高。闹羊花毒素II、III、V含量与产地、花期有相关性,可为药材质量标准的完善提供依据和为产地、采收期的选择提供参考依据。
闹羊花;HPLC-CAD;质量评价;闹羊花毒素II;闹羊花毒素III;闹羊花毒素V
闹羊花为杜鹃花科杜鹃属植物羊踯躅G. Don.的干燥花,始载于《神农本草经》,有大毒,列为下品[1],具有散瘀定痛、祛风除湿等作用,可用于治疗偏正头痛、跌打损伤、风湿痹痛、顽癣等[2]。现代药理学研究表明,闹羊花有免疫调节、抗炎、镇痛、降压、杀虫等多种药理作用,同时表现出对神经系统、脏器系统的强烈毒性[3-6]。
闹羊花药材的质量控制方法研究较薄弱,是历版《中国药典》中唯一一味无具体含量测定方法的“大毒”类中药[2],其临床治疗剂量与中毒剂量相近,有患者服用临床用量中毒[7]。闹羊花中主要含有二萜类、黄酮类、三萜类、木脂素类等成分。据报道二萜类成分是其毒效物质[8-10],闹羊花毒素II、III、V是二萜类代表性成分,故可以作为质量控制的重要指标。
由于二萜类成分无紫外吸收,已有采用HPLC-ELSD法建立闹羊花毒素II、III、VI的含量测定方法[11-12]。但ELSD检测器基线噪音较大、灵敏度低、线性范围较窄。电喷雾检测器(CAD)是近年来发展起来的一种新型检测器,目前有采用CAD对中药中萜类成分检测,刘丽娜等[13]比较了CAD、ELSD和RID 3种不同检测器检测萜类内酯含量,结果证明 CAD 检测器具有更高的灵敏度。因此,本研究采用HPLC-CAD建立同时测定闹羊花毒素II、III、V含量的方法,首次比较不同产地、不同采收期含量差异,进一步提升闹羊花现有质量标准,为闹羊花产地、采收期的选择提供参考依据。
1 仪器与试剂
1.1 仪器
Thermo Ultimate 3000液相色谱仪、Coron Veo RS电雾式检测器(赛默飞世尔科技有限公司);BN3000 型万分之一电子天平(上海精密科学仪器有限公司);CP2000型十万分子一电子天平(德国Sartorius公司);HX-200k型高速粉碎机(浙江省永康市溪岸五金药具厂);UPTUO-I-1000 TE优普系列超纯水机(成都纯水科技有限公司);DHG-9245A型电热鼓风干燥箱(上海一恒科技有限公司);SG8200 HDT型超声波清洗器(上海冠特超声仪器有限公司);Waters C18色谱柱(Sysmmetry shield TM RP18,250 mm×4.6 mm,5 μm)。
1.2 试药
甲醇(色谱纯,美国TEDIA有限公司),甲醇(分析纯,成都市科龙化工试剂厂),实验用水为超纯水;闹羊花毒素III对照品(批号11984-201901)、闹羊花毒素II对照品(批号11983-201901)由中国食品药品检定研究院提供;闹羊花毒素V对照品(批号DS7190922)购自德思特生物,经HPLC-DAD(面积归一化法)检测质量分数大于98.0%。
1.3 样品
收集不同产地样品17批(表1)、同一产地(S1)不同花期样品5批(表2和图1)。所有样品经成都中医药大学中药资源与鉴定系严铸云教授鉴定为杜鹃花科杜鹃属植物羊踯躅G. Don. 的干燥花。

表1 不同产地闹羊花样品信息

表2 不同采收期闹羊花样品信息

图1 不同花期闹羊花
2 方法与结果
2.1 混合对照品储备液的制备
分别精密称取闹羊花毒素II、闹羊花毒素III、闹羊花毒素V对照品适量,加甲醇溶解,制成质量浓度分别为860.09、670.06、310.03 μg/mL的对照品储备液。
2.2 供试品溶液的制备
精密称取闹羊花粉末(过4号筛)2.0 g,置于具塞锥形瓶中,精密加入80%甲醇20 mL,浸泡20 min,称定质量,超声提取1 h,放冷,再称定质量,用80%甲醇补足失重,过0.22 μm微孔滤膜,取续滤液,即得。
2.3 色谱条件
Waters C18色谱柱(250 mm×4.6 mm,5 μm),流动相甲醇(A)-水(B)梯度洗脱(0~10 min,20%~30% A;10~30 min,30 %~40% A;30~50 min,40%~50% A)。体积流量0.8 mL/min;柱温35 ℃;进样量20 μL;电喷雾检测器以氮气为载气,雾化温度35 ℃,PF1.0,采集频率10 Hz,过滤常数3.6。本实验条件下所测的3种成分与相邻色谱峰的分离度均大于1.5与其他组分分离完全,拖尾因子在0.95~1.05,理论塔板数大于6 000,色谱系统适用性试验符合含量测定要求。对照品溶液、供试品溶液及空白溶液的色谱图见图2。
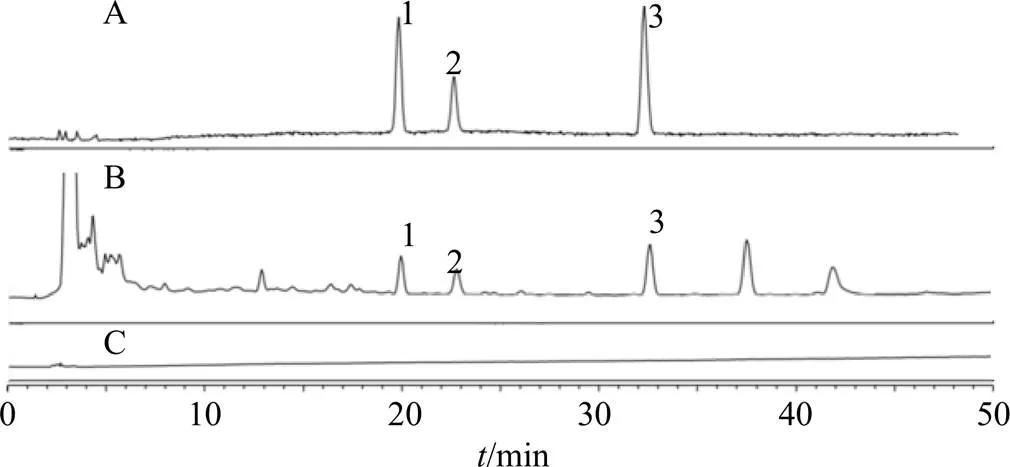
1-闹羊花毒素III 2-闹羊花毒素V 3-闹羊花毒素II
2.4 线性关系考察
精密吸取“2.1”项下混合对照品0.5、1.0、2.0、2.5、4.0、5.0 mL分别置5 mL量瓶中,用80%甲醇稀释定容至刻度,摇匀,即得;分别精密吸取上述混合对照品溶液各20 μL按“2.3”项下色谱条件进样,测定,以进样浓度()为横坐标,以峰面积为纵坐标(),绘制标准曲线,结果见表3,均大于0.999 5,呈良好线性关系。

表3 闹羊花中3种成分线性关系
2.5 定量下限和检测下限
取“2.4”项下闹羊花对照品溶液,不断稀释,以信噪比/=3为基准,测得检测限,以信噪比/=10为基准,测得定量限,结果见表3。
2.6 精密度考察
精密吸取“2.2”项下的对照品溶液,按照“2.3”项下的色谱条件重复测定6次,记录峰面积并计算RSD,结果闹羊花毒素II、III、V的RSD分别为1.39%、0.62%、1.73%,表明仪器精密度良好。
2.7 稳定性考察
精密称取闹羊花粉末(S1),按照“2.2”项下的方法制备供试品溶液。依照“2.3”项下的色谱条件分别于0、2、4、12、24、36 h进样,记录峰面积并计算RSD。结果闹羊花毒素II、III、V的RSD分别为1.80%、1.43%、1.9%。
2.8 重复性考察
取样品粉末编号(S1)6份,分别按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件测定,得各成分的质量分数及其RSD。结果闹羊花毒素II、III、V、的平均质量分数分别为0.141%、0.117%、0.243%,RSD分别为2.34%、1.17%、1.64%。
2.9 加样回收率考察
精密称取已测定的闹羊花(S1)样品粉末1.0 g,平行6份,分别加入3种成分对照品适量,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件测定,记录各峰面积,计算回收率,闹羊花毒素II、III、V加样回收率分别为99.50%、103.60%、103.30%,RSD分别为1.40%、1.18%、2.42%。
2.10 耐用性试验
分别考察流动相有机相甲醇浓度值变化±5%、柱温变化±5 ℃、体积流量变化±0.05 mL/min、不同的色谱柱(Agilent C18250 mm×4.6 mm,5 μm;Waters C18250 mm×4.6 mm,5 μm;Thermo hypersil gold C18250 mm×4.6 mm,5 μm)进行测定时,仪器色谱行为的变化。检测同一批闹羊花3种成分的量及其RSD。结果各条件下所测各成分质量分数的RSD均<3%,表明本方法具有较好的耐用性。
2.11 样品测定
2.11.1 不同产地样品测定 精密称取17批不同产地闹羊花样品,按“2.2”项下方法制备供试品溶液,分别精密吸取20 μL,按“2.3”项下色谱条件测定,以外标法测定供试品溶液,计算样品含量,测定结果均在线性范围内(除S16)结果见表4。

表4 不同产地闹羊花中3种成分的含量测定结果(n=3)
结果发现不同产地样品中闹羊花毒素II、III、V含量有明显差异,尤以闹羊花毒素V质量分数差异最大,为0.017%~0.160%,相差9倍,其中湖南永州含量低于检测限;闹羊花毒素III质量分数为0.106%~0.296%,相差近3倍;闹羊花毒素II为0.192%~0.395%,相差近2倍。
2.11.2 不同花期样品测定 精密称取5批不同花期闹羊花样品,按“2.2”项下方法制备供试品溶液,分别精密吸取20 μL,按“2.3”项下色谱条件测定,以外标法测定供试品溶液,计算样品含量,测定结果均在线性范围内,结果见图3。

图3 不同花期闹羊花毒素II、闹羊花毒素III、闹羊花毒素V3种二萜类含量变化(n=3)
结果表明不同花期闹羊花所含化学成分种类一致,但成分含量存在一定差异性。不同花期闹羊花中闹羊花毒素II、III、V的质量分数分别为0.184%~0.346%、0.097%~0.156%、0.150%~0.190%。闹羊花毒素II、III、3种闹羊花毒素总和含量盛开末期最高,闹羊花毒素V含量半开期最高。
2.12 聚类分析
采用IBM SPSS Statistics 23.0软件对17批不同产地的闹羊花药材中共有组分进行系统聚类分析(除S16外),当欧式距离为20时,全部样品被分成3大类,第1类[山东(由南方地区移栽)、湖南岳阳、郴州、永州与相邻的湖北黄石]闹羊花毒素V含量明显低于其他地区,第2类(江西上饶、抚州与2批购自荷花池,1批湖北随州)二萜类总含量低于其它2类;第3类(湖北随州和安徽岳西、霍山)所产闹羊花中3种成分含量较高。

图4 闹羊花样品的聚类分析
3 讨论
3.1 色谱条件与提取方法考察
本实验对闹羊花药材的提取方法进行了优化,以3个二萜类成分总含量为优化指标,分别对物料比(1∶10、1∶20、1∶30)、不同提取溶剂(100%、50%、80%甲醇、水、95%、70%乙醇)进行了考察,结果表明物料比为1∶10、超声时间1 h、80%甲醇作为提取溶剂的条件下,闹羊花药材中3种闹羊花毒素提取率最高。发现CAD的参数对测定的准确性有重要影响,因此本实验分别考察雾化温度(35、50 ℃)、功能参数(1.0、1.3、1.5)、采集频率(1、5、10、20)、过滤常数(3.6、5.0)。电喷雾检测器雾化温度35 ℃,功能参数1.0,采集频率10 Hz,过滤常数3.6,所得到的图谱基线平直,灵敏度高,分离度好。
3.2 不同产地对二萜含量的影响
闹羊花为我国特有植物,主产于南方山区, 因具观赏性,也作园艺、花艺,部分北方地区也开始引种栽培。因此,对不同产地闹羊花中闹羊花毒素成分含量进行研究具有重大意义。结果表明不同产地闹羊花药材中闹羊花毒素II、III的含量较为稳定,闹羊花毒素V含量差异显著,其中安徽岳西含量是湖南郴州的9倍。采用SPSS 23.0软件以不同产地的闹羊花药材中3种闹羊花毒素的含量为特征将样品聚成3类,山东(由南方地区移栽)、湖南岳阳、郴州、永州与相邻的湖北黄石为第1类;江西上饶、抚州与2批购自荷花池,1批湖北随州为第2类;大别山地区的湖北随州,安徽岳西、霍山与河南南阳为第3类,表明地理位置相近的样本被归类一起。因此,闹羊花中3种闹羊花毒素成分含量受不同地理环境的影响。《中国药典》2020年版[2]规定闹羊花的临床用量为0.6~1.5 g,安全剂量较窄。有临床研究报道,即使在临床用量范围内(日用量1.0 g)[7],患者也发生中毒,这可能跟不同产地闹羊花毒素含量差异有关。
3.3 不同采收期对二萜含量的影响
《中国药典》[2]规定闹羊花以花初开时采收,但对于“初开”界定不明。目前,市售闹羊花药材性状有半开期、盛开期、盛开末期等多种花期。因此,对不同采收期闹羊花中闹羊花毒素成分含量进行研究具有重大意义,可为花期的选择提供参考。本实验于湖北随州代采从3月底花蕾期至4月下旬盛开末期共5批次闹羊花,覆盖了闹羊花的所有花期。不同花期闹羊花毒素II、III的变化趋势相同,花蕾期~半开期含量先升后降,半开期~盛开末期含量呈上升趋势,以盛开末期含量最高;闹羊花毒素V五个时期先升后降,又升再降,以半开期含量最低;3种闹羊花毒素含量总和花蕾期最低,盛开末期最高,相差约1.5倍。从含量成分角度,闹羊花采收应以盛花末期为宜,有别于《中国药典》[2]规定的“初开”时采收。中药质量不能唯成分论,3种闹羊花毒素成分的含量高低,不代表整体化学信息。因此,本课题组已展开“物质基础-毒性-药效”多元评价模式研究闹样花质量标准体系,从多角度交叉分析评价不产产地、不同花期对闹羊花质量的影响。
利益冲突 所有作者均声明不存在利益冲突
[1] 清·顾观光. 神农本草经 [M]. 哈尔滨: 哈尔滨出版社, 2007: 23.
[2] 中国药典 [S]. 一部. 2020: 236.
[3] Cai Y Q, Hu J H, Qin J,.Molle (Ericaceae): Phytochemistry, pharmacology, and toxicology [J]., 2018, 16(6): 401-410.
[4] 薛秋雯, 梁爽. 羊踯躅化学成分及其药理作用研究进展 [J]. 中草药, 2020, 51(5): 1350-1360.
[5] Wang X, Hu Y W, Yuan D,. Chemical constituents from the flowers ofG. Don [J].,2014, 23(2): 94-98.
[6] Popescu R, Kopp B. The genus Rhododendron: An ethnopharmacological and toxicological review [J]., 2013, 147(1): 42-62.
[7] 徐淑岗, 杨海东. 闹羊花中毒存在明显个体差异 [J]. 罕少疾病杂志, 2019, 26(3): 109-110.
[8] Li Y, Liu Y B, Yu S S. Grayanoids from the Ericaceae family: Structures, biological activities and mechanism of action [J]., 2013, 12(2): 305-325.
[9] Li Y, Zhu Y, Zhang Z,. Antinociceptive grayanane-derived diterpenoids from flowers of[J]., 2020, 10(6): 1073-1082.
[10] Li C H, Zhang J Y, Zhang X Y,. An overview of grayanane diterpenoids and their biological activities from the Ericaceae family in the last seven years [J]., 2019, 166: 400-416.
[11] 张枝润, 周成, 娄志华, 等. HPLC-ELSD法测定闹羊花中Rhodojaponin-III和Rhodojaponin-Ⅵ含量 [J]. 天然产物研究与开发, 2013, 25(9): 1234-1236,1204.
[12] 张小红, 董磊迟, 李会军, 等. 高效液相色谱蒸发光散射检测法测定闹羊花中闹羊花毒素II的含量 [J]. 中国新药杂志, 2013, 22(5): 602-604,608.
[13] 刘丽娜, 金红宇, 潘媛媛, 等. 高效液相色谱-电雾式检测器法测定银杏叶提取物中萜类内酯含量 [J]. 药物分析杂志, 2018, 38(7): 1269-1274.
Simultaneous determination of rhodojaponins II, III, V offrom different producing area and flowering phase by HPLC-CAD
FENG Jing-wen,GUO Xiao-hong,LI Dan,HU Yuan, LIU You-ping,CHEN Hong-ping
College of Pharmacy, Chengdu University of Traditional Chinese Medicine Key Laboratory of Standardization of Traditional Chinese Medicine Ministry of Education State Key Laboratory of Traditional Chinese Medicine Resources with Southwest Characteristics, Chengdu, 611137, China
This study was established to simultaneously determine the content of rhodojaponins II, III, and V of, and to compare samples from different origins and flowering stages.Using Waters C18 column (250 mm × 4.6 mm, 5 μm) column, methanol (A)-water (B) to establish a high performance liquid chromatography combined with electrospray detector (HPLC-CAD) method, and methodological verification was carried out to determine the content of three kinds of rhodojaponin in 17 batches of different origin and five batches of medicinal materials at different flowering dates, and cluster analysis.The established analytical method was simple, with good accuracy and precision, and can be used as a routine quantitative evaluation method formedicinal materials; Samples from different origins can be grouped into three categories, category 1 (Yongzhou, Chenzhou, Yueyang in Hunan, Huangshi in Hubei and Rizhao in Shandong) rhodojaponin V was significantly lower than that in other regions. The total content of rhodojaponin in category 2 (Jiangxi Shangrao, Fuzhou and two batches purchased from Hehuachi, one batch in Suizhou, Hubei) was lower than that of the other two categories. The content of the three components in the three categories (Suizhou, Hubei, Yuexi, Huoshan, Anhui) was relatively high. Rhodojaponin II and III were the highest in the late blooming period, rhodojaponin V was the highest in the half-open period, and the total content of the three rhodojaponin is the lowest in the flower bud period and the highest in the late blooming period.The content of rhodojaponin II, III, and V is related to the origin and flowering period, which can provide a basis for improving the quality standards of medicinal materials and a reference for the choice of origin and harvesting period.
; HPLC-CAD; Quality evaluation; rhodojaponin II; rhodojaponin III; rhodojaponin V
R286.2
A
0253 - 2670(2021)24 - 7624 - 06
10.7501/j.issn.0253-2670.2021.24.025
2021-07-09
国重·双一流·中药质量保障提升创新科研团队(030041011);重庆市自然科学基金面上项目(cstc2019jcyj-msxmX0552);重庆市科研院所绩效激励引导专项(cstc2018jxjl130011);成都中医药大学杏林学者学科人才科研提升计划(YYZX20180023)
冯靖雯(1996—),在读硕士研究生,主要从事中药物质基础与质量标准化研究。Tel: 15680506886 E-mail: 517244131@qq.com
陈鸿平(1980—),成都中医药大学药学院教授,博士学位,主要从事中药炮制、中药质量标准化及药效物质基础研究工作。Tel: 13982283303 E-mail: chenhong-ping@126.com
[责任编辑 时圣明]
