开心散对APP/PS1小鼠神经炎症和Aβ沉积的作用研究
2021-12-16王彬斌冯晓晓恩特扎尔别尔克李朝霞
王彬斌,冯晓晓,恩特扎尔·别尔克,赵 晖,李朝霞
开心散对APP/PS1小鼠神经炎症和Aβ沉积的作用研究
王彬斌,冯晓晓,恩特扎尔·别尔克,赵 晖,李朝霞*
首都医科大学中医药学院,中医络病研究北京市重点实验室,北京 100069
研究开心散对阿尔茨海默症(Alzheimer’s disease,AD)动物模型淀粉样前体蛋白/早老素基因1(amyloid precursor protein/presenilin 1,APP/PS1)双转基因小鼠的作用。将3月龄雄性APP/PS1小鼠随机分为模型组、美金刚(3.33 mg/kg)组及开心散低、中、高剂量(0.33、1.00、3.00 g/kg)组,采用同月龄相同遗传背景C57BL/6J小鼠作为对照组和对照给药(开心散1.00 g/kg)组,每组8只。连续ig给药2个月后,Morris水迷宫实验评价小鼠学习记忆能力;苏木素-伊红(HE)染色法观察小鼠海马CA1区神经元形态;刚果红染色法检测小鼠脑组织淀粉样斑块表达;免疫组化学法检测小鼠皮层和海马中β淀粉样蛋白1-40(amyloid β protein 1-40,Aβ1-40)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和离子钙接头结合调节分子-1(ionized calcium binding adaptor molecule-1,Iba-1)的表达;ELISA法检测小鼠血清中炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6水平以及皮层和海马中乙酰胆碱(acetylcholine,Ach)水平。与模型组相比,美金刚组和开心散组小鼠学习记忆能力明显提高(<0.05、0.01),海马CA1区神经元数量增加(<0.01);皮层和海马中的淀粉样斑块、Aβ1-40、GFAP和Iba-1表达明显减少(<0.05、0.01);血清中TNF-α、IL-1β和IL-6水平明显降低(<0.05、0.01);皮层中Ach水平显著升高(<0.01)。开心散可能通过抑制星形胶质细胞和小胶质细胞活化,降低血清中炎症因子TNF-α、IL-6、IL-1β水平,减少Aβ和淀粉样斑块的生成,增加皮层中Ach含量,从而发挥保护神经元、防治AD的作用。
开心散;阿尔茨海默症;淀粉样前体蛋白/早老素基因1双转基因小鼠;β淀粉样蛋白;胶质纤维酸性蛋白;离子钙接头结合调节分子-1
阿尔茨海默症(Alzheimer’s disease,AD)是一种以获得性记忆减退、认知功能障碍等为主要特征的中枢神经系统退行性疾病,以老年斑和神经原纤维缠结为主要病理特征[1]。随着世界人口老龄化,AD的发病率急剧增高,严重影响人类健康[2]。AD的发病机制复杂,β淀粉样蛋白(amyloid β protein,Aβ)沉积和神经炎症在AD的病理进程中起着至关重要的作用[3-4]。AD在中医学属“呆病”“健忘”“虚劳”等范畴。开心散始载于唐代孙思邈的《备急千金要方》,由“远志、人参各4分,茯苓2两,石菖蒲1两”组成[5],“主好忘”,是治疗老年痴呆的基础方。研究表明,开心散可改善AD动物模型的学习记忆能力,通过影响Aβ生成、保护神经元、调节神经递质、抗氧化等途径发挥作用[6-8],在防治AD方面具有良好的应用前景,但其基于Aβ沉积和神经炎症的药理作用还有待于进一步系统研究。本研究选择淀粉样前体蛋白/早老素基因1(amyloid precursor protein/presenilin 1,APP/PS1)双转基因小鼠,从行为学、Aβ沉积、神经炎症等方面评价开心散对APP/PS1小鼠的作用,为其临床应用提供理论依据。
1 材料
1.1 动物
SPF级雄性3月龄APP/PS1小鼠和C57BL/6J小鼠,体质量20~30 g,购自北京华阜康生物科技有限公司,动物许可证号SCXK(京)2020-0004。动物饲养于温度(25±2)℃、湿度(50±10)%的屏障环境内,自由进食饮水,每日光照12 h。动物实验经首都医科大学伦理委员会批准(批准号AEEI-2018-101)。
1.2 药材
开心散由人参、茯苓、石菖蒲和远志组成,人参、茯苓和石菖蒲购自北京能济中药饮片有限公司,远志购自北京明辉恒通药业有限公司,经首都医科大学中医药学院李佳副教授鉴定分别为五加科植物人参C. A. Mey.的干燥根和根茎、多孔菌科真菌茯苓(Schw.) Wolf的干燥菌核、天南星科植物石菖蒲Schott.的干燥根茎、远志科植物远志Willd.的干燥根。
1.3 药品与试剂
盐酸美金刚片(批号797818)购自丹麦灵北药厂;Aβ1-40抗体(批号GB11307)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(批号GB11096)、离子钙接头结合调节分子-1(ionized calcium binding adaptor molecule-1,Iba-1)抗体(批号GB11105)、HRP标记的山羊抗兔IgG抗体(批号GB11206)均购自武汉塞维尔生物科技有限公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒、小鼠白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、小鼠IL-1β ELISA试剂盒、小鼠乙酰胆碱(acetylcholine,Ach)ELISA试剂盒均购自上海蓝基生物科技有限公司;PBS溶液、苏木素-伊红(HE)染色试剂盒、多聚甲醛、二甲苯与中性树胶均购自武汉赛维尔生物科技有限公司;3%双氧水、无水乙醇、丙酮均购自北京化工厂。
1.4 仪器
63031型水迷宫实验设备(深圳市瑞沃德生命科技有限公司);3K15型低温高速离心机(美国Sigma公司);超低温冰箱(美国Thermo Fisher Scientific公司);Bio-Gen PRO200匀浆仪(美国PRO Scientific公司);Pannoramic scan全自动切片扫描仪(匈牙利3DHistech公司);SpectraMax Plus 385全波长酶标仪(美国Molecular Devices公司);UC7超薄切片机(德国Leica公司);E100显微镜(日本Nikon公司)。
2 方法
2.1 开心散的制备
将开心散的4味药材饮片粉碎,过24目筛得中药粗粉。按原方比例[9-12](人参、远志、石菖蒲、茯苓为1∶1∶25∶50),称取药材粉末适量,加入12倍量70%乙醇,浸泡0.5 h,加热回流提取2 h,滤过;滤渣继续用10倍量70%乙醇回流提取1 h,滤过,合并2次滤液,减压回收乙醇,于真空干燥箱干燥,得到开心散醇提物,4 ℃保存。取适量开心散醇提物干粉,用0.5%羧甲基纤维素钠(CMC-Na)溶液配制一定质量浓度的开心散药液,经高效液相色谱法(HPLC)测定,开心散中含远志𠮿酮III 9.3 μg/g、3,6′-二芥子酰基蔗糖102.0 μg/g、α-细辛醚97.1 μg/g、β-细辛醚1033.0 μg/g、去氢土莫酸298.0 μg/g、茯苓酸410.0 μg/g、松苓新酸11.7 μg/g。
2.2 动物分组与给药
将雄性APP/PS1小鼠随机分为模型组、美金刚(3.33 mg/kg)组和开心散低、中、高剂量(0.33、1.00、3.00 g/kg,以生药量计)组,每组8只。以同月龄、相同遗传背景的雄性C57BL/6J野生小鼠16只作为正常组,随机分为对照组和对照给药(开心散1.00 g/kg)组,每组8只。适应性饲养1周后,各给药组ig相应药物(10 mL/kg),模型组以及对照组ig等体积0.5% CMC-Na溶液,1次/d,连续2个月。给药结束后,进行Morris水迷宫实验[13]。
2.3 Morris水迷宫实验
2.3.1 定位航行实验 将平台置于某一象限,第1~5天将小鼠分别从其他3个象限面向池壁放入水中,每日训练3次,记录小鼠入水后60 s内站上平台所需时间,即逃逸潜伏期。小鼠找到平台后使其在平台上休息10 s,若规定时间内找不到平台,则由操作者将其引导上平台,使其在平台上停留相同时间。
2.3.2 空间探索实验 定位航行实验结束24 h后,撤除平台,将小鼠从同一入水点放入水中,记录小鼠在60 s内的穿越平台次数、平台象限时间百分比和平台象限路程百分比。
2.4 取材
水迷宫实验结束后,小鼠吸入异氟烷麻醉后取血,用于血清炎症因子的检测。取血后每组随机取3只小鼠心脏灌注4%多聚甲醛固定组织,制备脑组织石蜡包埋切片,分别进行HE染色、刚果红染色和免疫组化实验;每组剩余的5只小鼠取血后处死,断头取脑,冰上快速分离海马和皮层,于液氮中快速冷冻,−80 ℃冻存,用于Ach检测。
2.5 HE染色法观察小鼠海马CA1区神经元形态
取各组小鼠脑组织石蜡切片,通过常规脱蜡水化后,进行HE染色,中性树胶封片,于光学显微镜下观察海马CA1区神经元形态并采集图像,同时进行神经元计数。
2.6 刚果红染色法检测小鼠脑组织淀粉样斑块的表达
取各组小鼠脑组织石蜡切片,通过常规脱蜡水化后,进行刚果红染色,中性树胶封片,于光学显微镜下观察并采集图像。每个切片随机选取多个不同视野,测定淀粉样斑块的吸光度()值。
2.7 免疫组化法检测小鼠脑组织Aβ1-40、GFAP和Iba-1蛋白表达
取各组小鼠脑组织石蜡切片,常规脱蜡水化,抗原修复;放入3%双氧水溶液孵育后血清封闭,滴加Aβ1-40、GFAP、Iba-1抗体,4 ℃孵育过夜;加入HRP标记的山羊抗兔IgG抗体,室温孵育;滴加DAB显色,中性树胶封片,于光学显微镜下观察并采集图像。每个切片随机选取多个不同视野,测定Aβ1-40、GFAP和Iba-1的值。
2.8 ELISA法检测小鼠血清中炎症因子以及皮层、海马组织Ach水平
取各组小鼠血清,按照ELISA试剂盒说明书检测炎症因子TNF-α、IL-6和IL-1β水平。取各组小鼠的皮层和海马组织,按照组织质量和体积(1∶9)加入PBS溶液,冰浴下匀浆,4 ℃、3000 r/min离心,分离上清液,按照ELISA试剂盒说明书检测Ach水平。
2.9 数据分析
3 结果
3.1 开心散对APP/PS1小鼠学习记忆能力的影响
Morris水迷宫实验结果见表1、2。在定位航行实验中,各组小鼠逃逸潜伏期随着训练天数的增加整体呈下降趋势。与对照组相比,对照给药组小鼠的学习记忆能力无明显差异;模型组小鼠在第2~5天的逃逸潜伏期明显延长(<0.01)。与模型组相比,美金刚组小鼠在第3~5天的逃逸潜伏期明显缩短(<0.05);开心散各剂量组小鼠的逃逸潜伏期均有所减少,其中开心散高剂量组小鼠在第3~5天的逃逸潜伏期明显缩短(<0.05、0.01)。

表1 各组小鼠定位航行实验结果(, n = 8)
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,下表同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as below tables

表2 各组小鼠空间探索实验结果(, n = 8)
空间探索实验结果表明,与对照组相比,模型组小鼠的穿越平台次数、平台象限时间百分比和平台象限路程百分比均明显减少(<0.05、0.01);与模型组相比,美金刚组小鼠的穿越平台次数、平台象限时间百分比和平台象限路程百分比均明显增加(<0.05);开心散各剂量组小鼠的穿越平台次数、平台象限时间百分比和平台象限路程百分比均增加,其中开心散高剂量组具有显著性差异(<0.05)。
3.2 开心散对APP/PS1小鼠海马CA1区神经元损伤的影响
如图1和表3所示,对照组和对照给药组小鼠海马CA1区神经元染色清楚且均匀,细胞排列整齐,细胞核呈圆形,核仁清晰。与对照组相比,模型组小鼠的海马CA1区神经元数量明显减少(<0.01),细胞排列较为分散,核固缩现象明显,核仁不清晰;与模型组相比,美金刚组小鼠的海马CA1神经元数量明显增多(<0.01),神经元排列较为整齐,核固缩现象明显改善;开心散各剂量组小鼠的海马CA1区神经元数量均明显增多(<0.01),神经元排列较为规则整齐,核固缩现象明显得到改善。
3.3 开心散对APP/PS1小鼠脑组织淀粉样斑块表达的影响
如图2所示,对照组和对照给药组小鼠的皮层和海马中均未检测到阳性表达,在其他组小鼠的皮层和海马则检测到了呈弥散性分布的粉红色阳性表达,即淀粉样斑块。分别对海马和皮层中淀粉样斑块阳性表达的值进行半定量分析,结果见表4,与模型组相比,美金刚组和开心散中、高剂量组小鼠皮层中的淀粉样斑块均明显减少(<0.01),但对海马中淀粉样斑块的表达无明显改善作用。

图1 开心散对APP/PS1小鼠海马CA1区神经元形态的影响 (HE, ×400)

表3 开心散对APP/PS1小鼠海马CA1区神经元数量的影响(, n = 3)

A-对照组 B-对照给药组 C-模型组 D-美金刚组 E-开心散低剂量组 F-开心散中剂量组 G-开心散高剂量组 图片从左至右依次为全脑 (×20)、皮层 (×630)、海马(×100)、海马局部放大图(×630),黑色框标注局部放大区域,图3~5同

表4 开心散对APP/PS1小鼠脑组织淀粉样斑块表达的影响(, n = 3)
ND表示未检测到
ND means not detected
3.4 开心散对APP/PS1小鼠脑组织Aβ1-40表达的影响
Aβ1-40阳性表达为棕褐色。如图3和表5所示,与对照组相比,模型组小鼠的皮层和海马中Aβ1-40阳性表达显著增加(<0.01);与模型组相比,美金刚组小鼠的皮层和海马中Aβ1-40阳性表达明显减少(<0.05),开心散各剂量组小鼠皮层和海马中Aβ1-40阳性表达均有所减少,其中开心散低、中剂量组皮层Aβ1-40阳性表达具有显著性差异(<0.05),开心散中、剂量组海马中Aβ1-40阳性表达具有显著性差异(<0.05)。

图3 开心散对APP/PS1小鼠脑组织Aβ1-40表达的影响

表5 开心散对APP/PS1小鼠脑组织Aβ1-40表达的影响(, n = 3)
3.5 开心散对APP/PS1小鼠脑组织GFAP表达的影响
各组小鼠皮层和海马星形胶质细胞活化标志物GFAP的免疫组化实验结果见图4和表6,阳性表达为棕褐色。与对照组相比,模型组小鼠皮层和海马中GFAP表达明显增加(<0.01);与模型组相比,美金刚组小鼠皮层中GFAP表达明显减少(<0.01),开心散中剂量组海马和皮层中的GFAP表达均明显降低(<0.01)。

图4 开心散对APP/PS1小鼠脑组织GFAP表达的影响

表6 开心散对APP/PS1小鼠脑组织GFAP表达的影响(, n = 3)
3.6 开心散对APP/PS1小鼠脑组织Iba-1表达的影响
各组小鼠皮层和海马小胶质细胞活化标志物Iba-1的免疫组化实验结果见图5和表7,阳性表达为棕褐色。与对照组相比,模型组小鼠皮层和海马中Iba-1的表达明显增加(<0.05、0.01);与模型组相比,美金刚组小鼠海马中Iba-1的表达明显减少(<0.05),开心散中剂量组海马和皮层中Iba-1表达显著降低(<0.05、0.01)。
3.7 开心散对APP/PS1小鼠血清炎症因子水平的影响
如表8所示,与对照组相比,模型组小鼠血清中TNF-α、IL-1β和IL-6水平均明显升高(<0.05、0.01);与模型组相比,美金刚组和开心散高剂量组小鼠血清中TNF-α、IL-1β和IL-6水平均明显降低(<0.05、0.01),开心散中剂量组小鼠血清中TNF-α水平明显降低(<0.05)。
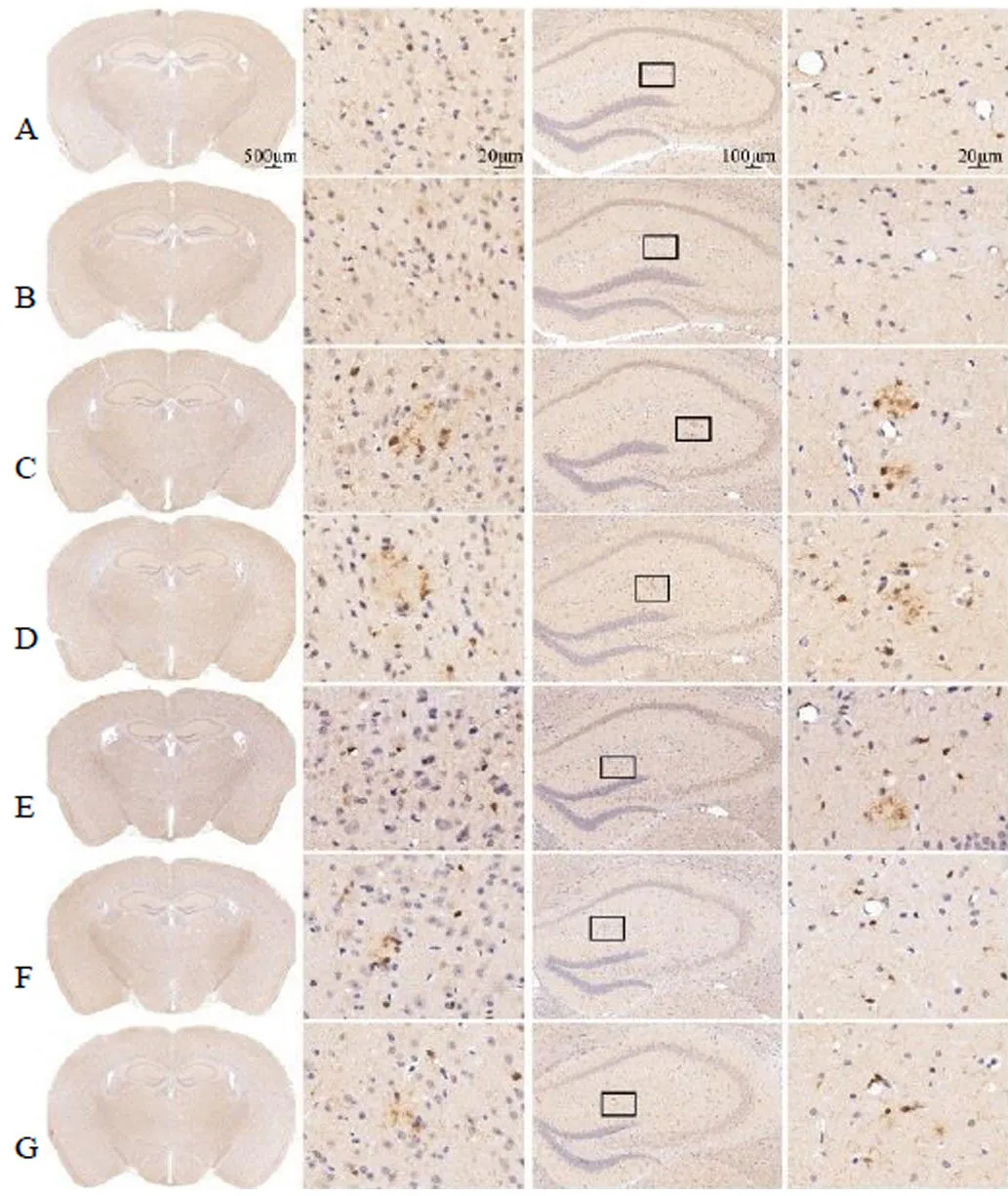
图5 开心散对APP/PS1小鼠脑组织中Iba-1表达的影响

表7 开心散对APP/PS1小鼠脑组织Iba-1表达的影响(, n = 3)
3.8 开心散对APP/PS1小鼠皮层和海马中Ach水平的影响
如表9所示,与对照组相比,模型组小鼠皮层和海马中Ach水平均明显下降(<0.01);与模型组相比,美金刚组和开心散中剂量组小鼠皮层中Ach水平明显升高(<0.01)。

表8 开心散对APP/PS1小鼠血清中炎症因子水平的影响(, n = 8)

表9 开心散对APP/PS1小鼠皮层和海马中Ach水平的影响(, n = 5)
4 讨论
AD在中医学属“呆病”“健忘”“虚劳”等范畴。历代中医医家对老年痴呆疾病的症状、病因和病机等都有着全面而深刻的认识,在疾病的治疗上多从补气、益智、安神等方面用药[14-15]。开心散始载于唐代孙思邈《备急千金要方·卷十四》,为益智方剂,“主好忘”,由“远志、人参各4分,茯苓2两,石菖蒲1两”组成。方中人参具有补气固脱、宁心益智之功效;远志具有安神益智、祛痰、消肿之功效;茯苓具有宁心安神、利水渗湿之功效;石菖蒲具有醒神益智、开窍豁痰之功效[16]。从数据挖掘角度分析中医药治疗健忘和痴呆的用药规律,人参、远志、茯苓和石菖蒲均为高频使用中药,故可认为开心散治疗老年性痴呆具有历史渊源且是治疗老年痴呆的基础方[17-18],其治疗老年痴呆的作用机制值得进一步的研究与探索。
AD的发病机制复杂,涉及多个病理环节。Aβ在脑内沉积是AD主要的发病机制之一[19-20]。Aβ在脑内生成过剩,不能及时得到清除,继而在神经细胞外大量聚集形成淀粉样斑块,引发神经炎症、神经元变性等一系列病理变化,最终导致患者的认知和记忆能力下降[21]。本研究结果显示,5月龄APP/PS1小鼠皮层和海马中均出现弥散分布的淀粉样斑块,Aβ1-40表达与对照组相比明显增多。给药2个月后,中、高剂量开心散可使APP/PS1小鼠皮层中淀粉样斑块表达明显降低,低、中剂量开心散可使APP/PS1小鼠皮层中Aβ1-40表达明显降低,中、高剂量开心散可使APP/PS1小鼠海马中Aβ1-40表达明显降低。结果表明,开心散对APP/PS1皮层和海马中的Aβ沉积具有一定的改善作用,可能通过降低Aβ1-40表达发挥作用。
神经炎症也是AD的发病机制之一[22-23]。神经炎症反应主要由脑组织中的免疫细胞异常激活介导,星形胶质细胞和小胶质细胞是脑中主要负责免疫调节的细胞,GFAP和Iba-1分别是星形胶质细胞和小胶质细胞活化的标志物[24-25]。研究表明,开心散具有降低AD小鼠脑组织和血清中炎症因子水平[26-27]以及通过调控中枢神经炎症系统、抗抑郁的作用[28-29],但未见开心散在APP/PS1小鼠的抗炎作用报道。本研究结果显示,5月龄APP/PS1小鼠皮层和海马中GFAP和Iba-1表达异常增加,出现星形胶质细胞和小胶质细胞异常活化,血清中炎症因子TNF-α、IL-1β和IL-6水平增加。中剂量开心散可明显降低APP/PS1小鼠皮层和海马中GFAP和Iba-1表达,并降低血清中IL-1β水平;高剂量开心散可明显降低血清中TNF-α、IL-1β和IL-6水平,表明开心散可缓解星形胶质细胞和小胶质细胞的异常活化,抑制炎症因子TNF-α、IL-1β和IL-6的大量释放。
在AD的病理过程中,炎症反应与Aβ沉积密切相关。Aβ沉积可诱导胶质细胞过度激活[30-31]。小胶质细胞过度激活导致促炎因子大量释放,对Aβ的清除减少[32];星形胶质细胞被激活后表现出神经毒性作用,促使炎性介质释放增加,导致神经变性和突触丢失,加剧认知障碍[33],从而形成恶性循环。开心散具体通过哪些作用靶点和通路抑制胶质细胞活化、炎症反应和Aβ沉积,有待进一步深入研究。
此外,有研究表明胆碱能异常与Aβ异常沉积之间存在紧密联系,胆碱能缺失可能促进Aβ和tau的病理改变,从而导致认知功能障碍[34]。脑内的Ach主要来源于皮层和基底前脑的胆碱能神经元,在学习记忆与认知功能中起重要作用。FDA批准上市的AD治疗药物主要是胆碱酯酶抑制剂,它们通过抑制Ach水解从而增加脑内Ach水平。本研究结果显示,5月龄APP/PS1小鼠脑组织的皮层和海马脑区均出现Ach水平下降,开心散给药2个月后,中剂量开心散可明显提高大脑皮层中的Ach水平,提示开心散可能通过增加Ach的含量发挥改善学习记忆的功能。
综上所述,本研究发现开心散给药2个月可改善APP/PS1小鼠的学习记忆能力,其作用机制为通过抑制星形胶质细胞和小胶质细胞活化,降低血清中炎症因子TNF-α、IL-6、IL-1β水平,改善神经炎症,降低Aβ的含量,提高神经递质Ach水平,从而发挥对神经元的保护作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Knopman D S, Amieva H, Petersen R C,. Alzheimer disease [J]., 2021, 7(1): 1-21.
[2] Scheltens P, De Strooper B, Kivipelto M,. Alzheimer’s disease [J]., 2021, 397(10284): 1577-1590.
[3] Graff-Radford J, Yong K X X, Apostolova L G,. New insights into atypical Alzheimer’s disease in the era of biomarkers [J]., 2021, 20(3): 222-234.
[4] Leng F D, Edison P. Neuroinflammation and microglial activation in Alzheimer disease: Where do we go from here? [J]., 2021, 17(3): 157-172.
[5] 唐·孙思邈撰, 鲁兆麟主校. 备急千金要方 [M]. 沈阳: 辽宁科学技术出版社, 1997: 222.
[6] Yi P J, Zhang Z Y, Huang S Q,. Integrated meta-analysis, network pharmacology, and molecular docking to investigate the efficacy and potential pharmacological mechanism of Kai-Xin-San on Alzheimer’s disease [J]., 2020, 58(1): 932-943.
[7] Wang N, Jia Y M, Zhang B,. Neuroprotective mechanism of Kai Xin San: Upregulation of hippocampal insulin-degrading enzyme protein expression and acceleration of amyloid-beta degradation [J]., 2017, 12(4): 654-659.
[8] 李牧函, 张静, 赵润清, 等. 6首开心散类方对阿尔兹海默病模型小鼠的药理作用及机制研究 [J]. 中国中药杂志, 2016, 41(7): 1269-1274.
[9] Cao C, Xiao J Y, Liu M Q,. Active components, derived from Kai-Xin-San, a herbal formula, increase the expressions of neurotrophic factor NGF and BDNF on mouse astrocyte primary cultures via cAMP-dependent signaling pathway [J]., 2018, 224: 554-562.
[10] Zhu Y, Chao C, Duan X Z,. Kai-Xin-San series formulae alleviate depressive-like behaviors on chronic mild stressed mice via regulating neurotrophic factor system on hippocampus [J]., 2017, 7(1): 1467.
[11] Zhu Y, Duan X Z, Cheng X X,. Kai-Xin-San, a standardized traditional Chinese medicine formula, up-regulates the expressions of synaptic proteins on hippocampus of chronic mild stress induced depressive rats and primary cultured rat hippocampal neuron [J]., 2016, 193: 423-432.
[12] Smriga M, Saito H, Nishiyama N. Hoelen (Wolf) and ginseng (C. A. Meyer), the ingredients of a Chinese prescription DX-9386, individually promote hippocampal long-term potentiation[J]., 1995, 18(4): 518-522.
[13] Vorhees C V, Williams M T. Morris water maze: Procedures for assessing spatial and related forms of learning and memory [J]., 2006, 1(2): 848-858.
[14] 易娅静, 于颖, 刘旭, 等. 中医药治疗阿尔兹海默病研究进展 [J]. 中医药学报, 2021, 49(4): 99-105.
[15] 宋克立, 刘源香. 中医治疗阿尔茨海默病研究进展 [J]. 西部中医药, 2019, 32(4): 148-151.
[16] 王海霞, 姜宁, 吕静薇, 等. 开心散抗抑郁、改善学习记忆作用及机制研究进展 [J]. 中草药, 2020, 51(14): 3802-3813.
[17] 纪荣芳, 牛建昭, 许树强, 等. 从数据挖掘角度看中医药治疗健忘与痴呆 [J]. 中日友好医院学报, 2006, 20(6): 337-340.
[18] 芦锰, 周雨慧, 李晓宁, 等. 基于数据挖掘中医药治疗阿尔茨海默病用药规律研究 [J]. 中国中药杂志, 2021, 46(6): 1558-1563.
[19] Busche M A, Hyman B T. Synergy between amyloid-β and tau in Alzheimer’s disease [J]., 2020, 23(10): 1183-1193.
[20] Greenberg S M, Bacskai B J, Hernandez-Guillamon M,. Cerebral amyloid angiopathy and Alzheimer disease- one peptide, two pathways [J]., 2020, 16(1): 30-42.
[21] Panza F, Lozupone M, Logroscino G,. A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease [J]., 2019, 15(2): 73-88.
[22] Kwon H S, Koh S H. Neuroinflammation in neurodegenerative disorders: The roles of microglia and astrocytes [J]., 2020, 9(1): 42.
[23] Ransohoff R M. How neuroinflammation contributes to neurodegeneration [J]., 2016, 353(6301): 777-783.
[24] Taipa R, Ferreira V, Brochado P,. Inflammatory pathology markers (activated microglia and reactive astrocytes) in early and late onset Alzheimer disease: A post mortem study [J]., 2018, 44(3): 298-313.
[25] Price B R, Johnson L A, Norris C M. Reactive astrocytes: The nexus of pathological and clinical hallmarks of Alzheimer’s disease [J]., 2021, 68: 101335.
[26] 师冉, 季旭明, 董丽雪, 等. 开心散对快速老化痴呆小鼠SAMP8炎症因子及β-APP影响随机平行对照研究 [J]. 实用中医内科杂志, 2013, 27(13): 101-104.
[27] Guo S, Wang J, Wang Y,. Study on the multitarget synergistic effects of Kai-Xin-San against Alzheimer’s disease based on systems biology [J]., 2019, 2019: 1707218.
[28] Qu S, Liu M, Cao C,. Chinese medicine formula Kai-Xin-San ameliorates neuronal inflammation of CUMS-induced depression-like mice and reduces the expressions of inflammatory factors via inhibiting TLR4/IKK/NF-κB pathways on BV2 cells [J]., 2021, 12: 626949.
[29] Cao C, Liu M, Qu S,. Chinese medicine formula Kai-Xin-San ameliorates depression-like behaviours in chronic unpredictable mild stressed mice by regulating gut microbiota-inflammation-stress system [J]., 2020, 261: 113055.
[30] Kaur D, Sharma V, Deshmukh R. Activation of microglia and astrocytes: A roadway to neuroinflammation and Alzheimer’s disease [J]., 2019, 27(4): 663-677.
[31] Milà-Alomà M, Salvadó G, Gispert J D,. Amyloid beta, tau, synaptic, neurodegeneration, and glial biomarkers in the preclinical stage of the Alzheimer’s continuum [J]., 2020, 16(10): 1358-1371.
[32] Krasemann S, Madore C, Cialic R,. The TREM2-APOE pathway drives the transcriptional phenotype of dysfunctional microglia in neurodegenerative diseases [J]., 2017, 47(3): 566-581.
[33] Arranz A M, De Strooper B. The role of astroglia in Alzheimer’s disease: Pathophysiology and clinical implications [J]., 2019, 18(4): 406-414.
[34] Ramos-Rodriguez J J, Pacheco-Herrero M, Thyssen D,. Rapid β-amyloid deposition and cognitive impairment after cholinergic denervation in APP/PS1 mice [J]., 2013, 72(4): 272-285.
Pharmacological effects of Kaixin San on neuroinflammation and Aβ deposition in APP/PS1 mice
WANG Bin-bin, FENG Xiao-xiao, Entzal Berk, ZHAO Hui, LI Zhao-xia
Beijing Key Laboratory of TCM Collateral Disease Theory Research, School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China
To study the pharmacological effects of Kaixin San (开心散) on Alzheimer’s disease (AD) aninal model, amyloid precursor protein/presenilin 1 (APP/PS1) double transgenic mice.Three-month-old male APP/PS1 mice were randomly divided into model group, memantine group (3.33 mg/kg), low-, medium- and high-dose Kaixin San (0.33, 1.00, 3.00 g/kg) groups. C57BL/6J mice with the same genetic background of same month age were used as control group and control administration (Kaixin San 1.00 g/kg) group, with eight mice in each group. After continuous ig administration for two months, the learning and memory ability of mice was evaluated by Morris water maze test; Hematoxylin-eosin (HE) staining method was used to observe the neuron morphology in hippocampus CA1 area; Congo red staining was used to detect amyloid plaques expression in cortex and hippocampus; Immunohistochemical staining was used to detect amyloid β protein 1-40 (Aβ1-40), glial fibrillary acidic protein (GFAP) and ionized calcium binding adaptor molecule-1 (Iba-1) expressions in cortex and hippocampus; ELISA was used to detect the levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-6 in serum and acetylcholine (Ach) level in cortex and hippocampus.Compared with model group, learning and memory ability of mice in memantine group and Kaixin San group was significantly improved (< 0.05, 0.01), number of neurons in hippocampal CA1 area was increased (< 0.01); Expressions of amyloid plaques, Aβ1-40, GFAP and Iba-1 in cortex and hippocampus were significantly reduced (< 0.05, 0.01); Levels of TNF-α, IL-1β and IL-6 in serum were significantly reduced (< 0.05, 0.01); Ach level in cortex was increased (< 0.01).Kaixin San may prevent and treat AD by inhibiting the activation of astrocytes and microglia, decreasing the levels of inflammatory factors TNF-α, IL-6 and IL-1β in serum, reducing the production of Aβ and amyloid plaques, and increasing the content of Ach.
Kaixin San; Alzheimer’s disease; APP/PS1 double transgenic mice; amyloid β protein; glial fibrillary acidic protein; ionized calcium binding adaptor molecule-1
R285.5
A
0253 - 2670(2021)24 - 7511 - 09
10.7501/j.issn.0253-2670.2021.24.013
2021-09-03
北京市自然科学基金面上项目(7182019)
王彬斌,硕士研究生,研究方向为中药体内过程和作用机制研究。E-mail: missbin1996@163.com
李朝霞,副教授,研究方向为中药体内过程和作用机制研究。E-mail: gmacli@ccmu.edu.cn
[责任编辑 李亚楠]
