鹿血晶通过降低肾小管上皮细胞的5-羟色胺合成及降解抑制顺铂诱导的肾损伤
2021-12-16梁秀睿张誉馨金佳琦傅继华
张 怡,关 晶,徐 凡,梁秀睿,张誉馨,金佳琦,傅继华
• 药理与临床 •
鹿血晶通过降低肾小管上皮细胞的5-羟色胺合成及降解抑制顺铂诱导的肾损伤
张 怡,关 晶,徐 凡,梁秀睿,张誉馨,金佳琦,傅继华*
中国药科大学基础医学与临床药学学院,江苏 南京 210009
探讨鹿血晶保护肾脏以及抑制顺铂诱导肾损伤的作用机制。人肾小管上皮HK-2细胞设对照组、模型组及鹿血晶(160、400、1000 μg/mL)组和单胺氧化酶A(monoamine oxidase A,MAO-A)抑制剂氯吉兰(15 μmol/L)组,加入药物预处理1 h后加入顺铂(20 μmol/L)刺激24 h诱导细胞损伤。雄性ICR小鼠随机分为对照组、模型组及鹿血晶(0.78 g/kg)组,鹿血晶组预给药7 d,然后模型组及鹿血晶组ip顺铂(25 mg/kg)诱导肾损伤,继续治疗3 d后处死动物。检测细胞内丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)、三磷酸腺苷(adenosine triphosphate,ATP)水平、超氧化物歧化酶(superoxide dismutase,SOD)活性、上清液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)水平,以及细胞及小鼠肾组织活性氧(reactive oxygen species,ROS)、5-羟色胺(5-hydroxytryptamine,5-HT)水平;采用荧光探针DCFH-DA、Mito-Tracker Red CMXRos及荧光染料Hoechst 33342分别检测细胞内ROS含量、定位及细胞凋亡情况;Western blotting法检测细胞B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X,Bax)、半胱氨酸蛋白酶-3(Caspase-3)、Caspase-9、NADH脱氢酶1(NADH dehydrogenase 1,ND1)、细胞色素B(cytochrome b,CYTB)、ATP合成酶亚单位6(ATP synthase 6,ATP6)、核因子-κB p65(nuclear factor kappa-B,NF-κB p65)、磷酸化NF-κB p65(phosphorylated NF-κB p65,p-NF-κB p65)、抑制子κBα(inhibitor of NF-κB,IκBα)、p-IκBα蛋白表达,细胞及小鼠肾组织色氨酸羟化酶1(tryptophan hydroxylase,Tph1)、芳香簇氨基酸脱羧酶(aromatic amino acid decarboxylase,AADC)、5-HT2A受体(5-HT2Areceptors,5-HT2AR)、MAO-A蛋白表达;采用苏木素-伊红(HE)染色检测小鼠肾组织病理损伤;采用免疫组化法检测小鼠肾组织Tph1、AADC、5-HT2AR、MAO-A表达。与模型组比较,鹿血晶可抑制HK-2细胞内ROS、MDA及上清液中TNF-α、IL-1β水平(<0.05、0.01),降低细胞内GSH、SOD水平(<0.05、0.01),抑制细胞凋亡。鹿血晶(1000 μg/mL)组与氯吉兰组的作用效果接近,两组对顺铂诱导NF-κB p65磷酸化、细胞凋亡激活(Bax、Caspase-3、Caspase-9表达上调及Bcl-2表达下调)、呼吸链功能下降(ND1、CYTB、ATP6表达下调及ATP水平降低)的逆转作用也接近。并且,鹿血晶(1000 μg/mL)组可明显抑制顺铂诱导的HK-2细胞Tph1、AADC、5-HT2AR、MAO-A表达上调以及5-HT含量升高(<0.05、0.01),而氯吉兰组使5-HT水平进一步升高(<0.01)。荧光探针检测表明,线粒体是顺铂刺激时HK-2细胞产生ROS的部位,且鹿血晶(1000 μg/mL)组和氯吉兰组对其有相似的抑制效果。HE染色显示,顺铂致小鼠肾组织损伤的部位主要在近端肾小管上皮细胞,免疫组化显示该部位也是Tph1、AADC、5-HT2AR、MAO-A表达上调最明显的部位。鹿血晶可抑制顺铂诱导的Tph1、AADC、5-HT2AR、MAO-A蛋白表达的上调及肾组织5-HT、ROS含量升高(<0.01)。鹿血晶活性成分抑制顺铂诱导肾损伤的机制可能是直接作用于肾脏近端肾小管上皮细胞,抑制顺铂对细胞Tph1、AADC、5-HT2AR、MAO-A表达的上调,从而抑制细胞的5-HT合成及线粒体5-HT降解,达到抑制线粒体ROS生成、保护呼吸链,最终抑制氧化应激、炎症、细胞凋亡的效果。
鹿血晶;近端肾小管上皮细胞;线粒体;5-羟色胺合成;5-羟色胺降解;活性氧
鹿血为鹿科动物梅花鹿和马鹿的血液,系名贵中药。研究表明,鹿血可以增加放化疗患者的白细胞,在延缓衰老、增强免疫、抗疲劳、保护肾脏等方面也有明显疗效[1-2],故临床上常辅助用于肿瘤患者放化疗后的康复性治疗。常用的广谱抗肿瘤药物顺铂[3]可在肾脏的近端肾小管积累而造成急性肾损伤(acute kidney injury,AKI)[4-6],这是临床上顺铂等化疗药物难以避免的不良反应,而鹿血类产品可以明显保护肾脏、减轻顺铂对肾脏的损伤作用。本课题组前期研究证实,鹿血类产品——鹿血晶(一种鹿血的冷冻干燥制剂)可保护小鼠肾脏,明显减轻顺铂诱导的AKI、保护肾功能[7]。
AKI是指患者肾功能在短时间内迅速下降,导致血清肌酐和尿素氮浓度急剧升高,肾脏出现明显病理损伤[8]的一种临床表现。研究发现,AKI时肾脏的主要病变区域为近端肾小管上皮细胞,病变细胞的线粒体呼吸链受损,导致活性氧(reactive oxygen species,ROS)生成增多,从而使肾组织出现氧化应激、炎症、细胞凋亡[9-10]。鹿血晶可以保护肾脏并抑制顺铂诱导的肾脏ROS产生、氧化应激、炎症及细胞凋亡[7]。然而,鹿血中的活性成分保护肾脏、抑制顺铂诱导的ROS产生的作用机制尚不明确。课题组前期研究发现,细胞氧化应激、炎症的发生与细胞内5-羟色胺(5-hydroxytryptamine,5-HT)在线粒体单胺氧化酶A(monoamine oxidase A,MAO-A)催化下的降解升高密切相关,还牵涉到5-HT合成酶色氨酸羟化酶1(tryptophan hydroxylase-1,Tph1)及芳香族氨基酸脱羧酶(aromatic amino acid decarboxylase,AADC)、5-HT2A受体(5-HT2Areceptors,5-HT2AR)的激活[11-14]。本研究以顺铂刺激人肾小管上皮HK-2细胞,模拟顺铂诱导AKI时对肾小管上细胞的损伤作用,结合顺铂诱导小鼠AKI的动物模型考察鹿血晶对肾脏的保护作用是否与抑制5-HT降解有关,并评估鹿血晶对顺铂诱导HK-2细胞5-HT合成酶、5-HT2AR、MAO-A表达上调的影响,以探究鹿血晶保护肾脏、抑制顺铂诱导AKI的作用机制。
1 材料
1.1 细胞
HK-2细胞购自中国科学院细胞库。
1.2 动物
清洁级雄性ICR小鼠,6~8周龄,体质量18~22 g,购自扬州大学比较医学中心,动物许可证号SCXK(苏)2017-0007。动物饲养于中国药科大学药学动物实验中心,环境温度23~26 ℃,湿度50%~55%,12 h昼夜光照交替,自由进食饮水。动物实验遵循中国药科大学有关实验动物管理和使用的规定,符合3R原则。
1.3 药品与试剂
鹿血晶冻干粉末(批号L190504)购自苏州红冠庄国药股份有限公司;顺铂购自上海阿拉丁生化科技股份有限公司;氯吉兰购自上海CSN公司;DMEM低糖培养基购自美国Hyclone公司;胰蛋白酶购自美国Gibco公司;胎牛血清购自上海Excell公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(reduced glutathione,GSH)、三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒购自南京建成生物工程研究所;ROS、5-HT、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒购自上海酶联生物科技有限公司;BCA试剂、Hoechst 33342染料、ROS荧光探针DCFH-DA、Mito-Tracker Red CMXRos购自上海碧云天生物科技有限公司;Tph1抗体购自美国SAB公司;抑制子κBα(inhibitor kappa Bα,IκBα)、核因子κB p65(nuclear factor kappa B p65,NF-κB p65)及其磷酸化抗体、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体购自沈阳万类生物科技有限公司;5-HT2AR抗体、半胱氨酸蛋白酶-3(Caspase-3)抗体、Caspase-9抗体购自美国Santa公司;GAPDH抗体、AADC抗体、MAO-A抗体、NADH脱氢酶1(NADH dehydrogenase 1,ND1)抗体、细胞色素B(cytochrome B,CYTB)抗体、ATP合成酶亚单位6(ATP synthase 6,ATP6)抗体购自武汉三鹰生物科技有限公司;HRP标记的山羊抗兔IgG抗体、HRP标记的山羊抗小鼠IgG抗体购自Biosharp生物科技有限公司。
1.4 仪器
Infinite M2000 Pro全波长酶标仪(德国Tecan公司);IX51型荧光倒置显微镜(日本Olympus公司);TS2-S-SM型倒置荧光显微镜(日本Nikon公司);5200 Multi全自动化学发光系统(上海天能有限公司);1300型生物安全柜、Forma II型水套式CO2恒温培养箱(美国Thermo Fisher Scientific公司)。
2 方法
2.1 体外实验
2.1.1 HK-2细胞培养 HK-2细胞用含青霉素、链霉素及10%胎牛血清的DMEM低糖培养基,于37 ℃、5% CO2细胞培养箱中培养,细胞融合度达60%~80%传代。
2.1.2 鹿血晶对顺铂诱导的HK-2细胞ROS、MDA、GSH水平、SOD活性及上清液中TNF-α、IL-1β水平的影响 取处于对数生长期的HK-2细胞,以5×104/mL接种于6孔板,培养12 h。通过MTT实验确定不同质量浓度的鹿血晶对HK-2细胞活力的影响,然后设置对照组、模型组及鹿血晶(160、400、1000 μg/mL)组和氯吉兰(15 μmol/L)组。实验时,称取1 g鹿血晶冻干粉末,溶于20 mL PBS溶液,于超净台中用0.22 μm孔径的滤器滤过除菌,即得无菌的鹿血晶母液(50 mg/mL),以培养基稀释至所需浓度。各给药组加入相应药物预处理1 h,模型组和各给药组再加入顺铂(20 μmol/L)处理24 h;对照组加入不含药物的无血清培养基处理24 h。收集细胞,按照试剂盒说明进行MTT实验或检测ROS、MDA、GSH水平和SOD活性;收集上清液,按照试剂盒说明检测TNF-α、IL-1β水平。
2.1.3 鹿血晶对顺铂诱导的HK-2细胞凋亡的影响 按“2.1.2”项下方法分组并处理细胞,弃去培养液,用荧光染料Hoechst 33342染色,采用荧光显微镜(激发波长350 nm、发射波长460 nm)DAPI通道(蓝色荧光)观察细胞凋亡情况。
2.1.4 鹿血晶对顺铂诱导的HK-2细胞IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Bax、Bcl-2、Caspase-3、Caspase-9、ND1、CYTB、ATP6、5-HT2AR、Tph1、AADC和MAO-A蛋白表达的影响 设置对照组、模型组、鹿血晶(1000 μg/mL)组和氯吉兰(15 μmol/L)组,按“2.1.2”项下方法处理细胞,收集细胞。加入含蛋白酶抑制剂和磷酸酶抑制剂的IP裂解液,于 −80 ℃裂解,12 000 r/min离心,取上清液。采用BCA蛋白定量试剂盒测定蛋白质量浓度,加入上样缓冲液稀释蛋白样品,100 ℃沸水浴5 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转至PVDF膜,于牛血清白蛋白中封闭,分别加入IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Bax、Bcl-2、Caspase-3、Caspase-9、ND1、CYTB、ATP6、5-HT2AR、Tph1、AADC、MAO-A、GAPDH抗体,4 ℃孵育过夜,TBST洗涤;加入HRP标记的山羊抗兔IgG抗体(1∶20 000)或HRP标记的山羊抗小鼠IgG抗体(1∶80 000)抗体,室温孵育,TBST洗涤后置ECL发光液中显色,采用全自动化学发光系统观察并拍照,Image J软件分析条带灰度值。
2.1.5 鹿血晶对顺铂诱导的HK-2细胞ATP和5-HT含量的影响 设置对照组、鹿血晶(1000 μg/mL)组、氯吉兰(15 μmol/L)组、模型组、顺铂+鹿血晶(1000 μg/mL)组和顺铂+氯吉兰(15 μmol/L)组,按“2.1.2”项下方法处理细胞,收集细胞,按照试剂盒说明书检测细胞ATP含量。
设置对照组、模型组、鹿血晶(1000 μg/mL)组和氯吉兰(15 μmol/L)组,按“2.1.2”项下方法处理细胞,收集细胞,按照试剂盒说明书检测细胞5-HT含量。
2.1.6 鹿血晶对顺铂诱导的HK-2细胞内ROS含量及定位的影响 设置对照组、模型组、鹿血晶(1000 μg/mL)组和氯吉兰(15 μmol/L)组,按“2.1.2”项下方法处理细胞,弃去细胞培养液,用ROS荧光探针DCFH-DA、线粒体荧光探针Mito-Tracker Red CMXRos染色,采用激光共聚焦显微镜(ROS:激发波长488 nm,发射波长525 nm;线粒体:激发波长568 nm,发射波长579 nm)观察细胞内ROS及线粒体表达。
2.2 体内实验
2.2.1 动物分组、造模与给药 ICR小鼠随机分为对照组、模型组和鹿血晶(0.78 g/kg)[13]组。鹿血晶组ig药物,对照组和模型组ig 0.5%羧甲基纤维素钠(CMC-Na),2次/d,连续7 d;禁食不禁水12 h后,模型组和鹿血晶组ip顺铂(25 mg/kg)诱导肾损伤,对照组ip 0.9%氯化钠溶液。造模后各给药组ig药物,2次/d,连续3 d。给药结束后眼框取血,小鼠脱颈椎处死,取两侧肾脏。
2.2.2 鹿血晶对AKI小鼠肾组织病理变化的影响 取小鼠肾组织,于10%福尔马林中固定,梯度乙醇脱水,经无水乙醇和二甲苯处理使组织透明;石蜡包埋后切片(厚5 μm),进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.2.3 免疫组化法检测鹿血晶对AKI小鼠肾组织5-HT2AR、Tph1、AADC和MAO-A蛋白表达的影响 取各组小鼠肾组织,石蜡包埋后切片(5 μm厚),进行免疫组化染色:石蜡切片脱蜡封闭后,分别加入Tph1、AADC、5-HT2AR和MAO-A抗体,4 ℃孵育过夜;洗涤后滴加生物素标价的IgG抗体,37 ℃静置30 min;洗涤后加入HRP标记的链霉素卵白素工作液,37 ℃孵育15 min;洗涤后滴加DAB显色液避光显色,苏木精复染,中性树脂封片,于显微镜下观察并拍照。
2.2.4 Western blotting法检测鹿血晶对AKI小鼠肾组织5-HT2AR、Tph1、AADC和MAO-A蛋白表达的影响 取各组小鼠肾组织,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,按“2.1.4”项下方法提取蛋白并检测5-HT2AR、Tph1、AADC、MAO-A蛋白表达。
2.2.5 鹿血晶对AKI小鼠肾组织5-HT和ROS含量的影响 取各组小鼠肾组织,按照试剂盒说明检测5-HT和ROS含量。
2.3 统计分析
3 结果
3.1 鹿血晶对顺铂诱导的HK-2细胞活力的影响
MTT实验结果显示(图1),20 μmol/L顺铂刺激HK-2细胞24 h,细胞活力仍可达到对照组的43%,可用于后续研究。而预先加入鹿血晶(160、400、1000 μg/mL)或MAO-A抑制剂氯吉兰(15 μmol/L)处理1 h后再同时加入顺铂处理细胞24 h,不仅不会使细胞活力进一步下降,反而可轻度提高细胞活力(细胞活力提高10%~20%)。因此,以上述剂量进行后续研究。

与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同
3.2 鹿血晶对顺铂诱导的HK-2细胞ROS、MDA、GSH水平、SOD活性及上清液中TNF-α、IL-1β水平的影响
如表1所示,与对照组比较,模型组细胞内ROS、MDA水平明显升高(<0.01),SOD活力、GSH水平明显降低(<0.01),上清液中TNF-α、IL-1β水平显著升高(<0.01);与模型组比较,各给药组细胞内ROS、MDA水平明显降低(<0.01),SOD活力、GSH水平明显升高(<0.01),上清液中TNF-α、IL-1β水平显著降低(<0.01),且鹿血晶3个剂量组间也有明显差异(<0.05、0.01),成剂量相关性;鹿血晶(1000 μg/mL)组的作用效果与氯吉兰组接近。表明鹿血晶及氯吉兰均可明显抑制顺铂诱导的HK-2细胞ROS生成、氧化应激反应及炎症因子分泌。

表1 鹿血晶对顺铂诱导的HK-2细胞ROS、MDA、GSH水平、SOD活性及上清液中TNF-α、IL-1β水平的影响(, n = 4)
与对照组比较:**<0.01;与模型组比较:##<0.01;与鹿血晶(160 μg·mL−1)组比较:△△<0.01;与鹿血晶(400 μg·mL−1)组比较:▲<0.05▲▲<0.01
**< 0.01control group;##< 0.01model group;△△< 0.01deer blood crystal (160 μg·mL−1) group;▲< 0.05▲▲< 0.01deer blood crystal (400 μg·mL−1) group
3.3 鹿血晶对顺铂诱导的HK-2细胞凋亡的影响
如图2所示,与对照组相比,模型组细胞核的Hoechst 33342荧光蓝染明显变亮,提示顺铂刺激使HK-2细胞出现凋亡;给予鹿血晶和氯吉兰后,细胞的Hoechst 33342荧光蓝染亮度明显降低,且鹿血晶的作用呈剂量相关性,而鹿血晶(1000 μg/mL)组的作用效果与氯吉兰组接近。因此后续以1000 μg/mL鹿血晶研究其抑制顺铂诱导细胞损伤的作用机制。
3.4 鹿血晶对顺铂诱导的HK-2细胞IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Bax、Bcl-2、Caspase-3、Caspase-9蛋白表达的影响
如图3所示,与对照组比较,模型组细胞NF-κB p65、IκBα磷酸化水平显著升高(<0.01),Bax、Caspase-3、Caspase-9蛋白表达水平显著升高(<0.01),Bcl-2蛋白表达水平显著降低(<0.01),提示顺铂刺激使HK-2细胞NF-κB炎症信号通路及细胞凋亡通路激活。与模型组比较,各给药组NF-κB p65、IκBα磷酸化水平显著降低(<0.01),Bax、Caspase-3、Caspase-9蛋白表达水平显著降低(<0.01),Bcl-2蛋白表达水平显著升高(<0.05)。

图2 鹿血晶对顺铂诱导的HK-2细胞凋亡的影响 (×400)

图3 鹿血晶对顺铂诱导的HK-2细胞IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Bax、Bcl-2、Caspase-3、Caspase-9蛋白表达的影响(, n = 3)
3.5 鹿血晶对顺铂诱导的HK-2细胞线粒体呼吸链功能损伤的影响
如图4所示,与对照组比较,模型组细胞呼吸链蛋白ND1、CYTB及ATP6蛋白表达水平明显降低(<0.05、0.01),细胞内ATP含量明显降低(<0.01),提示顺铂可明显损伤HK-2细胞线粒体呼吸链功能、抑制ATP合成;与模型组比较,各给药组均可显著抑制顺铂对呼吸链功能的破坏作用(<0.05、0.01),使ND1、CYTB、ATP6蛋白表达及细胞内ATP含量恢复到接近对照组水平,且鹿血晶和氯吉兰的作用效果接近。

图4 鹿血晶对顺铂诱导的HK-2细胞ND1、CYTB、ATP6蛋白表达及ATP含量的影响(, n = 3)
3.6 鹿血晶对顺铂诱导的HK-2细胞5-HT系统激活及线粒体ROS生成的影响
如图5所示,与对照组相比,模型组细胞内5- HT2AR、Tph1、AADC及MAO-A蛋白表达水平明显升高(<0.01),5-HT含量升高(<0.01)。如图6所示,经DCFH-DA荧光探针染色,还检测到细胞内ROS含量明显升高;通过细胞内ROS、线粒体荧光探针双定位,发现顺铂诱导HK-2细胞ROS产生的部位为线粒体,两者定位重叠,提示顺铂刺激使HK-2细胞内5-HT合成酶、5-HT2AR、MAO-A同时激活,使细胞内5-HT含量及线粒体5-HT降解、ROS产生同时增多。
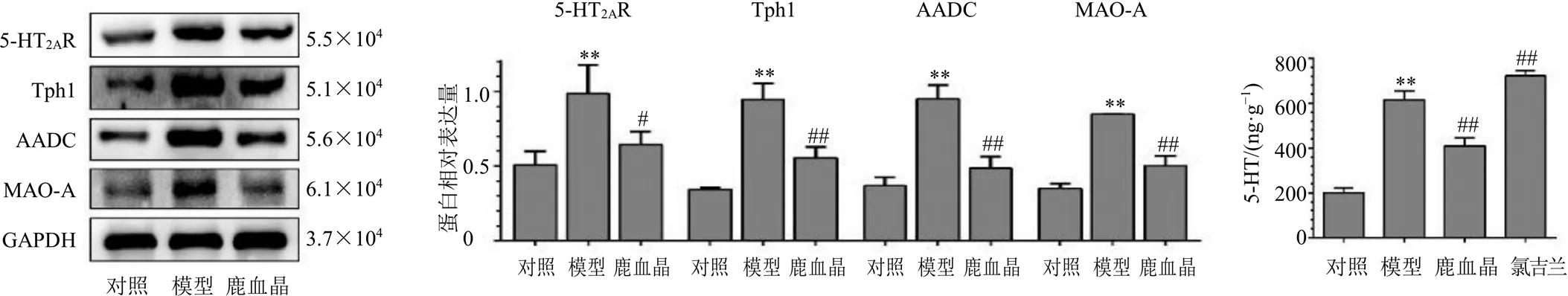
图5 鹿血晶对顺铂诱导的HK-2细胞5-HT2AR、Tph1、AADC、MAO-A蛋白表达及细胞内5-HT含量的影响(, n = 3)
与模型组比较,鹿血晶组细胞内5-HT2AR、Tph1、AADC及MAO-A蛋白表达水平明显降低(<0.01),5-HT含量降低(<0.01),但氯吉兰使细胞内5-HT含量进一步升高(<0.01);鹿血晶及氯吉兰组均降低细胞内及线粒体内ROS含量,且二者作用相似。提示,鹿血晶、氯吉兰对顺铂诱导的HK-2细胞5-HT降解、线粒体ROS产生的抑制作用是相同的;但鹿血晶还可抑制5-HT合成酶及5-HT2AR的上调、抑制5-HT合成,而氯吉兰不仅不能抑制5-HT合成使细胞内5-HT含量降低,反而使细胞内5-HT含量进一步升高。

图6 鹿血晶对顺铂诱导的HK-2细胞内ROS含量及定位的影响(×1000)
3.7 鹿血晶对AKI小鼠肾组织病理变化的影响
肾组织切片HE染色(图7)表明,与对照组相比,模型组小鼠肾小球周围肾小管(即近端肾小管)发生明显病变,出现肾小管上皮细胞脱落、坏死、空泡化,管形破坏;与模型组比较,鹿血晶组小鼠近端肾小管破坏明显减轻。

图7 鹿血晶对AKI小鼠肾组织病理变化的影响 (×400)
3.8 鹿血晶对AKI小鼠肾组织5-HT系统表达的影响
如图8所示,肾组织切片免疫组化检测显示,与对照组比较,模型组小鼠肾组织Tph1、AADC、5-HT2AR、MAO-A蛋白表达水平显著(<0.01),且蛋白表达量最高的细胞为近端肾小管上皮细胞,与肾组织的病变部位一致,肾组织5-HT、ROS含量也明显升高(<0.01);与模型组比较,鹿血晶组肾组织Tph1、AADC、5-HT2AR、MAO-A蛋白表达水平明显降低(<0.01),5-HT和ROS含量明显降低(<0.01)。

A-免疫组化法检测肾组织5-HT2AR、Tph1、AADC、MAO-A表达 (×400) B-Western blotting法检测肾组织5-HT2AR、Tph1、AADC、MAO-A蛋白表达 (n=4) C-肾组织5-HT、ROS含量 (n=10)
4 讨论
本研究揭示了鹿血晶对顺铂诱导的肾小管上皮细胞损伤具有直接的保护作用,且这种保护作用具有剂量相关性,与动物实验发现的“鹿血晶可剂量相关性地抑制顺铂诱导的AKI”结果一致[7]。表明鹿血晶中确实存在活性成分,可直接作用于肾脏,保护肾脏免受顺铂等毒物对肾脏的损伤作用、保护肾功能。结果表明,鹿血晶可剂量相关性地抑制顺铂诱导的HK-2细胞ROS产生、氧化应激、炎症因子分泌、细胞凋亡;鹿血晶的这种作用与抑制顺铂诱导的NF-κB炎症信号通路、细胞凋亡通路(Bax、Caspase3、Caspase9表达上调及Bcl-2表达下调)激活有关。鹿血晶还可保护线粒体,抑制顺铂对线粒体呼吸链功能的破坏(呼吸链蛋白ND1、CYTB和ATP6下调,ATP合成减少)。鹿血晶的以上作用与氯吉兰的作用完全相同;而氯吉兰的直接作用是抑制MAO-A对单胺类的降解作用,使降解过程时产生的ROS减少[15-17]。顺铂诱导的HK-2细胞ROS产生部位就是线粒体,而MAO-A正是位于线粒体的外膜上。因此,可以推测,鹿血晶对肾小管上皮细胞的保护作用可能是通过抑制线粒体MAO-A催化的5-HT降解,从而抑制ROS生成、恢复呼吸链功能实现的。
研究表明,5-HT参与肾脏的病理状态。近端肾小管细胞已被证明可高水平表达AADC[18],5-HT高水平合成可导致慢性肾病并发尿毒症[19]。在人系膜细胞,5-HT刺激5-HT2AR后产生大量ROS[20],通过调节下游细胞因子的表达,引起组织炎症、损伤和死亡[21]。本课题组前期研究也发现,5-HT参与糖尿病肾损伤的发生[14];并揭示出细胞5-HT降解系统调控ROS产生的机制[11,13,22]:由于5-HT合成增多、5-HT2AR及MAO-A表达上调,使线粒体MAO-A催化的5-HT降解增多,导致线粒体ROS生成增多、呼吸链受损ATP合成减少;其中,5-HT2AR的作用是同时介导5-HT合成酶Tph1、AADC的表达及MAO-A的表达,从而调控线粒体5-HT降解。顺铂诱导AKI的机制也是如此[23]。本研究表明,鹿血晶能够明显抑制顺铂对HK-2细胞及小鼠肾脏Tph1、AADC、5-HT2AR、MAO-A表达的上调作用,抑制HK-2细胞及肾组织内5-HT水平升高、5-HT降解。肾组织切片HE染色及Tph1、AADC、5-HT2AR、MAO-A免疫组化染色结果显示,AKI小鼠肾损伤部位就是这些蛋白的高表达部位,位于肾小球周围的肾小管上皮细胞,与文献报道的“AKI肾损伤部位-近端肾小管”一致[10,23]。因此,顺铂诱导肾小管上皮细胞线粒体ROS产生增多、呼吸链功能损伤,从而导致细胞损伤,起因于其对细胞5-HT降解系统的激活。
综上所述,推测鹿血晶保护肾脏、抑制顺铂诱导AKI的机制如下(图9):鹿血晶活性成分可直接作用于肾脏近端肾小管上皮细胞,抑制顺铂对细胞的损伤作用;其作用机制是抑制顺铂对细胞Tph1、AADC、5-HT2AR、MAO-A的上调作用,从而抑制细胞的5-HT合成及线粒体5-HT降解导致的ROS生成、呼吸链功能损伤,而细胞发生氧化应激、炎症、细胞凋亡等病变正是起因于线粒体ROS产生增多[11,13,23]。因此,鹿血晶保护肾功能、抑制顺铂诱导AKI,是通过抑制肾小管上皮细胞的5-HT降解系统激活实现的。
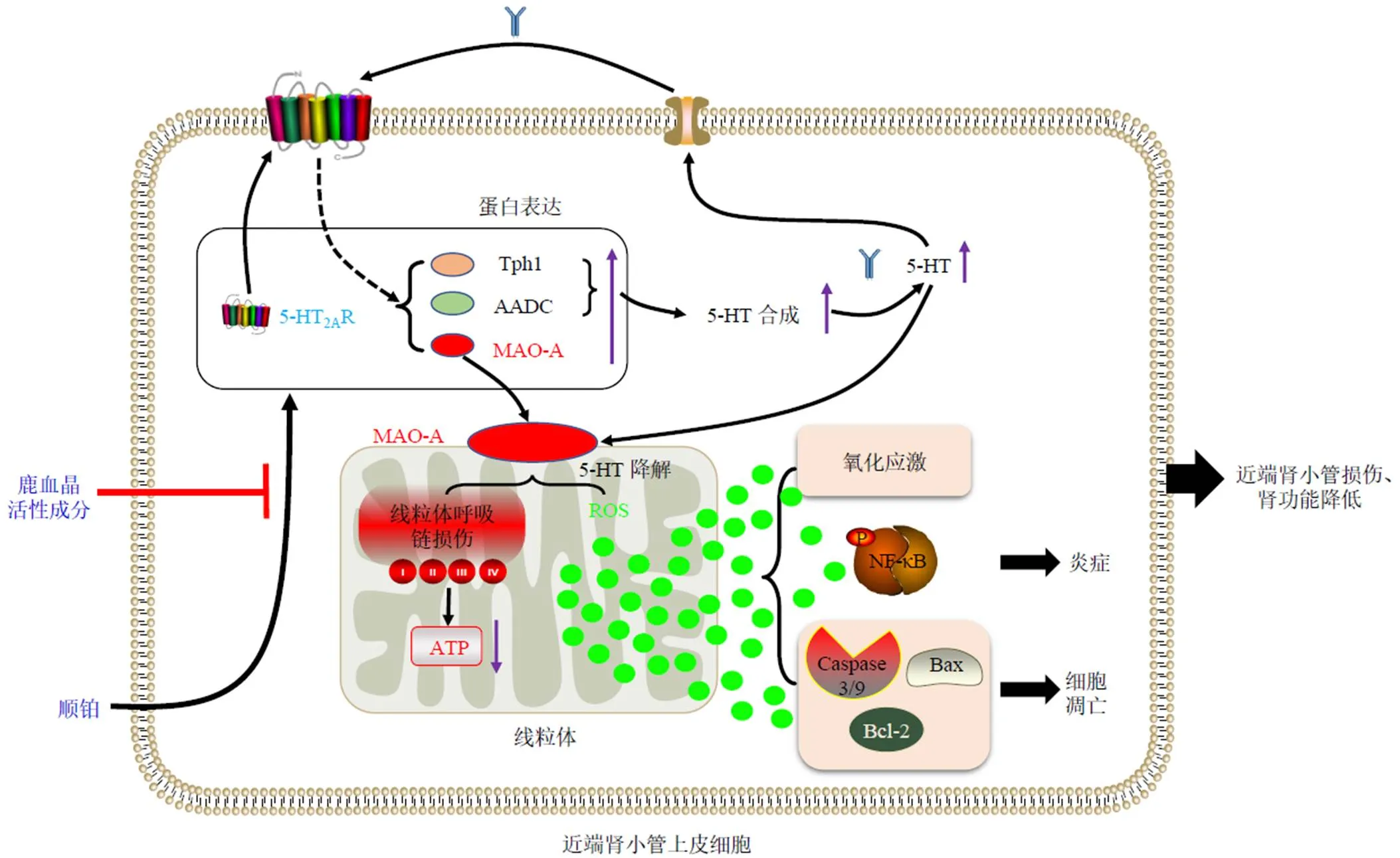
图9 鹿血晶抑制顺铂诱导肾小管上皮细胞损伤的机制
利益冲突 所有作者均声明不存在利益冲突
[1] 袁相恋, 薄士儒, 李庆杰, 等. 鹿血化学成分和药理作用及其应用研究进展 [J]. 经济动物学报, 2011, 15(4): 207-211.
[2] 韩淑芳, 邵志强, 吴双福. 鹿血口服液对肾阳虚和抗应激药理研究 [J]. 中国林副特产, 2002(2): 8-9.
[3] Ghosh S. Cisplatin: The first metal based anticancer drug [J]., 2019, 88: 102925.
[4] Shiraishi F, Curtis L M, Truong L,. Heme oxygenase-1 gene ablation or expression modulates cisplatin-induced renal tubular apoptosis [J]., 2000, 278(5): F726-F736.
[5] Dupre T V, Doll M A, Shah P P,. Suramin protects from cisplatin-induced acute kidney injury [J]., 2016, 310(3): F248-F258.
[6] Lebwohl D, Canetta R. Clinical development of platinum complexes in cancer therapy: An historical perspective and an update [J]., 1998, 34(10): 1522-1534.
[7] 张怡, 徐凡, 金佳琦, 等. 鹿血晶对顺铂诱导小鼠急性肾损伤的保护作用 [J/OL]. 中成药, [2021-04-19]. http://kns.cnki.net/kcms/detail/31.1368.R.20210416.1737. 002.html.
[8] Hoste E A J, Kellum J A, Selby N M,. Global epidemiology and outcomes of acute kidney injury [J]., 2018, 14(10): 607-625.
[9] Gonsalez S R, Cortês A L, Silva R C D,. Acute kidney injury overview: From basic findings to new prevention and therapy strategies [J]., 2019, 200: 1-12.
[10] Holditch S J, Brown C N, Lombardi A M,. Recent advances in models, mechanisms, biomarkers, and interventions in cisplatin-induced acute kidney injury [J]., 2019, 20(12): 3011.
[11] Ma Y Y, Liang X R, Li C,. 5-HT2Areceptor and 5-HT degradation play a crucial role in atherosclerosis by modulating macrophage foam cell formation, vascular endothelial cell inflammation, and hepatic steatosis [J]., 2021, doi: 10.5551/jat.58305.
[12] 张誉馨, 张锐, 杨静, 等. 2型糖尿病引起的疲劳与骨骼肌5-羟色胺降解的相关性研究 [J]. 药学学报, 2021, 56(1): 190-200.
[13] Fu J, Li C, Zhang G,. Crucial roles of 5-HT and 5-HT2 receptor in diabetes-related lipid accumulation and pro-inflammatory cytokine generation in hepatocytes [J]., 2018, 48(6): 2409-2428.
[14] 徐凡, 杨静, 金佳琦, 等. 肾脏5-羟色胺合成和降解在高血糖诱导肾损伤时的作用研究 [J/OL]. 药学学报, [2021-04-07]. https://doi.org/10.16438/j.0513-4870.2021-0152.
[15] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算 [J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.
[16] Guimarães J T, Soares-da-Silva P. The activity of MAO A and B in rat renal cells and tubules [J]., 1998, 62(8): 727-737.
[17] Chaaya R, Alfarano C, Guilbeau-Frugier C,. Pargyline reduces renal damage associated with ischaemia-reperfusion and cyclosporin [J]., 2011, 26(2): 489-498.
[18] Manni M E, Bigagli E, Lodovici M,. The protective effect of losartan in the nephropathy of the diabetic rat includes the control of monoamine oxidase type A activity [J]., 2012, 65(4): 465-471.
[19] Hafdi Z, Couette S, Comoy E,. Locally formed 5-hydroxytryptamine stimulates phosphate transport in cultured opossum kidney cells and in rat kidney [J]., 1996, 320 (Pt 2): 615-621.
[20] Pawlak D, Znorko B, Kalaska B,. LP533401 restores bone health in 5/6 nephrectomized rats by a decrease of gut-derived serotonin and regulation of serum phosphate through the inhibition of phosphate co-transporters expression in the kidneys [J]., 2018, 113: 124-136.
[21] Greene E L, Houghton O, Collinsworth G,. 5-HT(2A) receptors stimulate mitogen-activated protein kinase via H(2)O(2) generation in rat renal mesangial cells [J]., 2000, 278(4): F650-F658.
[22] Li X, Guo K K, Li T,. 5-HT 2 receptor mediates high-fat diet-induced hepatic steatosis and very low density lipoprotein overproduction in rats [J]., 2018, 12(1): 16-28.
[23] Guan J, Tong X, Zhang YNephrotoxicity induced by cisplatin is primarily due to the activation of the 5-hydroxytryptamine degradation system in proximal renal tubules [J],2021,doi: 10.1016/j.cbi.2021.109662.
Deer blood crystal inhibits cisplatin-induced kidney injury by reducing synthesis and degradation of 5-HT in renal tubular epithelial cells
ZHANG Yi, GUAN Jing, XU Fan, LIANG Xiu-rui, ZHANG Yu-xin, JIN Jia-qi, FU Ji-hua
School of Basic Medicine and Clinical Pharmacy, China Pharmaceutical University, Nanjing 210009, China
To explore the mechanism of deer blood crystal (DBC) on protecting the kidney and inhibiting cisplatin-induced kidney injury.HK-2 cells were divided into control group, model group, DBC (160, 400, 1000 μg/mL) groups and monoamine oxidase A (MAO-A) inhibitor clorgyline (15 μmol/L) group, drug were added to pretreat for 1 h, and then the cells were exposed to cisplatin (20 μmol/L) for 24 h to induce cell damage. Male ICR mice were randomly divided into control group, model group and DBC (0.78 g/kg) group, after pretreatment with DBC for 7 d, kidney injury was induced by ip cisplatin (25 mg/kg) in model and DBC group; Furthermore, mice were still treated for 3 d and then killed. Malondialdehyde (MDA), glutathione (GSH), adenosine triphosphate (ATP) levels, superoxide dismutase (SOD) activity in cells and tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) levels in supernatant were measured, reactive oxygen species (ROS) and 5-hydroxytryptamine (5-HT) levels in cells and kidney tissue of mice were measured. ROS content, location and apoptosis of HK-2 cells were respectively distinguished by fluorescent probe DCFH-DA, Mito-Tracker Red CMXRos and fluorescent dye Hoechst 33342.Western blotting was used to analyze the protein expressions of B-cell lymphoma-2 (Bcl-2), Bcl-2-associated X protein (Bax), Caspase-3, Caspase-9, NADH dehydrogenase 1 (ND1), cytochrome B (CYTB), ATPase 6 (ATP6), nuclear factor-κB p65 (NF-κB p65), phosphorylated NF-κB p65 (p-NF-κB p65), inhibitor κBα (IκBα) and p-IκBα in cells, and tryptophan hydroxylase 1 (Tph1), aromatic cluster amino acid decarboxylase (AADC), 5-HT2Areceptor (5-HT2AR), MAO-A protein expressions in cells and kidney tissue of mice. Hematoxylin-eosin (HE) staining was used to detect the pathological damage of renal tissues; Immunohistochemistry was used to detect expressions of Tph1, AADC, 5-HT2AR, and MAO-A in renal tissues.Compared with model group, elevation of intracellular ROS, MDA levels and supernatant TNF-α, IL-1β levels were inhibited by DBC (< 0.05, 0.01), intracellular GSH, SOD levels were reduced (< 0.05, 0.01), and apoptosis in HK-2 cells were reduced. Effect of DBC (1000 μg/mL) group was similar to that of clorgyline group, and reversal effects of both on cisplatin-induced phosphorylation of NF-κB p65, activation of apoptosis (upregulation of Bax, Caspase-3, Caspase-9 expressions, and downregulation of Bcl-2 expression), and decline of respiratory chain function (downregulation of ND1, CYTB and ATP6 expressions, and reduction of ATP level) were also similar in HK-2 cells. Additionally, the upregulation of Tph1, AADC, 5-HT2AR, MAO-A expression, and increased 5-HT levels in HK-2 cells induced by cisplatin were significantly inhibited in DBC (1000 μg/mL) group (< 0.05, 0.01), while the level of 5-HT was even higher in clorgyline group (< 0.01). Fluorescence probe detection showed that mitochondria was the site of ROS production in HK-2 cells induced by cisplatin, and the inhibitory effect of DBC (1000 μg/mL) group and clorgyline group on ROS production was similar. HE staining showed that the damage site of renal tissue induced by cisplatin was mainly in the proximal renal tubular epithelial cells, and it was the site of the highest upregulation of Tph1, AADC, 5-HT2AR and MAO-A expressions induced by cisplatin as shown by immunohistochemistry. DBC could suppressed the upregulation of Tph1, AADC, 5-HT2AR and MAO-A protein expressions and the increase of 5-HT and ROS levels induced by cisplatin in renal tissue (< 0.01).The mechanism of inhibiting cisplatin-induced kidney injury by active components of DBC is probably to directly act on the renal proximal tubular epithelial cells, suppressing the upregulation of Tph1, AADC, 5-HT2AR and MAO-A expressions induced by cisplatin, thus inhibiting the synthesis of 5-HT and mitochondrial 5-HT degradation, inhibiting ROS production and protecting mitochondrial respiratory chain, so as to inhibit oxidative stress, inflammation and apoptosis.
deer blood crystal; renal proximal tubular epithelial cells; mitochondrion; synthesis of 5-hydroxytryptamine; degradation of 5-hydroxytryptamine; reactive oxygen species
R285.5
A
0253 - 2670(2021)24 - 7501 - 10
10.7501/j.issn.0253-2670.2021.24.012
2021-08-03
国家自然科学基金资助项目(81570720)
张 怡(1996—),女,硕士,从事肾脏急性损伤的病理机制及相关药理学研究。Tel: 15895908069 E-mail: zy578546102@qq.com
傅继华(1962—),男,副教授,硕士生导师,从事肝肾损伤、代谢异常性疾病的发病机制研究及相关疾病治疗的药理学研究。Tel: 13951933013 E-mail: fjhfy_cpu@163.com; jihua_fu@cpu.edu.cn
[责任编辑 李亚楠]
