CD38 在人狼疮肾炎血中的表达及临床意义
2021-12-16崔道林陈春丽
崔道林,陈春丽
(曲靖医学高等专科学校基础医学院,云南曲靖 655000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种机制不详的自身免疫性疾病,其主要特征是存在致病性自身抗体、免疫失调和慢性炎症〔1〕。中性粒细胞、巨噬细胞和树突状细胞等免疫细胞的浸润,可导致全身各组织和器官受损,以肾损伤为主。狼疮肾炎(lupus nephritis,LN)是一种肾小球肾炎,是SLE 常见且最严重的并发症之一,也是SLE 患者发病和死亡的主要原因。LN 与先天性免疫和固有免疫的过度激活密切相关,血液中除有丰富的中性粒细胞外,还有T 淋巴细胞、B 淋巴细胞、单核细胞、浆细胞等免疫细胞,这些细胞与先天性免疫和固有免疫关系密切。因此,血液是寻找人LN 生物标志物的理想来源。
CD38 是一种多功能单链Ⅱ型的跨膜蛋白,该蛋白具有胞外酶和细胞受体功能。在淋巴细胞、单核细胞、巨噬细胞、树突状细胞、粒细胞和自然杀伤细胞(natural killer cell,NK cell,简称“NK 细胞”)等免疫细胞中广泛表达〔2〕。CD38 可以催化烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD) 生成环二磷酸腺苷核糖(cyclic adenosine diphosphate ribose,cADPR),接着催化cADPR 生成二磷酸腺苷核糖(adenosine diphosphate ribose,ADPR)〔2〕。cADPR 作为信号传导介质,不但可以控制中性粒细胞、树突状细胞的定位和迁移运动〔3-4〕,而且是T 淋巴细胞活化和分化的调节剂〔5〕。CD38及其配体CD31 之间的相互作用,参与调节淋巴细胞与内皮细胞的黏附〔6〕。CD38 可以与多种免疫细胞形成横向交联,例如T 淋巴细胞的TCR/CD3 复合物,膜型免疫球蛋白,巨噬细胞的MHCⅡ类分子,B 淋巴细胞的CD19/CD81 复合物〔7-8〕。CD38 不仅可以识别T 淋巴细胞抗原受体(TCR)来调整抗原介导的T 淋巴细胞反应〔9〕,还可以识别B 淋巴细胞抗原受体(BCR)来增强B 淋巴细胞对抗原的敏感性〔10〕。由此可见,CD38 在T 淋巴细胞、巨噬细胞、B淋巴细胞等免疫细胞的生理和病理环境中均起着重要作用,推测CD38 可能与人LN 密切相关。
人LN 的早期准确诊断和迅速治疗对疾病进展至关重要。如果疾病症状能够得以缓解,10年存活率将从46% 提高至95%〔11〕。理想的生物标志物,不仅有助于疾病的早期准确诊断和迅速治疗,还有助于探寻特异性生物制剂的有效靶点。在本研究中,利用GEO(Gene Expression Omnibus)数据库,分析CD38 在人LN 血液中的表达及临床意义,预测CD38 参与人LN 的信号通路,旨在鉴定人LN 新的生物标志物。
1 材料和方法
1.1 数据来源 通过GEO 数据库下载基因芯片GSE72747, 输 入 类 型“Series”, 种属为“Homo sapiens”,研究类型为“Expression profiling by array”,数据注释平台为GPL570。免疫治疗前,LN 患者血样10 例(GSM1869396,GSM1869399,GSM1869402,GSM1869405,GSM1869408,GSM1869411,GSM1869414,GSM1869417,GSM1869420,GSM1869423);免疫治疗后3 个月LN 患者血样10 例(GSM1869397,GSM1869400,GSM1869403,GSM1869406,GSM1869409,GSM1869412,GSM1869415,GSM1869418,GSM 1869421,GSM1869424);免疫治疗后6 个月LN 患者血样10 例(GSM1869398,GSM1869401,GSM1869404,GSM1869407,GSM1869410,GSM1869413,GSM 1869416,GSM1869419,GSM1869422,GSM1869425)。
1.2 基因表达差异分析 从GEO 数据库下载GSE72747 芯片的“Series Matrix File(s)”和数据注释平台GPL570 的文件,将探针信息转变成基因名称,用基因表达矩阵提取CD38 表达数据。利用R语言引用“limma”数据包,分析LN 未治疗组和治疗组的表达差异并进行可视化。利用“strawberry-perl-5.32.0.1” 处理同一病人未治疗和已治疗的配对信息,运用R 语言生成配对差异图。
1.3 相关性分析 治疗时间分为未治疗、免疫抑制治疗3 个月和6 个月;患者性别分为男性和女性。文件整理成:第1 列为样品ID,第2 列为时间或性别,第3 列为CD38 基因表达量。采用Kruskal 检验分析CD38 与治疗时间的相关性,采用Wilcox 检验分析CD38 与患者性别的相关性。运用R 语言将差异进行可视化。
1.4 统计学分析 利用SPSS 23.0 软件对临床数据进行Pearson 相关分析,筛选与CD38 相关性显著的临床数据。临床数据包括:SLEDAI 评分、ds DNA 抗体、肾小球滤过率等。对相关性显著的临床数据进行多元线性回归分析,自变量包括ds DNA 抗体、肾小球滤过率和CD38;因变量为SLEDAI 评分(连续数值型变量)。
1.5 CD38 基因GSEA 富集分析 采用GSEA 4.1.0软件对CD38 进行富集分析,根据GSE72747 中CD38 表达的平均值将CD38 表达分为高表达组和低表达组。关键参数设置:置换次数为1000;基因集数据库为c2.cp.kegg.v7.2.symbols.gmt[Curated];P < 0.05 为显著富集基因集。
2 结果
2.1 CD38 在LN 患者血液中表达差异分析 LN 患者经过免疫治疗后,血液中CD38 的表达量显著降低(P< 0.05);免疫治疗前后配对分析显示,相对于免疫治疗前,免疫治疗后血液中CD38 的表达量出现显著性下调(P< 0.05)。见图1。
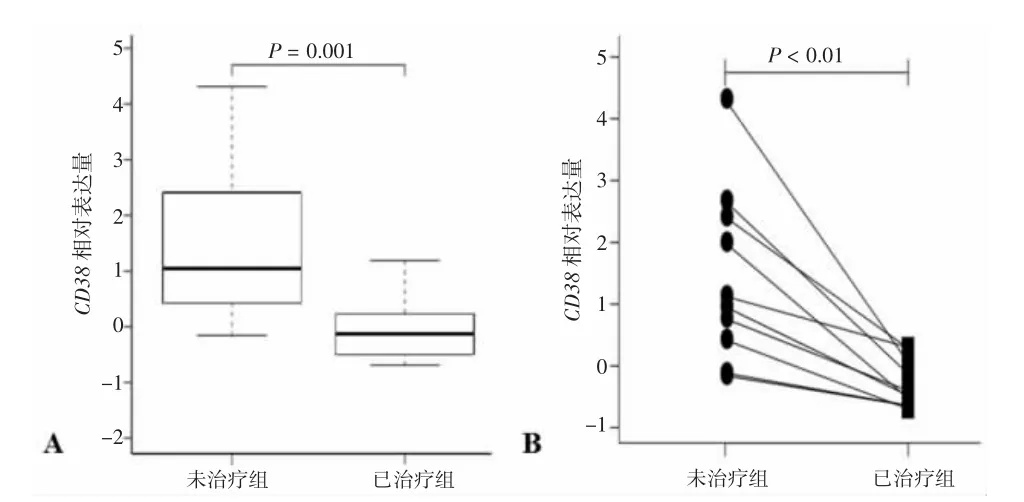
图1 CD38 在LN 患者血液中表达差异分析
2.2 CD38 与治疗时间和患者性别的相关性分析随着免疫治疗时间的延长,LN 患者血液中CD38 的表达量显著下调(P< 0.05);不同性别的LN 患者,血液中CD38 的表达量无显著性差异(P= 0.554)。见图2。
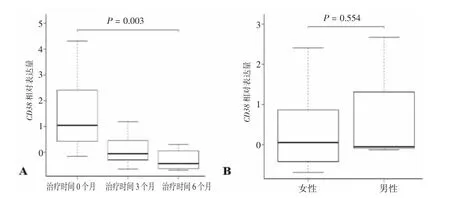
图2 CD38 与治疗时间和患者性别的相关性分析
2.3 临床病理特征的Pearson 相关性分析 CD38的表达量与ds DNA 抗体和SLEDAI 评分相关性显著(P< 0.05),CD38 的表达量与肾小球滤过率弱相关(相关系数r > 0.3)。见表1。
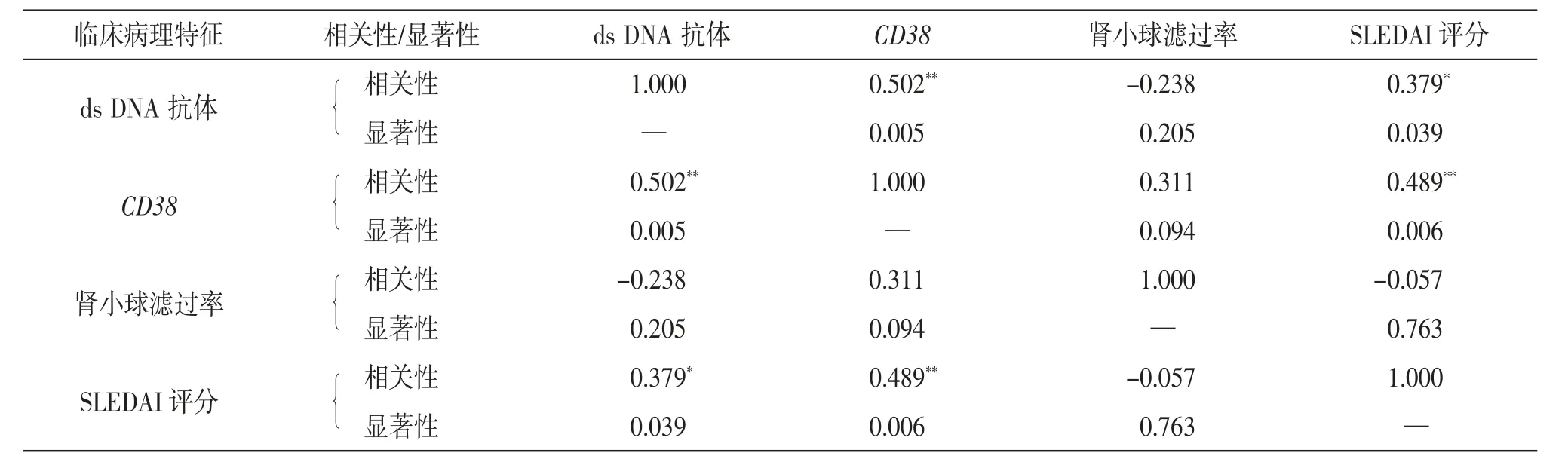
表1 临床病理特征的Pearson 相关性分析(n=30)
2.4 临床病理特征的多元线性回归分析 该模型通过F 检验,差异具有统计学意义(P < 0.05)。D-W值为1.596,接近2,表明该模型不存在自相关性。方差膨胀系数(variance inflation factor,VIF)小于5,说明自变量之间不存在多重共线性。CD38 与SLEDAI评分呈正相关(P < 0.05),ds DNA 抗体与SLEDAI评分相关性不显著(P = 0.74),肾小球滤过率与SLEDAI 评分相关性不显著(P = 0.322)。见表2。

表2 临床病理特征的多元线性回归分析
2.5 CD38 基因GSEA 富集分析 对LN 患者免疫治疗后CD38 表达量下调的可能机制进行初步分析。CD38 低表达样本主要富集在丝裂原激活蛋白激酶(mitogen activation protein kinase,MAPK)信号通路、Wnt 信号通路、JAK-STAT 信号通路、脂肪细胞因子信号通路、多糖生物合成、精氨酸和脯氨酸代谢。见表3。
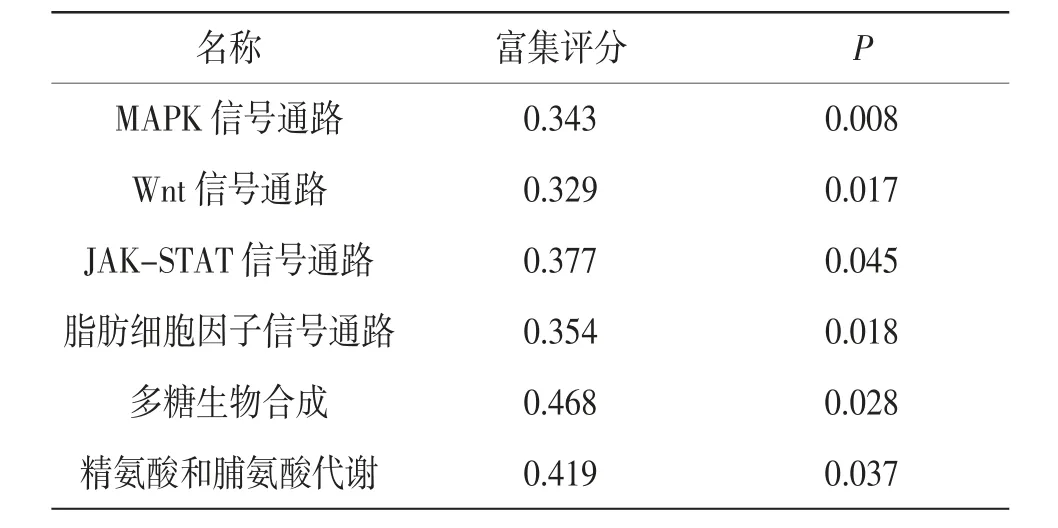
表3 CD38 基因GSEA 信号通路富集分析结果
3 讨论
本研究分析了CD38 在LN 患者血液中的表达差异,结果显示LN 患者免疫治疗后,血液中CD38的表达量呈现显著性下调,提示CD38 的表达量与人LN 密切相关,CD38 参与了人LN 的发病机制。一般认为人LN 的发生与免疫复合物(immune complex,IC)有关,因为几乎所有SLE 患者肾脏都发现了IC 沉积物〔12〕。然而,沉积IC 不足以驱动人LN 的发展,还涉及其他病理因素〔13〕。LN 患者肾脏的组织病理学数据表明,肾脏内发生的炎症是免疫失调的缩影,实质细胞和白细胞之间的相互作用决定了肾脏损害的程度〔14〕。中性粒细胞胞外陷阱在先天免疫反应中起关键作用,并且它们还调节适应性免疫反应〔15〕。巨噬细胞、B 淋巴细胞、树突状细胞、T 淋巴细胞、中性粒细胞浸润肾组织,可导致肾脏的损失〔14〕。CD38 对中性粒细胞和树突状细胞的迁移很重要〔3-4,16〕。B 淋巴细胞是人LN 有希望的治疗靶标,因为它们是发病机制的关键〔17〕。B 淋巴细胞的致病作用不仅限于自身抗体的产生,还扩展到抗原呈递,T 淋巴细胞活化,树突状细胞成熟的调节以及细胞因子的分泌。随着B 淋巴细胞的发育成熟,CD38 的表达量逐渐增加。CD38 刺激B 淋巴细胞的成熟需要磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、布鲁顿酪氨酸激酶(Bruton′s tyrosine kinase,BTK)、Src 家族激酶(Src family kinase,SFK)和胞外信号调节激酶(extracellular signal-regulated kinase,ERK)的参与〔18〕。CD38 依赖PI3K、BTK 和蛋白激酶C(protein kinase C,PKC)激活核因子κb(nuclear factor kappalight-chain-enhancer of activated B cell,NF-κB)〔19〕,从而促进B 淋巴细胞向浆细胞分化,浆细胞能分泌形成IC 的自身抗体。以上证据表明,CD38 促进SLE 转化为LN 或加重其症状。
随着治疗时间的增加,血液中CD38 的表达量逐渐降低,与LN 患者症状减轻一致。因此,CD38 的表达量可衡量人LN 免疫治疗的效果。研究表明,ds DNA 抗体除了形成IC 外,还可以上调肾细胞中与炎症和纤维化有关的基因,导致肾脏的炎症和纤维化,从而促进人LN 的发病或加重其临床症状〔20-21〕。SLEDAI 评分是经验丰富的临床医师对狼疮疾病活动进行评估的有效模型,代表了狼疮研究领域专家组的共识〔22〕。表2 结果显示CD38 的表达量显著影响SLEDAI 评分。因此,CD38 可作为LN 患者早期诊断或症状轻重的生物标志物。
免疫系统自我耐受性丧失,自身反应性T 淋巴细胞和B 淋巴细胞被异常激活,大量促炎细胞因子的产生,这些细胞因子对组织损伤和局部炎症起引发或放大作用〔23〕。研究表明,MARK 信号通路、Wnt信号通路和JAK-STAT 信号通路参与人LN 发病的分子机制〔24〕。表3 结果表明,CD38 可调节MARK信号通路、Wnt 信号通路和JAK-STAT 信号通路,抑制促炎细胞因子的生成,从而特异性地预防肾损失。
综上所述,本研究运用生物信息学方法分析LN 患者免疫治疗前后血液中CD38 表达量的差异。Pearson 相关性分析和多元线性回归分析表明CD38可作为人LN 早期诊断或治疗的生物标志物。GSEA富集分析结果显示CD38 通过MARK 信号通路、Wnt 信号通路和JAK-STAT 信号通路参与人LN 的发病机制。
