产几丁质酶菌株GXUN-20的筛选、鉴定及其产酶条件优化
2021-12-16王一兵申乃坤姜明国
张 奇,王一兵,2, ,申乃坤,姜明国
(1.广西民族大学海洋与生物技术学院, 广西多糖材料与改性重点实验室, 广西海洋微生物资源产业化工程技术研究中心, 广西高校微生物与植物资源利用重点实验室, 广西南宁 530008;2.广西科学院, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007)
几丁质(Chitin)又名甲壳素、甲壳质,是由N-乙酰-D-葡糖糖胺以β-1,4糖苷键连接而成的天然多聚体,其含量在自然界仅次于纤维素,广泛存在于海产品虾蟹的外壳、节肢动物、大多数昆虫的外骨骼,以及真菌和藻类等植物的细胞壁中[1]。近年来,海鲜的生产和消费不断增加,虾蟹壳是目前主要的海鲜生产废弃物[2],由于技术和市场的限制,海鲜废弃物的再利用受到了限制,其中有部分虾蟹壳废弃物用于堆肥或转化为低附加值产品,比如动物饲料和化肥,大部分废弃物在没有处理的情况下直接丢弃到环境中,如果处理不当,会对环境造成严重的危害[3]。然而,这些虾蟹壳废弃物是具有高效益原材料的来源,可用于生产生物产品[4]。
虾蟹壳中的几丁质不溶于水、稀酸、稀碱等常用试剂,严重限制了其商业应用,几丁质经几丁质酶(Chitinase)水解得到易溶于酸的壳聚糖[5];壳聚糖是自然界中发现的唯一碱性多糖,因其分子中有大量的游离氨基,所以溶解性能比几丁质有所改善,并具有生物可降解性,被广泛应用于食品、医药、化妆品、环保、农业等领域,具有很大的生物技术应用价值和商业前景[6]。目前,生产壳聚糖主要采用化学方法,但此方法耗能大,较危险,且容易造成环境污染等问题[7],酶解法生产壳聚糖绿色环保,反应条件较温和,耗材耗能相对较低,并且可以获得脱乙酰程度较均一稳定的产品,运用几丁质酶生产壳聚糖是近年来研究的热点。因此,几丁质酶研究的重点在于筛选出产酶量高、适合大规模化生产的菌株,探索适合的发酵工艺等方面[8]。
海岸滩涂具有独特的微生物环境,蕴含着丰富的具有催化特性酶类的微生物资源[6],其沉积物中含有大量虾蟹及贝壳废弃物,虾蟹壳含有丰富的蛋白质和几丁质,是碳和氮的重要来源[9],寻找具有催化特性的几丁质酶类,不仅对降解虾蟹壳废弃物以提高其利用率、保护环境具有很好的指导作用[10],而且虾蟹壳降解后得到的丰富的碳氮源还可以减少农药和化肥的投入使用,能够改善土壤肥力、增强土壤微生物菌群活力,为菌肥的研发提供了新思路[11]。因此,本研究从广西合浦县大神木海鸭场附近滩涂沉积物中筛选产几丁质酶细菌,并对筛选得到的菌株进行16S rDNA属种鉴定,对其中一株产几丁质酶活力较强菌株进行产酶条件优化研究,提高发酵产酶水平,以期为降解虾蟹壳酶法生产壳聚糖提供实验基础。
1 材料与方法
1.1 材料与仪器
滩涂沉积物 中国广西合浦县大神木海鸭场,东经 108°54′25″,北纬 21°37′25″,置于-15 ℃ 左右车载冰箱立即带回实验室进行菌株筛选;细菌病原菌:金黄色葡萄球菌(Staphylococcus aureus1.10755)、大肠杆菌(Escherichia coli1.12883)、枯草芽孢杆菌(Bacillus subtilis1.15792);真菌病原菌:黑曲霉(Aspergillus niger3.3928)、尖孢镰刀菌(Fusarium oxysporum3.18025)、立枯丝核菌(Rhizoctonia solani3.17046)、白色链霉菌(Streptomyces albus4.7658)
以上菌种均购于中国普通微生物菌种保藏管理中心(CGMCC);几丁质 生工生物工程(上海)股份有限公司;PCRMix 北京康润诚业生物科技有限公司;引物 北京擎科新业生物技术有限公司;其它试剂 国产分析纯试剂。
GI54DS高压蒸汽灭菌锅 致微(厦门)仪器有限公司;SW-CJ-1F单人双面垂直净化工作台 上海汗诺仪器有限公司;ZXMP-A1230电热恒温培养箱、摇床 上海智城分析仪器制造有限公司;HH-2数显恒温水浴锅 常州国华仪器有限公司;LEGEND MICR 017微量台式离心机、Multiskan Go 全波长酶标仪 美国Thermo Scientific公司;BioRad T100 Mastercycler nexus聚合酶链式反应(PCR)仪 Bio-Rad公司。
1.2 实验方法
1.2.1 培养基 DNS溶液、胶体几丁质溶液的配制:根据傅丽君等[12]的方法进行DNS和胶体几丁质溶液的配制;LB 培养基(g/L):NaCl 5.0 g,酵母膏 5.0 g,胰蛋白胨 10.0 g,pH 7.0~8.0[13](若为固体,加入琼脂15.0 g);PDA 培养基(g/L):马铃薯 200.0 g,葡萄糖20.0 g,琼脂 15.0 g,pH 自然。
复合盐母溶液(g/L):K2HPO470.0 g,KH2PO430.0 g,MgSO4·7H2O 50.0 g,FeSO4·7H2O 1.0 g[14]。
液体富集培养基(g/L):几丁质粉末 8.0 g,(NH4)2SO42.0 g,复合盐母溶液 10 mL,pH7.2~7.5。
胶体几丁质培养基(g/L):胶体几丁质4.0 g,(NH4)2SO42.0 g,复合盐母溶液10 mL,琼脂15.0 g,pH7.0。
种子培养基(g/L):几丁质粉末10.0 g,酵母粉5.0 g,蛋白胨5.0 g,复合盐母溶液10 mL,pH7.0。
发酵培养基(g/L):几丁质粉末10.0 g,(NH4)2SO42.0 g,复合盐母溶液 10 mL,pH7.0。
1.2.2 产几丁质酶菌株的筛选及发酵酶活测定 称取滩涂沉积物样品5.0 g,加入25 mL无菌水中,混匀后于30 ℃、180 r/min 培养4 h,取1 mL上清液加入到29 mL液体富集培养基中,混匀后于30 ℃、200 r/min 培养 3~4 d后,取样液梯度稀释至 10-3、10-4、10-5并分别吸取200 μL于胶体几丁质培养基上涂布分离,30 ℃倒置培养2~5 d[15-16],观察菌落生长及透明圈产生情况,挑取产透明圈的菌株在LB固体培养基中纯化出单菌落[17],同时接种于LB斜面培养基-4 ℃低温保藏及30%甘油管-80 ℃超低温保藏。
挑选单菌落至种子培养基中,于30 ℃、200 r/min培养2~3 d后,再以2%(v/v)接种量接种至发酵培养基30 ℃、200 r/min培养4 d后,发酵液8000 r/min离心10 min取上清粗酶液。取1 mL胶体几丁质溶液(1%)于5 mL离心管中,45 ℃水浴预热10 min之后加入1 mL稀释粗酶液。45 ℃反应1 h后,混匀取出200 μL加入300 μL DNS终止反应,在沸水中显色10 min,冷却后加入300 μL去离子水,12000 r/min离心5 min,取上清液于540 nm处测吸光值,以煮沸灭活的上清液作为对照。酶活力单位(U)定义为:在45 ℃下每分钟产生1 μmol N-乙酰-D-氨基葡萄糖所需要的酶量[8]。
1.2.3 菌株GXUN-20 16S rDNA扩增及分析 煮沸法提取DNA模板:挑取单一菌落至EP管中,加入100 μL 20%的Chelex裂解液,振荡煮沸30 min后,12000 r/min离心10 min,取上清。PCR引物:27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GG TTACCTTGTTACGACTT-3'。反应体系 50 μL:PCR Mix 23 μL,ddH2O 21 μL,上下游引物各 2 μL,模板2 μL。反应程序:98 ℃ 预变性 5 min;95 ℃ 变性1 min,55 ℃ 退火 1 min,72 ℃ 延伸 90 s,34 个循环;72 ℃终延伸10 min,4 ℃保存。PCR扩增产物送至生工生物工程(上海)股份有限公司测序,所得序列提交GenBank,并与GenBank数据库中的序列进行同源性比对,用MEGA 6.0软件进行16S rDNA序列的比对分析,并构建系统发育树。
1.2.4 菌株GXUN-20的鉴定以及抑菌实验 产透明圈最大的菌株命名为GXUN-20,根据伯杰氏细菌鉴定手册对菌株GXUN-20进行形态观察和生理生化鉴定[18]。抑菌实验采取滤纸法[19],将细菌病原菌分别接入 LB培养基,37 ℃培养 12 h,吸取 50 μL至LB固体培养基涂布,在滤纸上滴加GXUN-20菌液8 μL后放置在LB培养基上,30 ℃倒置培养1 d;真菌病原菌分别接种至PDA培养基中央,在滤纸上滴加GXUN-20菌液8 μL后放置于真菌的对立面,25 ℃倒置培养3~5 d,分别观察滤纸片四周是否有抑菌圈生成。
1.2.5 单因素实验 优化前发酵条件:发酵培养基,30 mL/150 mL 装液量,2%(v/v)接种量,30 ℃、200 r/min发酵培养4 d,进行酶活测定。
1.2.5.1 生长曲线及最适发酵产酶时间 分别在发酵的第 1、2、3、4、5、6、7、8 d检测 OD600及酶活。
1.2.5.2 碳源浓度的确定 将种子液接种到几丁质粉末添加量分别为 6.67、10.0、13.33、16.67、20 g/L的培养基中,其它发酵因素不变,恒温培养测定酶活。
1.2.5.3 氮源及其添加量的确定 将种子液接种到分别以2 g/L的硫酸铵、蛋白胨、氯化铵、黄豆饼粉、尿素、牛肉膏为唯一氮源培养基中,在最适氮源基础上进行最适氮源添加量(1、2、3、4、5 g/L)优化,其它发酵因素不变,恒温培养测定酶活。
1.2.5.4 发酵培养温度的确定 将种子液接种至发酵培养基后,置于温度分别为 26、28、30、32、35、37 ℃摇床中,其它发酵因素不变,培养测定酶活。
1.2.5.5 发酵液初始pH 将种子液接种到发酵液初始 pH分别为 7.8、8.0、8.2、8.4、8.6、8.8、9.0的培养基中,其它发酵因素不变,恒温培养测定酶活。
1.2.5.6 接种量的确定 将种子液以接种量分别为0.5%、1%、2%、3%、4%、5%(v/v)接种于培养基中,其它发酵因素不变,恒温培养测定酶活。
1.2.6 正交试验 根据单因素实验结果选出对产几丁质酶影响较大的4个因素(氮源浓度、发酵液初始pH、碳源浓度、接种量)进行4水平正交试验(表1)。单因素温度优化结果比几丁质粉末浓度优化结果酶活力高,但考虑到该菌株是以几丁质为底物发酵产几丁质酶,固选择几丁质粉末添加量为4因素之一,以几丁质酶活力为考察指标,探究该菌株最佳产酶条件。
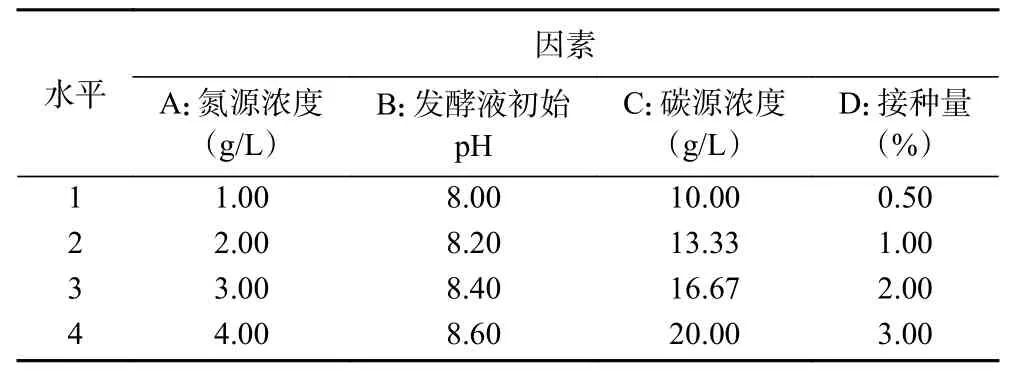
表1 4因素4水平正交实验Table 1 Orthogonal experiment of 4 factors and 4 levels
1.3 数据处理
采用GraphPad Prism 8作图,采用SPSS21.0进行正交实验数据统计分析,实验均为三组平行。
2 结果与分析
2.1 产几丁质酶菌株的筛选及发酵酶活测定结果
将富集培养的滩涂沉积物稀释液涂布于胶体几丁质固体培养基,30 ℃倒置培养3 d,菌株在胶体几丁质固体培养基上生长,并产生白色透明圈,结果如图1所示,挑选有透明圈的菌株纯化至单菌落,共得到3株产丁质酶菌株,将透明圈最大的菌株命名为GXUN-20。以N-乙酰-D-氨基葡萄糖标准品绘制标准曲线,R2=0.9971,结果如图2所示,按照酶活测定方法,测定该菌株未优化之前几丁质酶的酶活为0.140 U/mL。
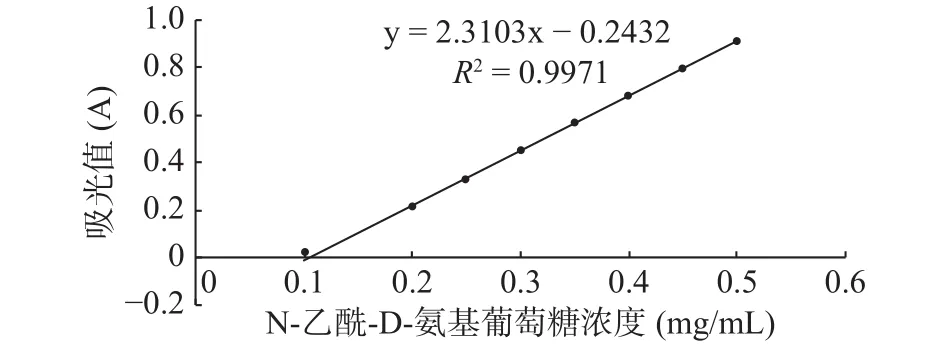
图2 N-乙酰-D-氨基葡萄糖标准曲线Fig.2 Standard curve of N-acetyl-D-glucosamine
2.2 菌株GXUN-20 16S rDNA扩增及分析
将PCR产物送至生工生物(上海)股份有限公司,所得 1411 bp序列提交 GenBank检索,并与GenBank数据库里的序列进行同源比对,发现与Lysobacter firmicutimachus(登录号:KU593484)菌株16S rDNA相似度最高为99.79%。运用MEGA 6.0软件进行16S rDNA序列的对比分析,并构建系统发育树如图3,从图中可以看出 GXUN-20与Lysobacter firmicutimachus菌株亲缘关系最接近,可初步鉴定GXUN-20(登录号:MW897735)为厚壁溶杆菌。
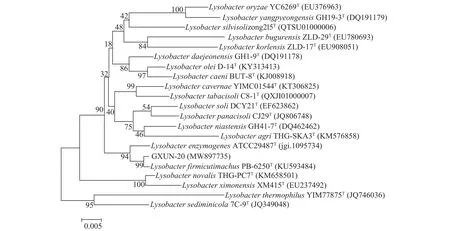
图3 基于16S rDNA序列构建菌株GXUN-20系统发育树Fig.3 Phylogenetic tree of strain GXUN-20 based on 16S rDNA sequence
2.3 菌株GXUN-20的鉴定以及抑菌实验结果
2.3.1 菌株GXUN-20形态学鉴定 菌株GXUN-20的形态学观察见图4。菌株GXUN-20为革兰氏阴性短杆菌,无芽孢,菌落呈淡黄色圆形,表面湿润光滑,边缘规则,无晕环,中央饱满突起,直径0.1~0.5 mm,挑起有粘性,较易挑取,与Miess等[20]研究结果相似,在有氧条件下生长于LB、R2A、TSA等培养基,菌落圆形凸出,奶油黄色,圆端非孢子棒状,单个或成对出现,无氧条件下不生长。
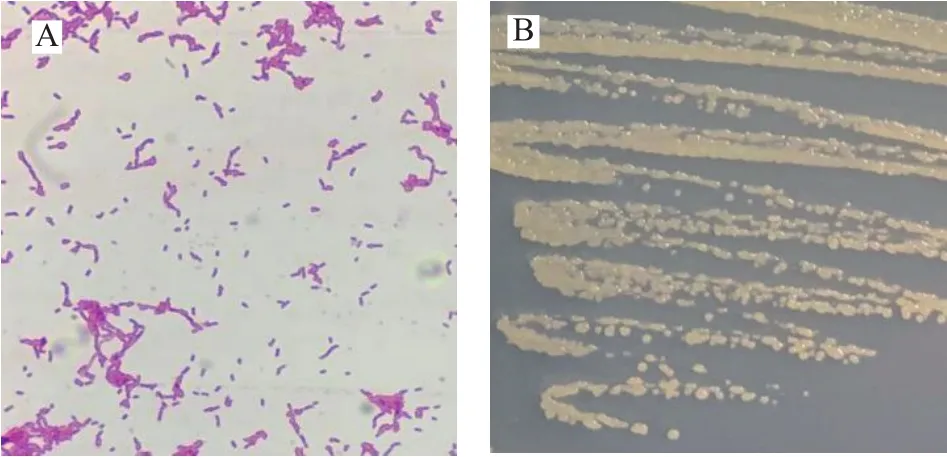
图4 菌株GXUN-20的形态观察结果Fig.4 Morphological observation results of strain GXUN-20
2.3.2 菌株GXUN-20生理生化特征 菌株GXUN-20部分生理生化试验结果及说明见表2。从结果得知,明胶液化试验、过氧化氢试验、SIM生化试验、吲哚试验、七叶苷试验均呈现阳性,VP、MR、硝酸盐试验、甘露糖、麦芽糖、葡糖糖、木糖、鼠李糖试验均呈现阴性。

表2 菌株GXUN-20的生理生化试验结果Table 2 Physiological and biochemical tests results of strain GXUN-20
2.3.3 菌株GXUN-20抑菌实验结果 几丁质是真菌细胞壁的主要成份[23],几丁质酶可通过水解作用将几丁质裂解为可溶性寡糖[24],从而裂解病原真菌细胞壁使其死亡[25],利用分泌几丁质酶菌株对植物病原真菌进行防治是目前生防领域研究热点之一[26]。因此,实验菌株在细菌病原菌的基础上加入真菌病原菌,探究GXUN-20菌株是否对细菌和真菌病原菌具有抑制效果。抑制实验结果如图5所示,GXUN-20对细菌金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、真菌白色链霉菌、尖孢镰刀菌没有明显的抑菌圈,初步判断没有抑制作用,在真菌黑曲霉、立枯丝核两株真菌生长范围内看见较明显抑菌圈,初步判断该菌株对部分真菌有抑制作用,GXUN-20菌株抑制黑曲霉抑菌圈平均直径为17.3 mm,抑制立枯丝核抑菌圈平均直径为23.8 mm。
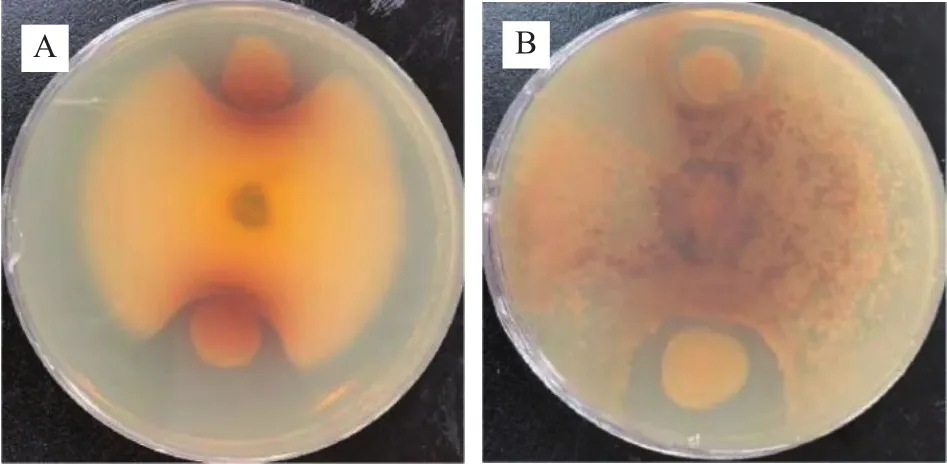
图5 菌株GXUN-20抑制真菌实验结果Fig.5 Experimental results of fungi inhibition by strain GXUN-20
2.4 单因素实验结果
2.4.1 生长曲线及其最适发酵产酶时间的确定GXUN-20菌株的生长曲线及发酵时间对该菌株产酶的结果如图6所示。菌株GXUN-20在发酵条件下培养1~3 d繁殖数量少,处于生长延滞期,酶活力也相对较低,3~6 d,处于生长对数期增殖加快,发酵液里菌体浓度增大,在这一阶段几丁质酶活力也快速升高,并在第6 d菌液浓度和几丁质酶活力达到最高,最高酶活为 0.689 U/mL,6~8 d,进入衰亡期,可能是由于发酵液里的营养物质消耗过多,产物的积累、pH变化等不利因素的影响[27],菌株繁殖速度逐渐降低,几丁质酶活力也相对减弱。通过对GXUN-20菌株生长曲线和发酵时间的监测最后确定该菌株发酵产酶的最适时间为6 d。
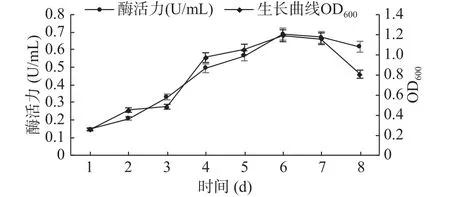
图6 菌株GXUN-20的生长曲线以及最适发酵产酶时间曲线Fig.6 Growth curve and optimal fermentation time curve of strain GXUN-20
2.4.2 碳源浓度的确定 几丁质粉末为GXUN-20菌株发酵产酶的唯一碳源,最适添加量对产酶酶活力影响如图7所示。未优化之前该菌株酶活力为0.140 U/mL,几丁质粉末添加量为16.67 g/L时,产几丁质酶活力最高,可达到0.351 U/mL,酶活力约为优化前的2.51倍,因此确定GXUN-20菌株发酵产酶的碳源最适添加量为16.67 g/L。碳源添加量过少时,菌体生长所需碳源不足,导致菌株生长不充分,酶活力降低,碳源浓度增大,在发酵过程中发酵液会越来越粘稠,摇瓶不充分,导致酶活力降低[8]。
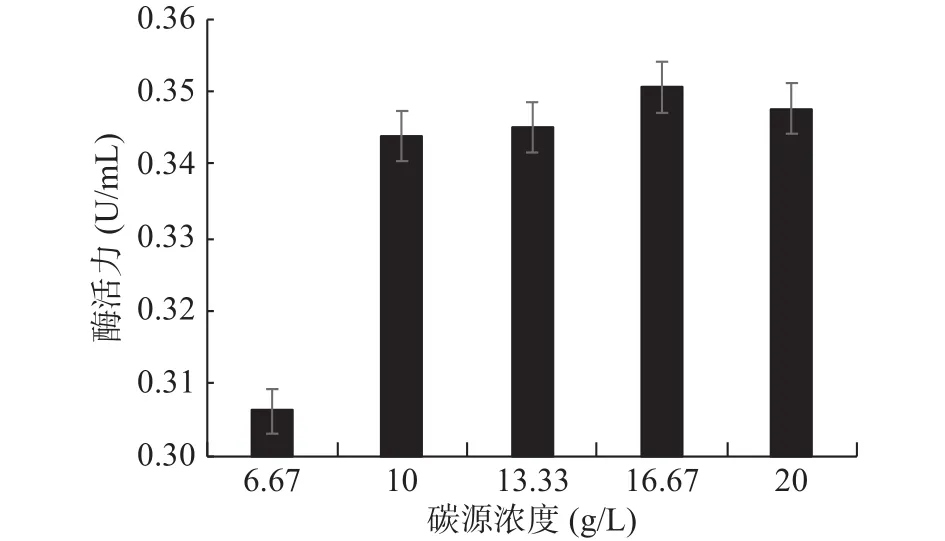
图7 菌株GXUN-20碳源浓度的确定Fig.7 Determination of carbon source concentration of strain GXUN-20
2.4.3 最适氮源的筛选 氮源是微生物生长必不可少的营养物质之一,也是生物体酶、结构蛋白的重要来源[28],可作为代谢的前体物质,直接参与次生代谢[29]。GXUN-20最适氮源筛选结果如图8所示,该菌株发酵产酶的氮源分为无机氮和有机氮,以无机氮硫酸铵和氯化铵为氮源时该菌株的酶活分别达到0.570和0.519 U/mL,以黄豆饼粉为氮源时该菌株酶活力最高,酶活力为0.600 U/mL,是优化前的4.29倍。有研究表明与其他氮源相比,黄豆饼粉营养更丰富,更容易被利用,是因为黄豆饼粉不仅仅提供必要的氮元素之外,还提供了很多必需的生长因子[30]。因此,确定GXUN-20菌株发酵产酶的最适有机氮源为黄豆饼粉,硫酸铵是较好的无机氮源,也说明该菌株既能利用有机氮源也能利用无机氮源。
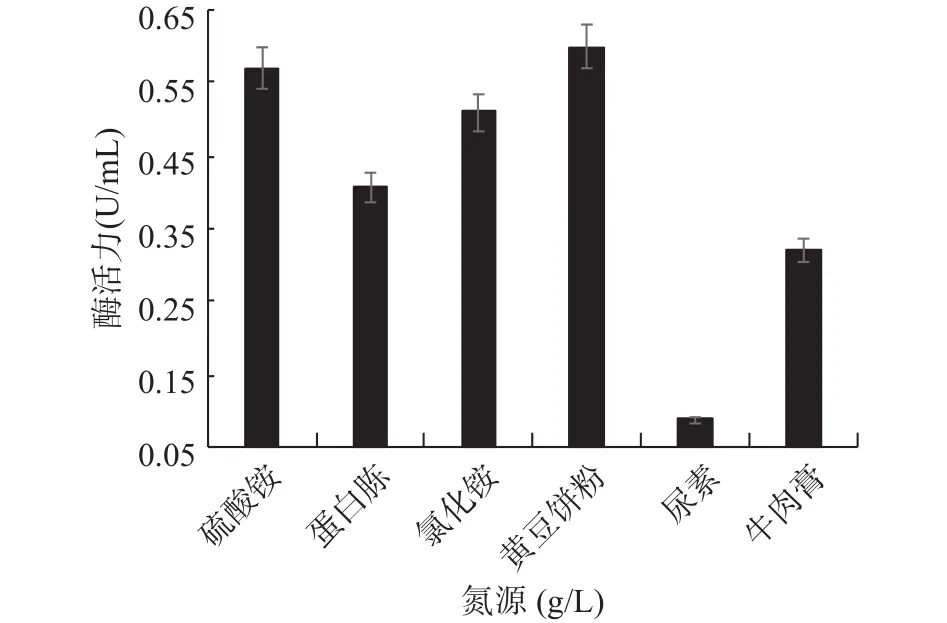
图8 菌株GXUN-20最适氮源的筛选Fig.8 Screening of optimum nitrogen source for strain GXUN-20
2.4.4 最适氮源添加量的确定 氮源添加量对GXUN-20菌株发酵产酶酶活力的影响如图9所示。低浓度和高浓度的黄豆饼粉都不利于该菌株发酵产几丁质酶,马璐等[31]研究发现低浓度氮源不足以维持菌体生长需要,当氮源浓度高时相对碳源浓度低,细菌没有充足能量合成蛋白质和进行生命活动,因此合适的碳氮比可促进菌体生长及次生代谢产物的积累。随着黄豆饼粉浓度的增加,几丁质酶活力先增加后下降,在黄豆饼粉达到3 g/L时,该菌株产几丁质酶活力最高,达到0.486 U/mL,是优化前的3.47倍。因此,确定GXUN-20菌株发酵产酶的最适氮源添加量为3 g/L。
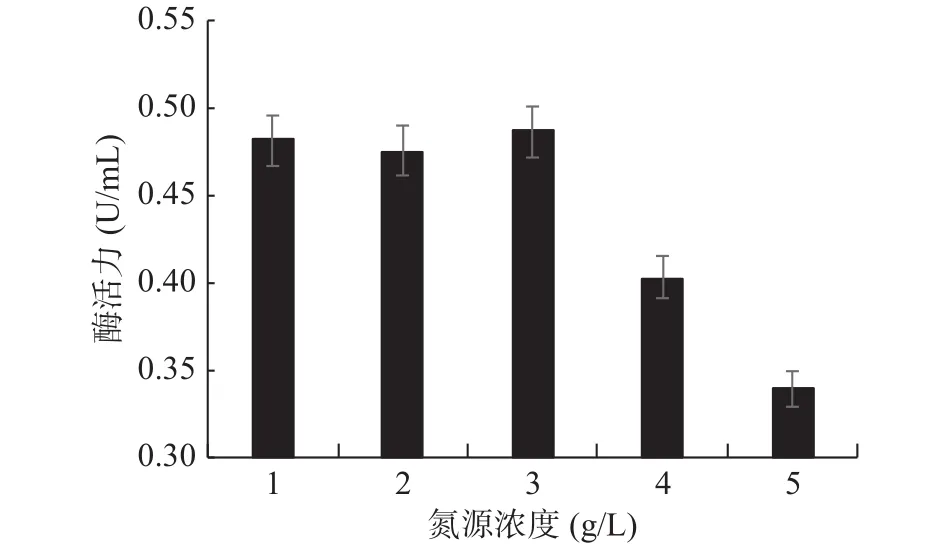
图9 菌株GXUN-20最适氮源黄豆饼粉添加量的确定Fig.9 Determination of the optimum nitrogen source for soybean cake powder of strain GXUN-20
2.4.5 最适温度的确定 GXUN-20菌株酶活力随温度变化结果如图10所示。低温菌体生长减缓,释放酶蛋白减少,总体酶活性不高,在一定温度范围内,随着温度的上升,呼吸强度增加,代谢速度增强,最终导致细胞生长繁殖加速[32],几丁质酶活力上升,在30 ℃时,几丁质酶活力达到最高为0.458 U/mL,是优化前的3.27倍,随着温度继续升高,高温会让酶蛋白失活变性,酶活力有所下降,因此,确定GXUN-20菌株发酵产酶的最适温度为30 ℃。
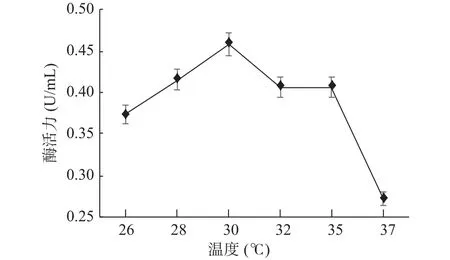
图10 菌株GXUN-20最适温度的确定Fig.10 Determination of the optimum temperature of strain GXUN-20
2.4.6 发酵液初始最适pH的确定 菌株GXUN-20发酵液初始最适pH对酶活力的影响结果如图11所示。pH偏低,发酵液偏酸性,不利于菌体生长,酶活力不高,在一定pH范围内,随着pH的升高,发酵液偏弱碱性,有利于该菌株生长,酶活力增强,在pH=8.4时,GXUN-20菌株产几丁质酶活力最大,为0.659 U/mL,是优化前的4.71倍,随着pH继续增大,发酵液偏碱性,碱性会让酶蛋白变性失活,酶活力减弱,表明该菌株适合弱碱性的产酶环境,可能是因为该菌株生长在碱性的海岸环境中,而大部分细菌最适发酵产酶的pH在6.3~7.5[32]。
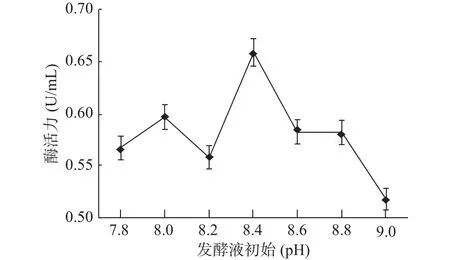
图11 菌株GXUN-20最适发酵液pH的确定Fig.11 Determination of the optimum pH of fermentation liquor of strain GXUN-20
2.4.7 发酵液最适接种量确定 GXUN-20菌株发酵液最适接种量优化结果如图12。接种量在2%(v/v)时,GXUN-20产几丁质酶活力最大,为0.501 U/mL,是优化前的3.58倍。随着接种量的增加,过高的接种量会极具地消耗培养基中的氧气和营养物质[17],所以菌株的酶活力逐渐减弱,因此,GXUN-20菌株发酵产酶的最适接种量为2%。
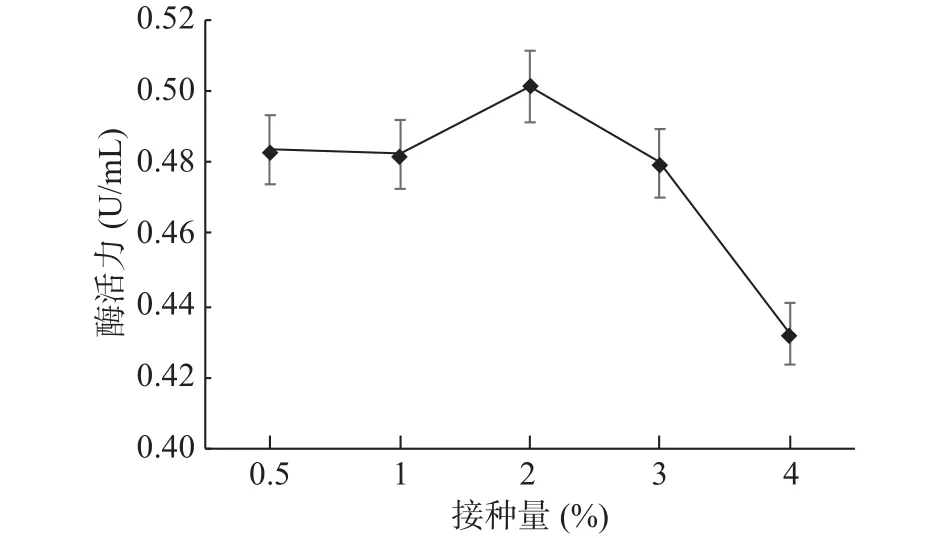
图12 菌株GXUN-20最适接种量的确定Fig.12 Determination of optimum inoculation amount of strain GXUN-20
2.5 正交试验结果
在单因素实验结果的基础上设计L16(44)正交试验,对因素A:氮源黄豆饼粉浓度、B:pH、C:碳源几丁质粉末浓度、D:接种量,4因素之间的相互作用做进一步的研究。正交试验结果见表3,根据实验结果计算出kn值和R值,得出的最佳发酵方案为:A1B3C4D4,即黄豆饼粉 1 g/L,发酵液初始 pH8.4,几丁质粉末 20 g/L,接种量 3%;R值 A>C>B>D,A为最显著因素,正交实验方差分析结果见表4,得出黄豆饼粉对试验结果影响显著(P=0.013<0.05),即氮源对GXUN-20菌株产酶影响最为明显。以正交试验得出GXUN-20菌株最适发酵产酶条件进行产酶酶活力验证,黄豆饼粉1 g/L,几丁质粉末20 g/L,复合盐母溶液10 mL,pH8.4,接种量3%,200 r/min、30 ℃振荡培养6 d后,检测液体酶活力为0.965 U/mL,是优化前的6.89倍。
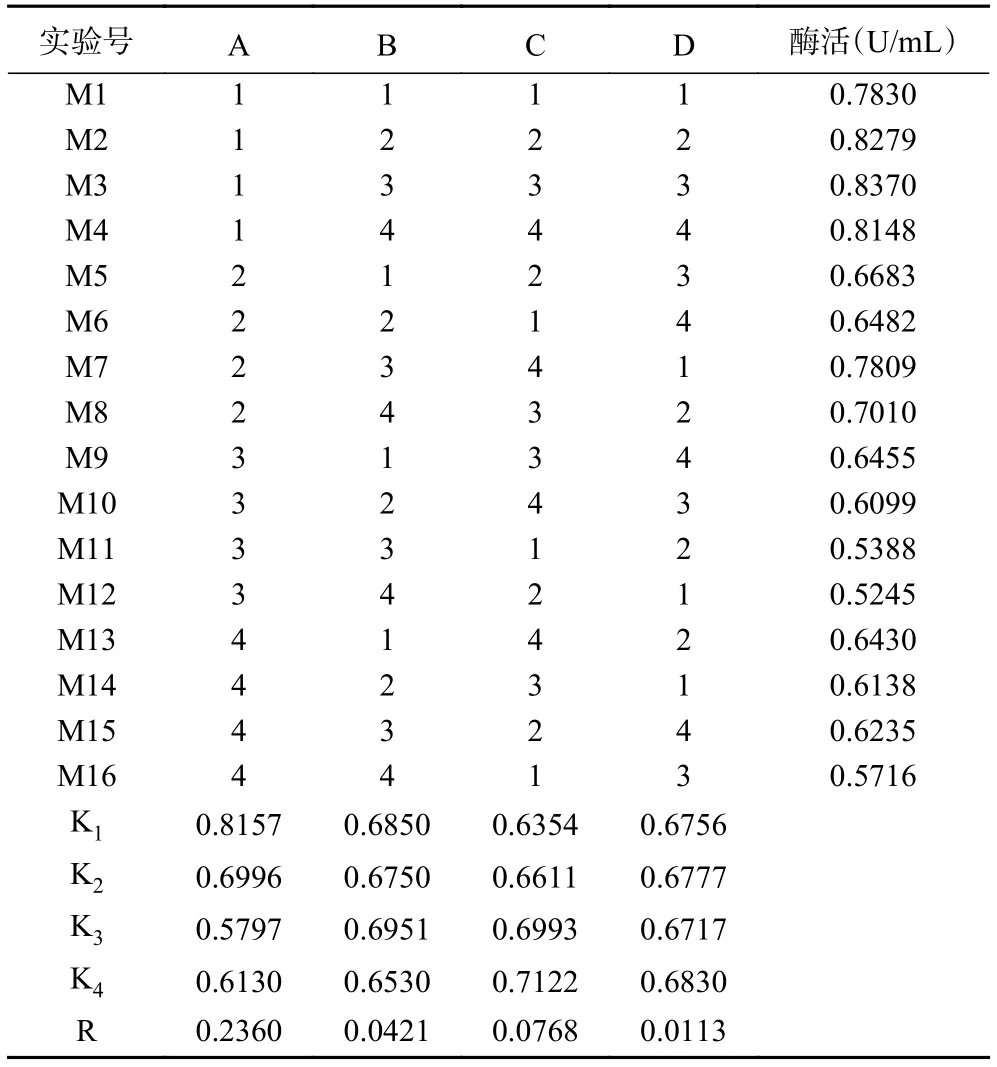
表3 L16(44)正交试验结果Table 3 Results of L16 (44) orthogonal experiment
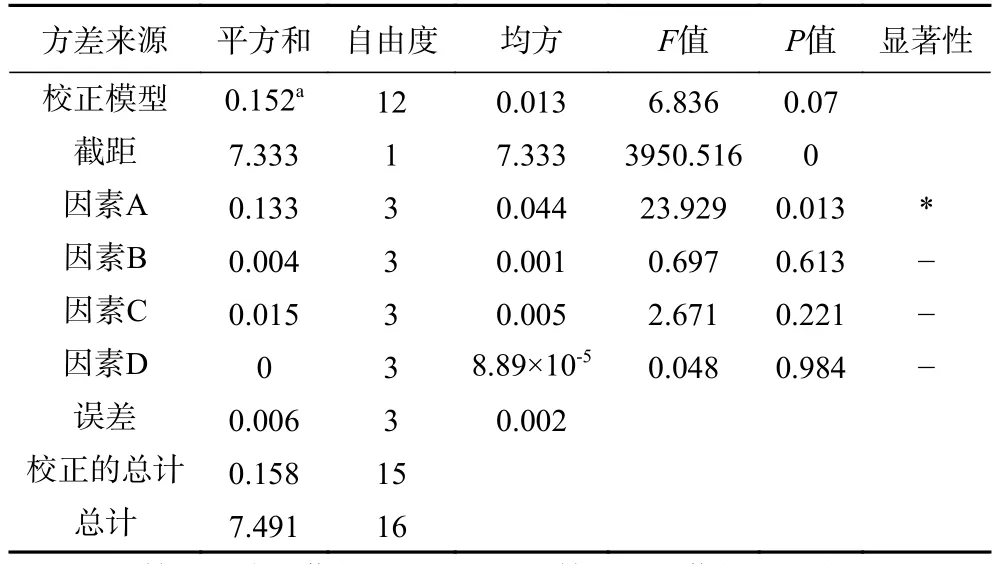
表4 GXUN-20菌株正交实验方差分析Table 4 Variance analysis of orthogonal test of GXUN-20 strain
3 结论与讨论
自然环境中虾蟹壳的降解主要是由微生物完成的,为了提高虾蟹等海产品废弃物利用率及其附加值,本研究从广西合浦县大神木海鸭场附近滩涂沉积物(虾蟹及贝壳废弃物)中筛选出一株产几丁质酶菌株GXUN-20,经16S rDNA序列构建系统发育树,鉴定与Lysobacter firmicutimachus相似度为99.79%,为厚壁溶杆菌,与虾蟹壳土壤[33]、黄粉虫虫蜕[16]中筛选到的几丁质降解菌株类芽孢杆菌属的结果不一致,说明产几丁质酶菌株分类广泛。以几丁质酶活力为指标,对GXUN-20菌株进行发酵条件单因素优化,在单因素优化结果较显著的4因素(氮源浓度、发酵液初始pH、几丁质粉末浓度、接种量)基础上进行4水平正交试验及正交试验方差分析。结果显示:氮源浓度对产酶影响显著(P=0.013<0.05),在氮源为1 g/L黄豆饼粉,几丁质粉末为20 g/L,接种量为3%,发酵液初始 pH 8.4,30 ℃、200 r/min发酵 6 d条件下,发酵液中几丁质酶活力最大,达0.965 U/mL,是优化前酶活力的6.89倍。本研究结果为GXUN-20菌株产几丁质酶进一步开发与应用提供了基础数据和实验方法,也为进一步探究降解虾蟹壳酶法生产壳聚糖提供实验基础。
目前国内外对溶杆菌属产几丁质酶方面的研究较少,有研究发现Lysobacter enzymogenes菌株可产几丁质酶[20],Qian 等[34]、朱慧等[35]研究Lysobacter enzymogenes对辣椒疫霉具有抑制作用以及该菌株产几丁质酶的分子机制。由于Lysobacter firmicutimachus菌株产几丁质酶相关研究缺乏,本研究通过单因素实验优化了GXUN-20菌株产几丁质酶发酵培养条件,通过对该菌株的生长曲线以及最适产酶时间的测定,得出该菌株生长密度与产酶活力呈正相关,在一定时间范围内,随着该菌株的生长,发酵液里菌体浓度不断增加,该菌株降解几丁质产还原糖的能力增加,即几丁质酶活力增加,并在菌体生长达到顶峰时,几丁质酶活力也达到最大,这与陈立功等人的研究基本一致[36]。随着发酵时间延长,发酵环境越来越不适合该菌株的生长,发酵液中氧气和营养物质的消耗以及代谢物的增加,菌株浓度慢慢降低,几丁质酶活力也呈现下降的趋势[27]。
几丁质粉末为该菌株发酵培养的唯一碳源,在单因素优化中,分别以不同浓度的碳源进行发酵产酶活力测定,结果在几丁质粉末为16.67 g/L时,GXUN-20菌株产酶活力最高,碳源添加量过少,菌体生长所需碳源不足,导致菌株生长不充分,酶活力降低,碳源浓度增大,在发酵过程中发酵液越发粘稠,摇瓶不充分,导致酶活力降低。不同氮源对GXUN-20菌株产几丁质酶具有明显的影响,以硫酸铵、氯化铵、黄豆饼粉作为氮源时该菌株产几丁质酶活力较高,以蛋白胨、牛肉膏、尿素为氮源时该菌株几丁质酶表达量较低,有机氮源黄豆饼粉单因素优化之后该菌株产酶活力最大,但与无机氮源硫酸铵差别不大,为考虑到工业生产成本问题,后期可以考虑选择无机铵盐代替黄豆饼粉进行工业发酵生产。
pH能影响菌株形态、生长以及对营养物质吸收和代谢物产生[32]。在菌株GXUN-20 pH单因素优化研究中,前期pH单因素研究设计pH范围为4~10,得出最适产酶pH为8,考虑到较强度的酸碱会影响菌株产酶能力,所以在前期的实验基础上缩小pH优化范围,最后pH优化范围为7.8~9.0,得出该菌株最适发酵产酶pH为8.4。在单因素温度优化研究中GXUN-20菌株最适产酶温度为30 ℃,随着温度的升高,酶蛋白失活变性,GXUN-20菌株产几丁质酶活力降低。
几丁质酶是一类差异较大的水解酶,由于菌株的来源不同,其酶学性质不尽相同,几丁质酶对底物的亲和力也不同[16],本研究测定酶活力是以几丁质粉末为底物,还需进一步使用虾蟹壳粉末为底物,测定该菌株产生的几丁质酶对虾蟹壳粉末的降解效果,利用几丁质酶直接降解虾蟹壳粉末,制备虾蟹壳降解产物,才能真正地实现虾蟹壳废弃物的资源化利用。研究结果还发现GXUN-20对黑曲霉、立枯丝核具有抑菌作用,因此,可以尝试将该菌株投入大田实验,研究生防菌剂来达到生物防治植物真菌病害的目的。
