基于聚类分析和主成分分析的洋槐蜜成熟过程中主要成分变化研究
2021-12-16吴美佳黎洪霞周金慧陈兰珍
吴美佳,佘 僧,黎洪霞,尹 欣,周金慧,2,陈兰珍,2,
(1.中国农业科学院蜜蜂研究所, 北京 100093;2.农业农村部蜂产品质量安全控制重点实验室, 北京 100093)
蜂蜜作为一种天然食品,经蜜蜂采集蜜源植物的花蜜或分泌物,在蜂巢中经浓缩、挥发等加工酿制而成。蜂蜜中富含多种营养成分,如糖类、蛋白质、矿物质、酶以及其它微量物质维生素、有机酸、酚类物质和芳香物质等[1-2]。蜂蜜中的低聚糖和多酚具有很高的生物活性功能及医药价值。低聚糖可不经肠胃消化而直接被人体吸收,以减少肠胃负担,此外还具有调节血糖、抗菌等功效[3],酚类化合物在预防和治疗胃肠道疾病、水肿、癌症、代谢问题、心血管疾病及炎症等方面有很好的应用[4-6]。蜂蜜品质的好坏主要受蜜源植物、地理气候、蜂种、后期加工储存以及蜂蜜是否成熟等多种因素的影响[7],其中蜂蜜的成熟过程决定了真实蜂蜜全部的营养物质成分[8]。我国传统养蜂方式大多采取“追花逐蜜”,为在花期内增大产量和减少成本以达到高利润的目的,会采取提前摇蜜、缩短取蜜周期的方式[9]。这种生产模式下的蜂蜜并未成熟,含水量较多,需要人工进行浓缩处理,会造成蜂蜜营养物质的损失。造成这种情况的原因除了我国特殊的养蜂模式外,还有蜂蜜的自然成熟过程研究不足,且缺乏完善的成熟蜜判定标准。洋槐蜜来源于木本植物洋槐(Robinia pseudoacaciaL.)的花蜜,不易结晶、味道香甜醇厚、略有清香味[10],是一种深受消费者喜爱的单花种蜂蜜。我国北方地区是洋槐蜜的主产区,主要分布于辽宁、河北、山西、山东、陕西和甘肃等地。受地域、气候等环境因素的影响,各地的洋槐开花时间略有差异,一般集中在四月至六月。相对油菜、荆条等蜜源植物而言,洋槐的花期及流蜜期较短,一般维持在15 d和7 d左右。为增大洋槐蜜产量,在洋槐花期及流蜜期内会采取提前摇蜜的方式,使得洋槐蜜成熟度不足。
已有相关文献对蜂蜜在成熟过程中营养物质的变化进行报道,迟韵阳[11]测定了油菜和洋槐蜜的花蜜、蜜囊蜜、水蜜和成熟蜜的糖含量,发现蜂蜜成熟过程中主要发生的变化为蔗糖水解为果糖和葡萄糖,且随着蜜蜂的不断加工,蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖、海藻糖等糖的总含量呈现上升趋势。马天琛[12]研究表明,成熟和非成熟洋槐蜜的理化指标存在显著差异(P<0.05),非成熟洋槐蜜经浓缩后总酚酸和总黄酮含量明显下降。Gismondi等[13]通过对比洋槐蜜和洋槐花蜜,发现洋槐蜜成熟以后其糖及简单酚类等物质含量增加,水分含量显著降低,此外,研究还发现成熟洋槐蜜的体外抗氧化、真核细胞抗氧化及抑菌实验效果都优于洋槐花蜜。然而,目前尚未发现对蜂蜜成熟过程中低聚糖及多酚类物质含量变化的相关研究。
我国目前缺乏成熟蜜的判定依据,本研究通过测定洋槐蜜成熟过程中水分、单糖及二糖、9种低聚糖及18种多酚含量,揭示其营养物质和生物活性的变化规律,挖掘成熟洋槐蜜的特征指标,旨在为成熟洋槐蜜的采收提供合理意见,并为成熟蜂蜜标准制定提供数据和理论支撑。
1 材料与方法
1.1 材料与仪器
本实验选取山西省晋城市沁水县(海拔1010 m,N: 35°52′40,E: 112°15′48)作为采样点,为保证蜜源充足和排除其他干扰因素,试验时间选择洋槐花期的5月中旬,从同一蜂场选取意蜂蜂群无病害且群势相同的三个蜂箱,并提前对其巢脾做清空处理;分别从三个蜂箱内采集第3、5、8和11 d蜂蜜样本,每个蜂箱采集3个样本,共收集36个样本。乙腈、吡啶、β-苯基葡萄糖苷、HMDS+TMS+吡啶、葡萄糖、果糖、蔗糖、麦芽糖和9种低聚糖标准品(麦芽酮糖、松二糖、帕拉金糖、异麦芽糖、麦芽三糖、潘糖、蔗果三糖、吡喃基葡蔗糖、松三糖) 北京百灵威科技有限公司;18种多酚标准品:没食子酸、原儿茶酸、对羟基苯甲酸、咖啡酸、对香豆酸、阿魏酸、芦丁、苯甲酸、杨梅酮、桑色素、槲皮素、柚皮苷、芹菜素、山奈酚、柯因、松属素、咖啡酸苯乙酯、高良姜素 美国Sigma-Aldrich公司;所有试剂未明确标注纯度的均属于分析纯。
阿贝折光仪 上海精密科学仪器有限公司;PL203电子天平(精确度:0.0001) 美国梅特勒-托利多仪器有限公司;Milli-Q型纯水器 美国Millipore公司;CR22GⅡ冷冻离心机 日本Himac公司;TTLDC氮吹仪 北京同泰联科技发展有限公司;恒温干燥箱 上海一恒科学仪器有限公司;2695-高效液相色谱仪、6460-高效液相色谱串联质谱仪 美国安捷伦科技有限公司;QP2010-PIUS气相色谱-质谱联用仪 日本岛津公司。
1.2 实验方法
1.2.1 样品处理 36个洋槐蜜样品均先室温放置2 h后,搅拌使样品混合均匀。
1.2.2 水分、单糖及二糖含量测定 水分测定方法参考AOAC Official Method 969.38[14]和Heinz-Dieter等[15]的方法,使用阿贝折光仪在25 ℃条件下进行测定。果糖、葡萄糖、蔗糖、麦芽糖的测定方法参考《GB 5009.8-2016 食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》[16]。具体步骤为:准确称取2.0 g蜂蜜样本(精确至0.0001 g)至50 mL容量瓶中,加水定容至刻度,混匀,4℃下8000 r/min离心5 min,取上清液经0.45 μm滤膜过滤后装入1.5 mL进样瓶,利用HPLC进行测定。
1.2.3 低聚糖含量测定 9种低聚糖的检测方法参照She等[17]的方法。具体步骤为:称取0.5 g洋槐蜜样本于50 mL离心管中,向其中加入25 mL 80%乙醇溶液,旋涡充分溶解,于4 ℃下10000 r/min离心10 min后,取上清液 100 μL,50 ℃ 下氮气吹干,加入20 μLβ-苯基葡萄糖苷(0.25 mg/mL,溶于吡啶),加入200 μL 2%盐酸羟氨溶液,于70 ℃下反应30 min,然后加入衍生剂HMDS+TMS+吡啶300 μL,于70 ℃下反应 40 min,在 4 ℃下 10000 r/min离心 5 min,取上清液,利用GC-MS进行测定。
1.2.4 多酚含量测定 18种多酚类物质的检测方法参考Tanleque-Alberto等[18]和Dittgen等[19]的方法。具体步骤为:称取洋槐蜜样本5.0 g,置于50 mL离心管中,加入30 mL盐酸水溶液(pH=2),旋涡充分溶解,于4 ℃下10000 r/min离心10 min,取上清液待固相萃取。Oasis HLB固相萃取柱依次用10 mL甲醇和10 mL盐酸水溶液(pH=2)活化,然后将蜂蜜样本上清液倒入活化后的Oasis HLB固相萃取柱,再用10 mL超纯水清洗萃取柱,随后用10 mL甲醇洗脱酚类物质。洗脱液在40 ℃氮气吹干后,用1 mL 0.1%甲酸:乙腈(90:10, v/v)溶液溶解。将复溶液用0.22 μm尼龙膜过滤后装入1.5 mL进样瓶,利用HPLC-MS/MS进行测定。
1.3 数据处理
采用Excel 2016进行数据整理,用SPSS19.0 统计分析软件(IBM,美国)对数据进行方差分析和显著性检验(采用LSD法进行多重比较,不同小写字母表示在P<0.05水平下差异显著),柱状图和折线图采用 Origin 8.5(Origin Lab,美国)绘制,热点图和聚类图通过上传数据到在线程序中绘制完成,网址如下:https://software.broadinstitute.org/morpheus/。主成分分析利用SIMCA 14.1软件(Umetrics,瑞典)完成。每个样本做三次平行实验,同一蜂箱内三个样本做平均值处理,聚类分析和主成分分析前,对数据进行标准化处理。
2 结果与分析
2.1 洋槐蜜成熟过程中水分、单糖及二糖含量变化规律
表1为洋槐蜜成熟过程中水分、单糖及二糖含量变化图,结果表明,水分含量在洋槐蜜成熟过程中不断降低,且在不同成熟天数下含量差异显著(P<0.05)。在第11 d封盖时水分含量为16.33 g/100 g,整个成熟过程中水分含量下降了5.77 g/100 g。此外,果糖在洋槐蜜不同成熟天数下无显著性差异(P>0.05),含量保持稳定。而葡萄糖含量在不同成熟天数下差异显著(P<0.05),呈现先升高后降低的趋势。蔗糖和麦芽糖未检出。
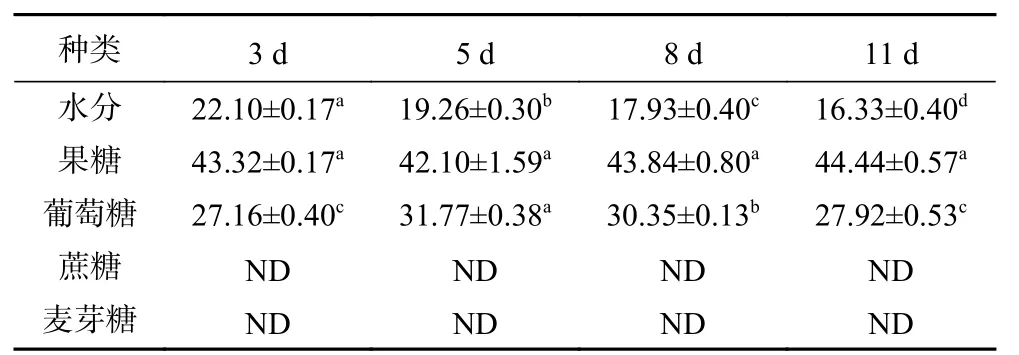
表1 洋槐蜜成熟过程中主要成分含量(g/100 g)Table 1 Main components contents of acacia honey during the ripening process (g/100 g)
水分含量是评定蜂蜜质量标准的重要参数指标。蜂蜜成熟过程中水分含量下降,主要是由于蜂巢中内勤蜂不断煽动翅膀加速水分蒸发,并将蜜液涂到巢房壁上以增大水分蒸发面积[20]。而葡萄糖含量在洋槐蜜成熟后期含量下降,可能是被蜂蜜中的葡萄糖氧化酶氧化成过氧化氢和葡萄糖酸所致[21]。
2.2 洋槐蜜成熟过程中低聚糖含量变化规律
低聚糖在洋槐蜜成熟过程中含量变化趋势(见图1)可以归纳为以下几个方面:麦芽酮糖(0.54~1.39 g/100 g)、松二糖(1.78~3.43 g/100 g)、吡喃基葡蔗糖(0.20~2.63 g/100 g)、异麦芽糖(0.13~0.38 g/100 g)的含量大致呈现上升趋势,且成熟后期与成熟初期含量差异显著(P<0.05);帕拉金糖(0.16~1.23 g/100 g)的含量先升高后降低;三糖的含量逐渐降低,其中蔗果三糖(0.17 g/100 g降至 0.08 g/100 g)、松三糖(3.53 g/100 g降至0.06 g/100 g)表现的较为明显,成熟后期其含量显著低于初期含量(P<0.05);麦芽三糖(0.06 g/100 g 左右)和潘糖(0.06 g/100 g左右)的含量在洋槐蜜成熟过程中无明显变化,含量都较低。
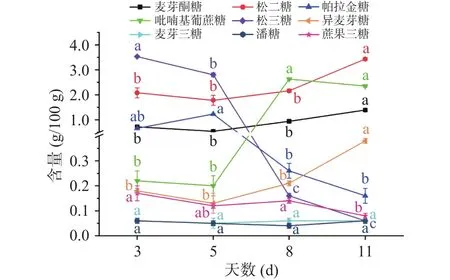
图1 洋槐蜜成熟过程中低聚糖含量变化Fig.1 Changes of oligosaccharides contents of acacia honey during the ripening process
对于上述低聚糖含量的变化趋势,上级营养物中部分三糖或多糖的分解过程非常缓慢,可能是由于花蜜中各糖类化合物相应的分解酶少,因此蔗果三糖、松三糖在洋槐蜜成熟初期含量较高。此后,松三糖的含量在洋槐蜜成熟过程中不断降低,可能是被α-葡萄糖苷酶转化所致,α-葡萄糖苷酶由蜜蜂分泌产生,且随着蜜蜂不断吞吐蜂蜜,酶含量相应增加,松三糖被转化为葡萄糖和果糖[22],故松三糖的含量持续降低,其含量在洋槐蜜不同成熟天数下差异显著,故松三糖可以作为判定洋槐蜜成熟的潜在特征指标。而部分糖类物质如吡喃基葡蔗糖、异麦芽糖在初始天数中的含量不高,这可能是因蜜源植物洋槐花蜜腺体中这些糖类化合物的含量很低所致。此外,麦芽三糖和潘糖的含量在洋槐蜜成熟过程中一直处于较低水平,故不建议二者作为蜂蜜成熟度判定的指标。
2.3 洋槐蜜成熟过程中多酚含量变化规律
图2A、B、C、D为洋槐蜜中多酚在不同成熟天数下的含量变化图。18种多酚类物质的含量变化大致可分为以下几种趋势:从整体上看,芦丁、山奈酚、原儿茶酸、对羟基苯甲酸的含量在洋槐蜜成熟过程中呈现上升趋势,其中山奈酚、对羟基苯甲酸含量在不同成熟天数下均明显上升,而芦丁、原儿茶酸在采蜜期3 d之前含量较低,3 d之后含量显著上升(P<0.05),在 5~11 d差异不显著;此外,没食子酸、桑色素、阿魏酸、高良姜素、咖啡酸苯乙酯、咖啡酸、柯因的含量呈现先升高后降低的趋势,其中没食子酸、阿魏酸和柯因在采蜜期5~8 d含量较高,咖啡酸、桑色素在5 d时含量最高,而高良姜素、咖啡酸苯乙酯在8 d时含量最高;而苯甲酸、对香豆酸含量呈现先降低后升高趋势;柚皮苷含量呈现波动式变化;而杨梅酮、槲皮素、芹菜素、松鼠素在洋槐蜜成熟过程中含量大致趋于平稳,无显著变化。
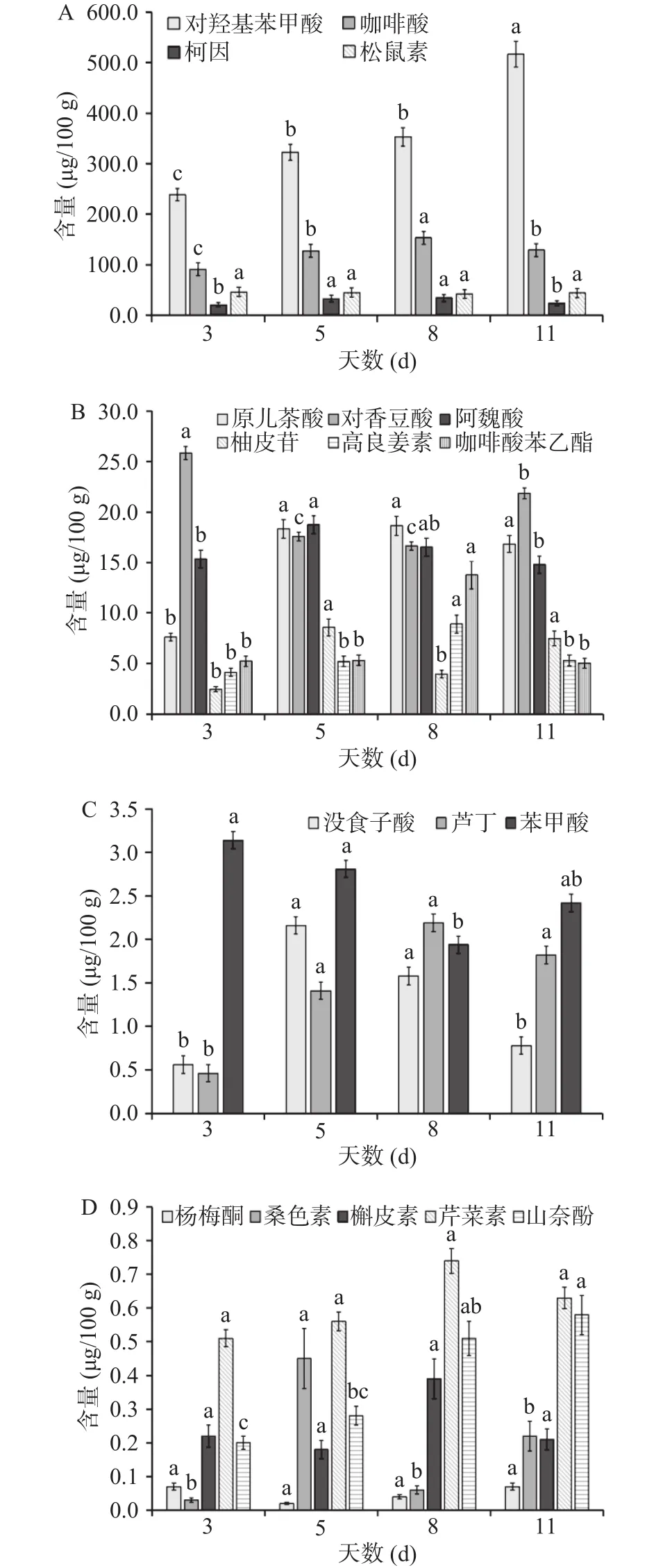
图2 洋槐蜜成熟过程中多酚含量变化Fig.2 Changes of polyphenol contents of acacia honey during the ripening process
本文所述18种多酚类物质曾被广泛应用于真实性溯源和营养学等研究[23-27]。本研究发现,上述多酚的含量在洋槐蜜整个成熟过程中存在差异。其中对羟基苯甲酸的含量在洋槐蜜成熟过程中一直占据总酚含量(18种多酚含量总和)的50%左右,且随着蜂蜜成熟度的提升,含量不断升高。对羟基苯甲酸和咖啡酸含量在洋槐蜜不同成熟天数下均变化显著,建议可以作为评价洋槐蜜是否成熟的指标。此外,黄酮醇类化合物的含量在整个过程一直低于其他类别的化合物。黄酮醇类物质中除芦丁、山奈酚含量不断升高外,桑色素、高良姜素含量都呈现先升高后降低的趋势,而杨梅酮和槲皮素的含量在蜂蜜成熟过程中趋于稳定。据文献报道,花蜜中存在黄酮类物质,洋槐花蜜的黄酮类化合物是鼠李糖苷,它们不被蜂蜜和蜜蜂唾液中存在的酶水解[28-29],这可能是山奈酚等几种物质在洋槐蜜成熟过程中含量没有减少的原因。而桑色素和高良姜素在蜂蜜成熟后期过程中含量有下降趋势,可能是由于蜂蜜中存在的过氧化氢导致这几种黄酮醇类化合物降解[23]。与此同时,没食子酸、山奈酚、对香豆酸、阿魏酸、对羟基苯甲酸和柯因六种多酚类物质在洋槐蜜成熟3和11 d时相较5~8 d时含量变化明显,这可能意味着蜂蜜成熟初期和后期是多酚变化最明显的时期。而杨梅酮、槲皮素、芹菜素和松鼠素含量在不同成熟天数下差异不明显,在洋槐蜜成熟过程中其含量一直保持稳定,故不建议作为判定洋槐蜜是否成熟的指标。
2.4 聚类分析
层次聚类分析(HCA)可以显示数据基于不同度量的自然分组[30],热点图和聚类图能分别显示数据的活动和聚集状态,实现数据的视觉互补化。以标准化后的9种低聚糖和18种多酚数据为变量,对不同成熟天数下的洋槐蜜进行聚类分析,聚类距离采用欧式距离,聚类方法采用单链连接法,热点图及树状图如图3所示。当距离为7时,成熟天数为3、5、8和11 d的洋槐蜜被很好地划分为4类。
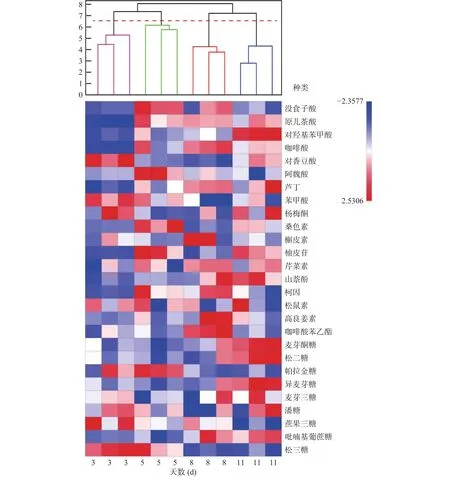
图3 洋槐蜜成熟过程中低聚糖及多酚含量热点-树状图Fig.3 Heat map and dendrogram of oligosaccharide and polyphenol contents of acacia honey during the ripening process
2.5 主成分分析
主成分分析是一种数据降维技术,它将大量原有的相关变量替换为少量不相关的主成分(即派生变量),同时尽可能多地保留原始数据集中存在的内部变量信息[31]。对不同成熟天数下的洋槐蜜中9种低聚糖和18种多酚进行主成分分析,提取出特征值大于1的3个主成分。其中第一主成分特征值为4.35,贡献率为40.39%,第二主成分特征值为2.92,贡献率为20.95%,第三主成分特征值为1.5,贡献率为15.0%,三个主成分累计贡献率达到76.34%,可以解释原始数据的大部分信息。前三个主成分得分图及载荷图如图4所示,图4A显示不同成熟天数下的洋槐蜜分布在不同的区域,且无重叠,说明低聚糖结合多酚可以很好地实现不同成熟度洋槐蜜的区分。图4B显示了第一主成分主要与山奈酚、芦丁、麦芽三糖、异麦芽糖、麦芽酮糖、松二糖、原儿茶酚、咖啡酸、对羟基苯甲酸、蔗果三糖、苯甲酸、松三糖相关性较强,第二主成分主要与没食子酸、柯因、咖啡酸苯乙酯、松鼠素、高良姜素、帕拉金糖、对香豆酸、松二糖、麦芽酮糖、异麦芽糖、潘糖相关性较强。第三主成分主要与杨梅酮、帕拉金糖、柚皮苷、对羟基苯甲酸、阿魏酸、松三糖、槲皮素、松鼠素、高良姜素、柯因相关性较强。
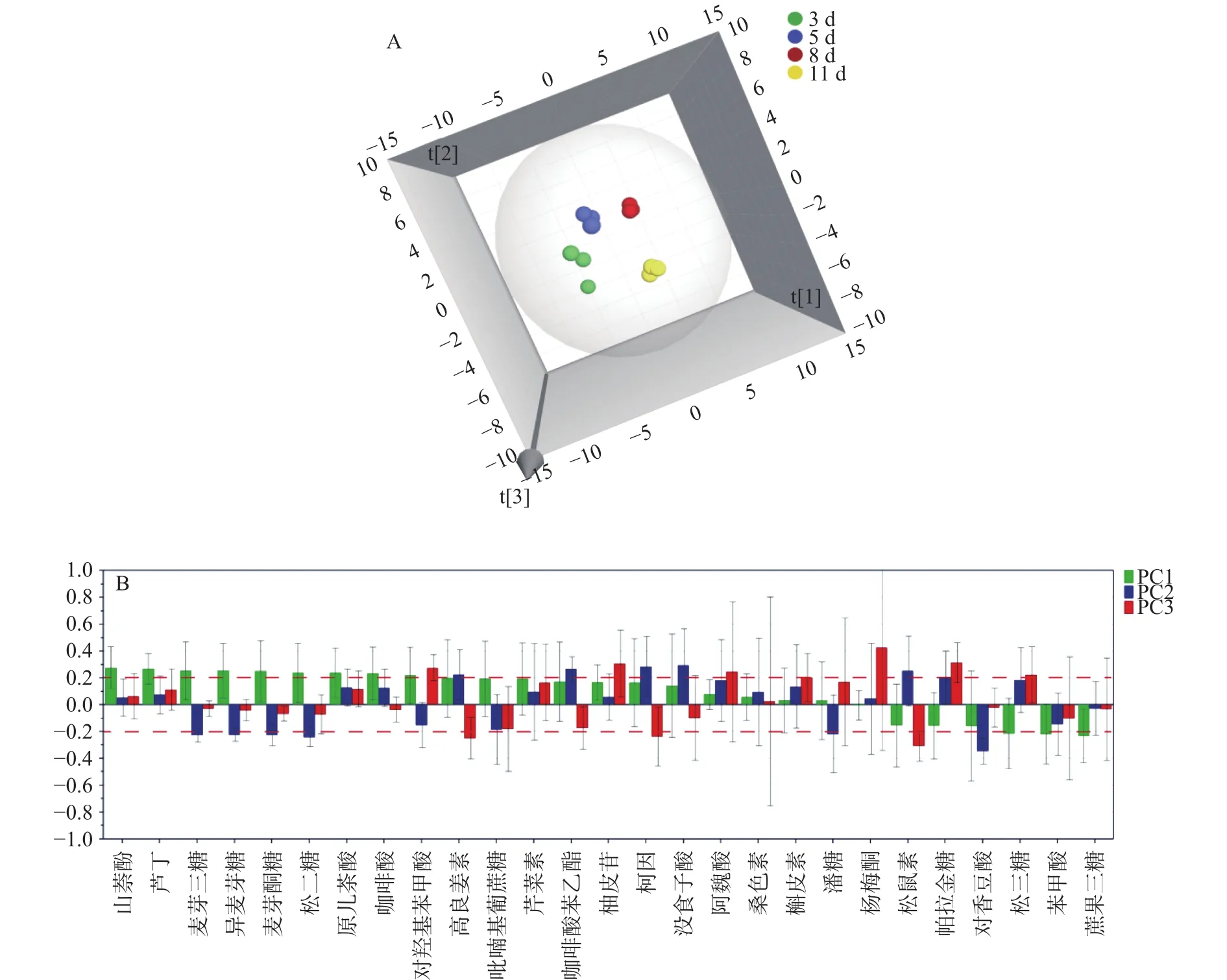
图4 洋槐蜜主成分分析三维得分图(A)及载荷图(B)Fig.4 3-dimensional score plot (A) and loading plot (B) of PCA of acacia honey
3 结论
本文通过测定洋槐蜜成熟过程中的水分、单糖及二糖、9种低聚糖以及常见的18种多酚类化合物含量,并结合分层聚类及主成分分析两种化学计量学方法进行分析。结果表明:洋槐蜜在成熟过程中,水分含量不断下降,低聚糖中部分三糖,如蔗果三糖、松三糖的含量不断降低,少数三糖如吡喃基葡蔗糖含量升高,而麦芽三糖和潘糖的含量保持稳定,一直处于较低水平。多数二糖如麦芽酮糖、松二糖、异麦芽糖的含量不断上升,帕拉金糖的含量则属于先升高后降低。其次,多酚中大部分物质含量呈现一定的规则性变化。多酚类物质中芦丁、山奈酚、原儿茶酸、对羟基苯甲酸的含量总体升高,没食子酸、桑色素、阿魏酸、高良姜素、咖啡酸苯乙酯、咖啡酸、柯因的含量呈现先升高后降低的趋势,苯甲酸、对香豆酸含量呈现先降低后升高趋势。而松三糖、对羟基苯甲酸和咖啡酸含量在洋槐蜜不同成熟天数下分别呈现显著降低、显著升高和显著升高趋势(P<0.05),建议可以将这三种物质作为评价洋槐蜜是否成熟的指标。此外,聚类分析和主成分分析结果都表明:低聚糖和多酚可以很好地实现对不同成熟天数下洋槐蜜的区分。综上可知,低聚糖和多酚结合化学计量学对研究洋槐蜜成熟过程具有一定的参考价值。
