碱提砂仁多糖的结构表征及其抗氧化活性研究
2021-12-16阮心眉戴涛涛袁建成
韦 志,阮心眉,戴涛涛,付 敏,袁建成,李 俶, ,陈 军
(1.南昌大学, 食品科学与技术国家重点实验室,江西南昌330047;2.广西壮族自治区农业科学院, 广西果蔬贮藏与加工新技术重点实验室,广西南宁530007)
砂仁(Amomum villosum,A.villosum)是姜科(Zingiberaceae)豆蔻属的植物果实,与益智仁、槟榔、巴戟天并称为我国“四大南药”,同时也是《中华人民共和国药典》(2015年版)收录的重要品种[1]。砂仁味道丰富,有酸甜苦辣咸味,砂仁的花、果、根、茎、叶部位均可入药。它具有“化湿开胃、理气止痛、温脾止泻、行气安胎”等功效[2]。研究结果表明砂仁中的挥发油成分具有显著的抗溃疡、促进肠胃蠕动、胃排空和镇痛等作用[3]。砂仁中含有较高含量的多酚、多糖等多种生物活性成分,具有明显的抗炎、抗氧化、抗肿瘤、镇痛等作用[4-6]。
多糖一般是指由十种或更多单糖通过糖苷键链接而成的聚合物。植物多糖是一种天然大分子,在其生命活动中发挥重要作用[7]。近年来,多糖因无毒、可生物降解、生物相容性好,而且与合成聚合物相比价格更低等优点备受关注。所有这些优点赋予了多糖及其衍生物在不同领域的广泛应用,如食品、生物医学等领域[8]。
目前,溶剂法提取多糖主要包括热水浸提、酸浸提、碱浸提、螯合剂浸提(草酸铵、EDTA等),不同溶剂提取的多糖具有不同的结构及生物活性[9],这可能是因为植物中多糖往往与其他成分结合共存,以及多糖在不同溶剂条件下的存在形式不同导致(如构象等)。热水浸提法只能提取一些水溶性的长链多糖分子,酸法是工业上提取果胶的常用技术,碱法则是通过释放与多酚或其它小分子结合的多糖,螯合剂的作用机理则是与钙离子结合降低多糖大分子之间的交联。有文献报道,碱法提取的多糖在抗氧化性上优于传统的水提多糖[10]。
为了获得更好的生物活性的多糖,本实验采用碱浸提法提取砂仁多糖,探究碱性提取条件下砂仁多糖的结构特性和抗氧化性,旨在为砂仁多糖的应用提供理论依据,对砂仁资源的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
海南砂仁 湛江中国热带农业科学院农产品加工研究所;咔唑、单糖组成标准品、3-甲基-1-苯基-2-吡唑啉-5-酮(PMP)、1,1-二苯基-2-三硝基苯肼(DPPH)、葡聚糖标准品、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、半乳糖醛酸 美国Sigma公司;考马斯亮蓝G-250 北京索莱宝科技有限公司;牛血清白蛋白 阿拉丁试剂(上海)有限公司;葡萄糖标准品 西陇科学股份有限公司;所有试剂 均为分析纯。
TGL-20B高速离心机 上海安亭科学仪器厂;HR-10中药粉碎机 浙江哈瑞工贸有限公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;AlpHa1-2LD冷冻干燥机 德国Christ公司;TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;Agilent 1260高效液相色谱仪(配Brookhaven BIDNDC示差检测器)、Agilent 1260型液相色谱仪(配DAD检测器) 美国Agilent公司;Nicolet 5700傅里叶红外光谱仪 美国热电公司;TGA 4000热重分析仪 美国PE公司;JSM-6701F冷场发射扫描电镜 日本电子株式会社;D8 Advance X射线衍射仪德国Bruker公司;Gen 5通用型酶标仪 美国Bio Tek公司。
1.2 实验方法
1.2.1 砂仁多糖样品制备 根据Gao等[11]方法稍作修改提取砂仁多糖。采用中药粉碎机将干燥后(含水量小于5%)砂仁粉碎,过60目标准筛。80%乙醇浸泡砂仁粉末过夜,除去脂溶性杂质。挥发蒸干乙醇后,加入3000 mL的0.1 mol/L NaOH(含0.01 mol/L NaBH4),在室温条件下提取多糖2 h。粗提液经离心(4800 r/min,15 min)得上清液,然后经旋转蒸发仪在60 °C条件下,浓缩上清液至原上清液的1/4后,加入95%乙醇使溶液乙醇浓度达到80%。样品经醇沉过夜后离心取沉淀,加水复溶。以Sevag法去除蛋白,即氯仿-正丁醇(4:1,v/v)溶液与砂仁多糖水溶液振摇混合(1:4,v/v),重复四次,使蛋白质变性析出,离心去除变性蛋白。蒸馏水透析(8~14 kDa)3 d。然后旋蒸,浓缩,经真空冷冻干燥获得砂仁多糖。
1.2.2 砂仁多糖的化学组成测定
1.2.2.1 总糖含量测定 采用苯酚-硫酸法[12]测定砂仁多糖的总糖含量。取1.0 mL不同浓度的葡萄糖标准品溶液或0.1 mg/mL的多糖溶液或蒸馏水(空白),与1.0 mL的5%的苯酚溶液混合均匀,加入4.0 mL浓硫酸摇匀混合,静置30 min,于490 nm处测定吸光度值。以葡萄糖标准品溶液的浓度(μg/mL)为横坐标,吸光度值为纵坐标,绘制标准曲线。以标准曲线计算砂仁多糖的总糖含量(μg/mL)。
1.2.2.2 糖醛酸含量测定 采用硫酸-咔唑法[13]测定多糖中的糖醛酸含量。取1.0 mL的不同浓度的半乳糖醛酸溶液或1 mg/mL的多糖溶液或蒸馏水(空白),在冰水浴条件下加入6.0 mL浓硫酸混合均匀,放入85 ℃水浴中恒温保持20 min,取出冷却至室温后,分别向各管中加入0.2 mL的0.1%咔唑-乙醇溶液,在室温下放置2 h,于530 nm处测定吸光度值。以半乳糖醛酸溶液的浓度(μg/mL)为横坐标,吸光度值为纵坐标,绘制标准曲线。以标准曲线计算砂仁多糖的糖醛酸含量(μg/mL)。
1.2.2.3 蛋白质含量测定 采用考马斯亮蓝法[14]测定蛋白质含量。取1.0 mL的不同浓度的牛血清白蛋白溶液或0.1 mg/mL的多糖溶液或蒸馏水(空白)加入5.0 mL的考马斯亮蓝溶液混匀,静置5 min。于595 nm处测定吸光度值。以牛血清白蛋白的溶液浓度(μg/mL)为横坐标,吸光值为纵坐标,绘制牛血清白蛋白标准曲线。以标准曲线计算砂仁多糖的蛋白质含量(μg/mL)。
1.2.3 多糖的单糖组成测定 参考Hu等[15]的方法,称取2.0 mg冻干的多糖样品,加入2 mol/L三氟乙酸溶液0.5 mL,在120 °C条件下水解120 min后用氮吹仪吹干。向干燥后的样品中加入溶于无水甲醇的0.5 mol/L的PMP试剂和0.3 mol/L的NaOH溶液各0.5 mL,充分混匀后置于70 °C水浴反应30 min。冷却至室温后,加入0.5 mL 0.3 mol/L HCl,混和均匀。加入1.0 mL氯仿,充分振荡萃取,4800 r/min离心15 min,去除氯仿层,共萃取三次。合并滤液,取水相层,过0.22 μm滤膜后,采用高效液相色谱检测。单糖标准品无需水解步骤,其他步骤同样品处理。检测配置与条件:Agilent 1260型液相色谱仪(配DAD 检测器)、Thermo ODS-2 C18柱(4.6×250 mm,5 μm)。流动相为磷酸盐缓冲液(0.1 mol/L,pH7.0)与乙腈的混合液(体积比82:18),流速1.0 mL/min,柱温25 ℃,进样量10 μL,检测波长245 nm。
1.2.4 多糖的相对分子量测定 采用高效尺寸排阻色谱法对得到的多糖进行分子量测定[16]。采用Agilent 1260型液相色谱仪(配 Brookhaven BIDNDC示差检测器),Agilent PL aquagel-OH系列凝胶过滤色谱柱(7.5×300 mm,8 μm)。流动相为超纯水(含 0.02% NaN3),流速为 0.5 mL/min,柱温 30 °C,进样量100 μL。配制1.0 mg/mL多糖溶液或1.0 mg/mL不同分子量(Mw:5、25、50、150、410、670 kDa)的葡聚糖标准品溶液,过0.45 μm水相滤膜后,进样检测。以葡聚糖分子量标准品的对数值(lgMw)为纵坐标,保留时间(min)为横坐标,绘制曲线。以标准曲线计算砂仁多糖的相对分子量(kDa)。
1.2.5 红外光谱分析(FTIR) 采用傅里叶变换红外光谱对多糖的分子结构进行分析[17]。取样品约1.0 mg,置于干燥的玛瑙研钵中,在红外灯照射下加入KBr约140 mg,研磨均匀后压片。用傅立叶红外光谱仪在400~4000 cm-1区内进行扫描,初步分析多糖的官能团。
1.2.6 扫描电镜(SEM)多糖的扫描电镜分析 取少量的干燥砂仁多糖样品粘着于样品台上,镀导电金,采用冷场发射扫描电镜在250倍和2000倍下进行观察[18]。
1.2.7 热重分析(TGA)多糖的热重分析 采用热重分析仪对砂仁多糖的热特性进行研究[19],样品称取5.0 mg,测试温度范围 30~600 °C,以 10 °C/min 的速率升温,在固定速率通氮气环境下测定多糖的受热质量变化情况。
1.2.8 X衍射分析(XRD) 采用X衍射仪对多糖的晶体结构进行分析[20]。测定范围为 5°~50°(2θ),步长 0.02°,计数时间 1 s/步。
1.2.9 多糖的抗氧化性指标测定
1.2.9.1 DPPH自由基清除能力 参考Gomez-Mejia等[21]方法,将1.0 mL不同浓度多糖溶液(0~2 mg/mL)或抗坏血酸溶液(阳性对照)或乙醇溶液(空白)与1.0 mL 0.2 mmol DPPH(50%乙醇溶解)摇匀,避光孵育30 min后于517 nm处测量吸光值,实验均平行测定3次,以DPPH自由基清除率表示DPPH自由基清除能力,计算公式如下:
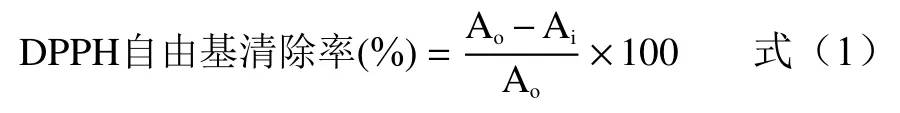
式中:中Ao为空白吸光度;Ai为样品或阳性对照吸光度。
1.2.9.2 ABTS+自由基清除能力 参考Deseo等[22]的方法,将 5.0 mL ABTS储备溶液(7 mmol/L)与5.0 mL K2S2O7溶液(2.45 mmol/L)混合后避光置于4 °C冰箱内反应12~16 h制备得ABTS溶液。反应前将ABTS溶液用磷酸缓冲液(0.1 mol/L,pH7.4)稀释至 734 nm处吸光度为 0.7±0.02,即 ABTS工作液。取40 μL多糖溶液或抗坏血酸溶液(阳性对照)或乙醇溶液(空白)于96孔板中,加入970 μL ABTS工作液混匀,避光反应6 min后用酶标仪测定734 nm下吸光度,以ABTS+自由基清除率表示ABTS+自由基清除能力,计算公式如下:
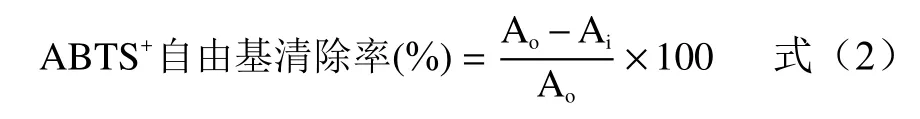
式中:中Ao为空白吸光度;Ai为样品或阳性对照吸光度。
1.2.9.3 羟基自由基清除能力 参考Wang等[23]的方法,取1.0 mL不同浓度的多糖溶液或抗坏血酸溶液(阳性对照)或乙醇溶液(空白)置于10 mL试管中,加入1.0 mL FeSO4溶液和1.0 mL水杨酸-乙醇溶液,混匀,加入1.0 mL H2O2溶液,充分混匀,放入37 °C水浴 30 min后,立即在510 nm处测定吸光值,平行三次,以羟基自由基清除率为表示羟基自由基清除能力,计算公式如下:
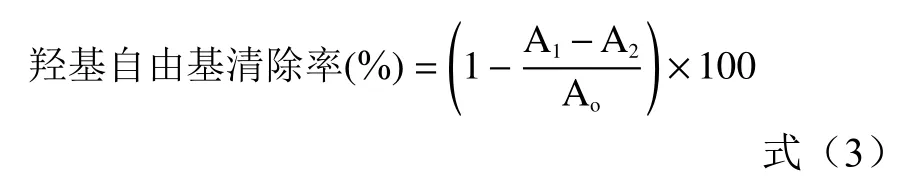
式中:中Ao为空白吸光度;A1为样品或阳性对照吸光度;A2为样品不加H2O2溶液的吸光度。
1.3 数据处理
本实验数据均重复测定三次。采用Excel2019和SPSS25.0统计分析软件对实验数据进行处理,结果表示为平均值±标准偏差。使用Origin 2020软件对实验数据进行作图。
2 结果与分析
2.1 砂仁多糖的得率与化学组成分析
本实验在碱性条件下,提取砂仁多糖,经脱蛋白处理后,测定其总糖含量、糖醛酸含量和蛋白质含量,标准曲线如图1。测定结果表明砂仁多糖的提取得率为3.97%±0.31%,总糖含量为 37.10%±1.43%,糖醛酸含量达到65.66%±2.02%,说明砂仁多糖是一种酸性多糖;蛋白质的含量为4.36%±0.71%,表明残留的蛋白可能是蛋白质溶于碱性溶液中,并与单糖结合,形成难以去除的蛋白质[24]。
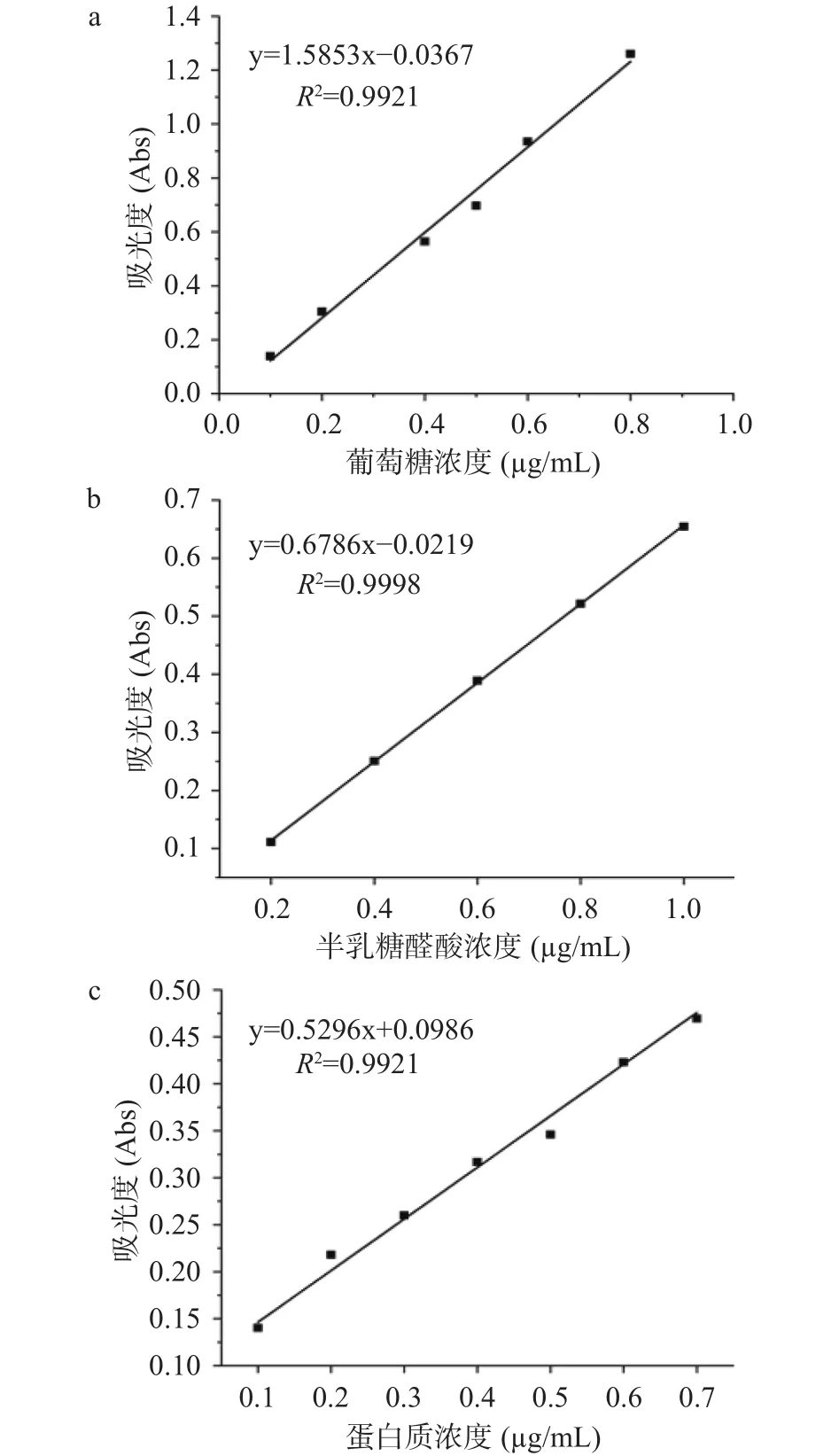
图1 砂仁多糖的化学组成含量测定的标准曲线Fig.1 Standard curve for determination of chemical composition of A.villosum polysaccharide
2.2 单糖组成分析
如图2液相色谱分析表明,砂仁多糖是一种杂多糖,含甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖。其相对摩尔百分比分别为 0.74%、0.71%、8.13%、13.41%、5.31%、14.84%、18.84%、38.02%。其中阿拉伯糖、木糖、半乳糖和半乳糖醛酸构成砂仁多糖的主要单糖成分。该结果与樊亚鸣等[25]研究的春砂仁多糖组成结果相似,均含有阿拉伯糖、甘露糖、葡萄糖和半乳糖,其他组分的不同可能是因为砂仁的产地和品种的不同。
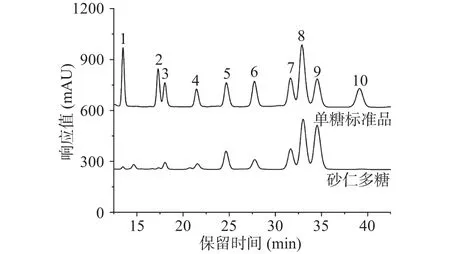
图2 砂仁多糖的单糖组成与单糖标准品Fig.2 GC chromatogram of the monosaccharide standards and monosaccharide composition of A.villosum
2.3 多糖相对分子量
如图3所示,依据多糖分子量大小Mw的对数值与保留时间成线性关系,绘制不同分子量的葡聚糖标准品的标准曲线:lgMw=-0.6746t+14.35(其中t表示保留时间),R2=0.9985。依据响应值最大时的保留时间,由标准曲线计算出砂仁多糖的相对分子量为95.46 kDa。
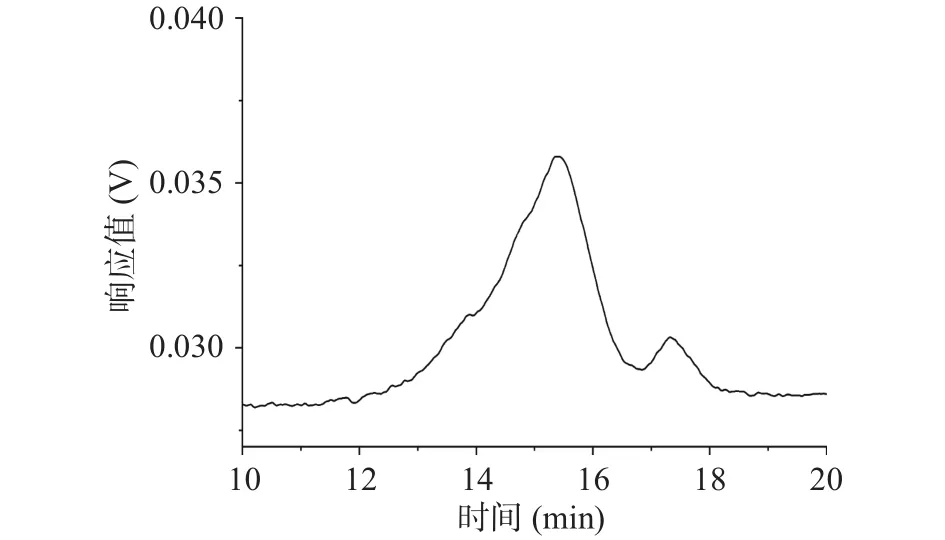
图3 砂仁多糖的相对分子量图Fig.3 Relative molecular weight curves of A.villosum polysaccharide
2.4 红外光谱分析
根据红外光谱吸收峰的位置和强度可判断多糖的基础官能团。一般来说,多糖的主要特征吸收峰位于 3100~3700 cm-1和 2800~3000 cm-1,前者被认为是分子间氢键和分子内氢键引起的O-H伸缩振动,后者归因于游离碳水化合物的C-H不对称伸缩振动[15]。如图4所示,在1615~1653 cm-1附近的强吸收峰,表明存在羰基的C=O不对称伸缩振动[23],而在1411~1423 cm-1附近的弱吸收峰则反映了羰基的C-O伸缩振动,表明多糖中含有糖醛酸[12],与砂仁多糖的化学组成结果一致。1075~1100 cm-1处的吸收峰,表明主链中存在吡喃糖环[26]。红外光谱表明砂仁多糖具备碳水化合物典型吸收峰,且存在吡喃糖环结构。
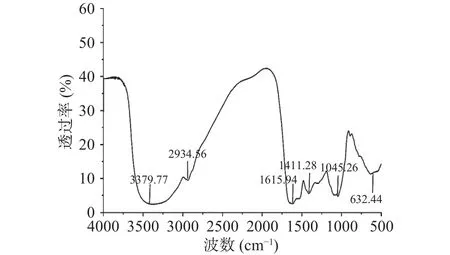
图4 砂仁多糖的红外光谱图Fig.4 FTIR spectra of A.villosum polysaccharide
2.5 扫描电镜
SEM图像提供了砂仁多糖的表面形貌特征。SEM结果表明(图5),砂仁多糖的表观形貌为片状结构。放大250倍可以看到,多糖形状不规则,大多为片状结构,有少量块状存在,碎片形状并不均一。该结果与Zhou等[27]研究结果一致,其观察到从阳春砂仁中提取的酸性多糖在SEM中呈现片状的疏松结构。放大2000倍下观察可见多糖表面粗糙,边缘不规则,这可能是冻干时冰升华。Zhu等[28]研究也发现,在高倍放大倍数下,多糖表面呈现不均匀的鳞片结构和少量的凹陷。

图5 砂仁多糖的扫描电镜图Fig.5 SEM images of A.villosum polysaccharide
2.6 热重分析
由图6热重分析曲线可以看出,砂仁多糖在高温过程中三次主要失重,可大概划分为40~150 °C、151~400 °C、401~600 °C 三个阶段。第一阶段可能为结晶水的散失[29],失重率约为4.21%;第二阶段可能为碳水化合物长链的降解和碎片的解聚,失重率约为30.55%[30],第三阶段质量损失减缓,可能是多糖的在进一步分解,剩下的多糖的热稳定性较好或者多数多糖已经碳化,从而导致失重缓慢[31]。在600 °C时剩余质量百分比为20.06%。不同来源的植物多糖往往具有相似的热重分析曲线,但其热降解温度和质量损失率可能存在差异。张华峰等[31]研究发现,当温度从248 °C升至350 °C时,滇黄精多糖的失重率约为58.59%,并将该现象其归因于多糖分子剧烈的解聚和分解作用。王占一等[32]研究发现石榴皮多糖在温度 225.4~327.9 °C内质量损失率为 46.5%,而以石榴皮多糖与亚硒酸钠为原料制备石榴皮多糖硒酸酯,其在600 °C前已经基本分解完全。由此可知,砂仁多糖具有较好的热稳定性。
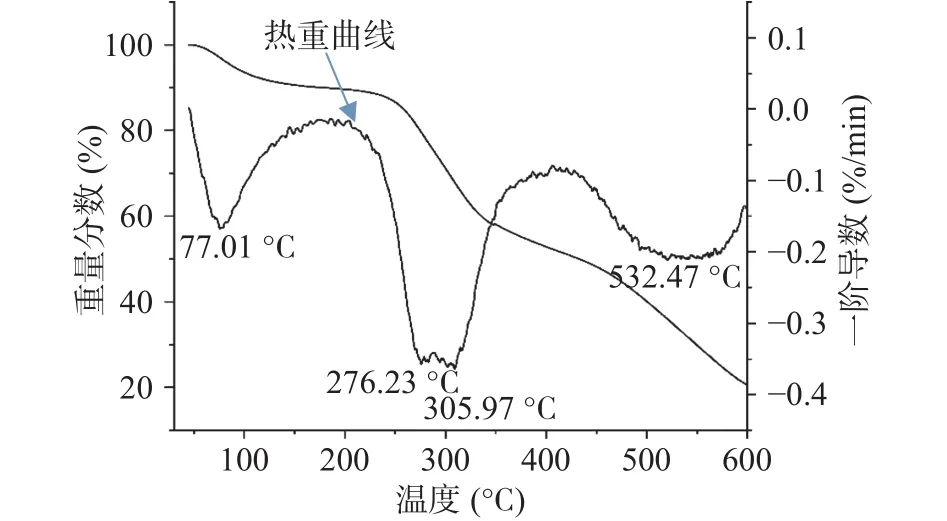
图6 砂仁多糖的热重分析曲线Fig.6 TGA of A.villosum polysaccharide
2.7 X衍射分析
采用X衍射对砂仁多糖的晶体结构进行分析。一般来说,衍射峰的尖窄可以反映晶体结构,衍射宽峰反映的是非晶结构,非晶区域的分子间键弱于晶体区域的分子间键[33]。如图7所示,XRD结果表明砂仁多糖在15°~30°之间,有一个峰宽较宽、强度较大的峰。因此,砂仁多糖的结晶度较低,属于低结晶度材料[34]。此外,半结晶区在20.75°。该结果与Zhu等[28]研究水提醇沉法提取海南砂仁多糖的X衍射的分析结果一致,均是半结晶结构。
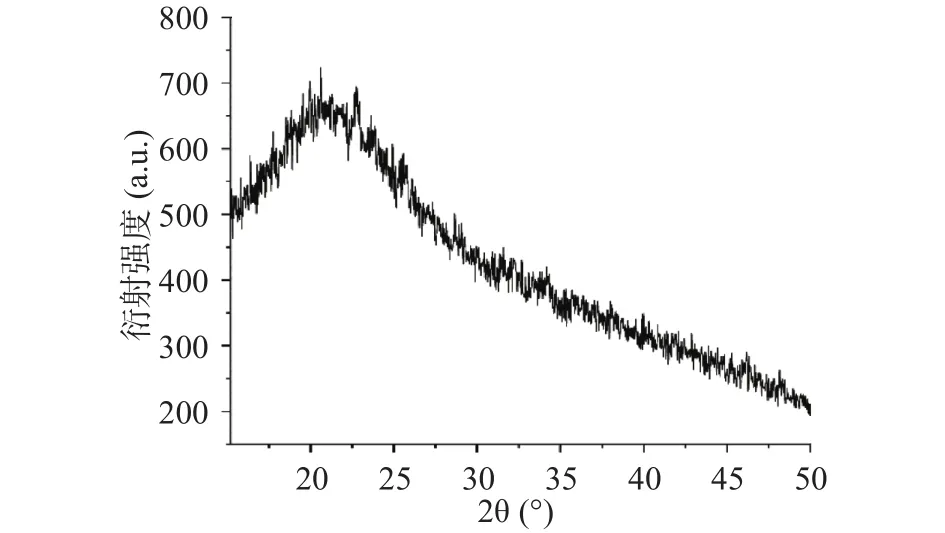
图7 砂仁多糖的X-衍射图Fig.7 XRD of A.villosum polysaccharide
2.8 砂仁多糖的体外抗氧化活性
2.8.1 DPPH自由基清除能力的测定 如图8a所示,砂仁多糖的DPPH自由基清除率在0~2.0 mg/mL范围内,表现出浓度依赖性,即随着多糖浓度的升高,其DPPH自由基清除率逐渐升高。在浓度为2.0 mg/mL时,砂仁多糖的自由基清除能力接近抗坏血酸,自由基清除率达到96.13%。而Zhang等[35]研究发现砂仁粗多糖在5.0 mg/mL浓度下,DPPH自由基清除能力为73.5%。本研究的砂仁多糖对DPPH自由基半数抑制对应的浓度(IC50)为0.81 mg/mL,显示出较好的抗氧化性。
2.8.2 ABTS+自由基清除能力的测定 如图8b所示,砂仁多糖的ABTS+自由基清除率在在0~2.0 mg/mL范围内,表现出浓度依赖性,即随着多糖浓度的升高,其ABTS+自由基清除率逐渐升高。砂仁多糖对ABTS+自由基半数抑制对应的浓度(IC50)为0.65 mg/mL。抗坏血酸在0.25 mg/mL时,达到最大抑制能力,但是在1.0 mg/mL时,砂仁多糖的自由基清除率达到了80.95%,清除率较高。相比于其他多糖,如仙人掌皮多糖[36](在10mg/mL时,对ABTS+自由基清除率为39.85%),砂仁多糖具有更强的ABTS+自由基清除能力。
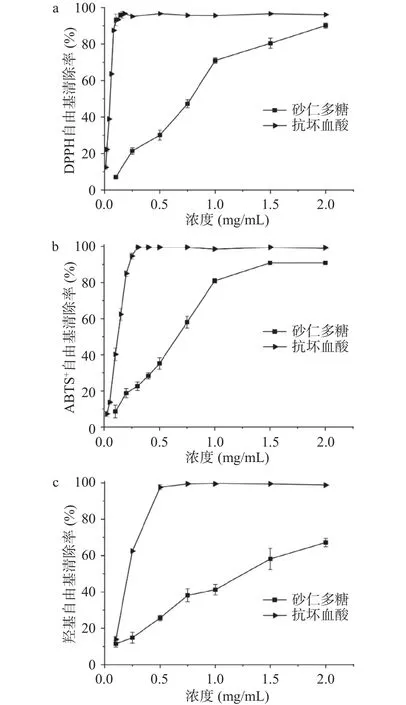
图8 砂仁多糖的体外抗氧化性Fig.8 In vitro antioxidant activities of A.villosum polysaccharide
2.8.3 羟基自由基清除能力的测定 如图8c所示,随着砂仁多糖浓度的增加,其羟基自由基的清除率增大。在0.5 mg/mL时,抗坏血酸的羟基自由基清除率达到97.65%。同时,砂仁多糖的羟基自由基清除率随着浓度的增大而增大,在2.0 mg/mL时,砂仁多糖的羟基自由基清除率达到67.22%,对羟基自由基半数抑制对应的浓度(IC50)为1.20 mg/mL。Zhang等[35]研究发现在5.0 mg/mL浓度下,阳春砂仁粗多糖的羟基自由基清除能力为66.3%,两者的羟基自由基清除能力相近。综上,砂仁多糖具有较好的抗氧化能力。
3 结论
本研究选用海南砂仁为原料,采用碱液浸提法提取多糖,对所得砂仁多糖进行理化性质、表观形貌、晶型和热重分析,并评价其体外抗氧化活性,以期为砂仁多糖发展奠定良好基础。主要结论如下:砂仁多糖的提取得率为3.97%,总糖含量为37.10%,糖醛酸含量为65.66%,蛋白质的残留含量为4.36%。砂仁多糖的主要单糖组成为阿拉伯糖、木糖、半乳糖和半乳糖醛酸,其摩尔百分比分别为38.02%、18.84%、14.84%和13.41%,且分子量为95.46 kDa;砂仁多糖是一种低结晶度、具有吡喃环、热稳定较好的片状酸性杂多糖,具备多糖普遍的表观形貌特征;砂仁多糖的三种体外抗氧化模型研究表明,砂仁多糖对DPPH自由基、ABTS自由基和羟基自由基的半数抑制对应的浓度(IC50)分别为 0.81、0.65和 1.20 mg/mL,具有较好的抗氧化能力。该研究证实砂仁多糖的抗氧化能力强,可作为天然抗氧化剂,值得更深入的研究其抗氧化机制,该研究结果可为砂仁多糖的开发和利用提供理论应用基础。
