高压均质对EGCG-OSA玉米淀粉复合体的结构及其抗氧化特性的影响
2021-12-16黎明明解新安
黎明明,李 璐,解新安,李 雁
(华南农业大学食品学院,广东广州 510642)
表没食子儿茶素没食子酸酯(Epigallocatechin gallate, EGCG)是一种从绿茶中提取的具有极强抗氧化能力和清除自由基能力的茶多酚单体,具有调节糖脂代谢、抗炎、抗肿瘤等功效[1]。但是EGCG的生物利用率却很低,人体摄入茶多酚后,由于其易被氧化分解的特性,只有少量的EGCG能顺利达到小肠从而被人体有效吸收,此外儿茶素间也会发生一定程度的结合,这些因素共同导致了EGCG的低生物利用率[2]。辛烯基琥珀酸酐淀粉(OSA淀粉)同时具有亲水性和疏水性,以及一定的抗氧化性,使其不仅在水环境中能较好地控制生物活性化合物的释放[3],而且能与被运载物很好地有机结合,在有效控释目标物的同时也能发挥自身的抗氧化性。因此,OSA淀粉被广泛应用于各种生物活性化合物的运载体系。
目前对淀粉-多酚复合物的制备多采用高温加热糊化法[4]。Wang等[5]将阿魏酸溶于氢氧化钾溶液并在80 ℃下与玉米淀粉糊混合作用1 h,得到阿魏酸-高直链玉米淀粉复合物,抗氧化性实验结果显示复合物具有一定的抗氧化能力,但此法加热时产生的高温可能导致复合物热降解与酚类化合物氧化[6]。也有学者用较为新颖的方法对EGCG进行包埋,如Patel等[7]将水溶性的纤维素衍生物聚合物以一定浓度滴到 EGCG 溶液中,后经过冷冻干燥制备出运载量25%(w/w)的多酚聚合物玻璃粉末,并具有较强的抗氧化能力。以上这些技术提高了 EGCG 的利用率和使用范围,但EGCG的包埋率仍然较低,且处理方法较为复杂,成本经济消耗比较高[8]。
高压均质技术能在短时间内通过高压剪切力作用于目标物体上,淀粉类物质通过高压均质,能破坏淀粉分子的有序长链结构及其分子平均粒径大小和晶型[9]。Cui等[10]用高压均质法制备了稻米淀粉-脂肪酸复合物,并研究高压均质对其结构变化及与消化率之间的关系。结果表明,经过高压均质制备的淀粉-脂肪酸复合物为具有更高程度的短程有序结构的V型多晶型物,并且结晶度、有序结构度和热稳定性均得到提高。Sentandreu等[11]研究发现,与巴氏杀菌果汁中总类胡萝卜素的生物可及性相比,经过高压均质的样品的生物可及性提高了五倍,表明粒径减小对促进消化酶作用具有积极效果,并且在消化过的样品胶束中检测到环氧类胡萝卜素的含量明显增加,从而得出高压均质能提高果汁中类黄酮的生物可及性的结论。高压均质不仅能从结晶度、粒径等物理结构层面改变样品体系的理化性质,而且有增加体系稳定性与样品生物活性的潜力[12]。将高压均质技术运用到构建淀粉-多酚复合物体系,对增加淀粉对多酚的包埋率及提升多酚的生物活性有重要意义。
综上所述,为了简化操作步骤,节约成本,同时减少高温对于复合体的影响,本文以EGCG与OSA玉米淀粉为原料,通过加热、高压均质以及先均质后加热三种方式制备EGCG-OSA复合体,测定其抗氧化性,表征理化性质,为EGCG在淀粉-多酚复合物制品中的广泛应用提供理论及技术基础。
1 材料与方法
1.1 材料与仪器
OSA玉米淀粉 佛山市南海华昊华丰淀粉有限公司;无水乙醇 天津市富宇精细化工有限公司;DPPH试剂 上海化成工业发展有限公司;ABTS试剂 Bomei公司;EGCG 源叶生物有限公司。
Vertex 70型傅里叶变换红外光谱仪 布鲁克公司;Mastersizer 3000型激光粒度分析仪 Malvern公司;EVO MA 15型扫描式电子显微镜 ZEISS公司;Ulitma型X射线多晶粉末仪 Rigaku公司;MCR502模块化智能型高级流变仪 安东帕公司。
1.2 实验方法
1.2.1 OSA玉米淀粉与EGCG复合体的制备
1.2.1.1 加热糊化法 称取3 g OSA淀粉和0.3 g EGCG(淀粉干基的 10%)均匀分散于150 mL蒸馏水中。后将混合物悬浮液进行95 ℃水浴30 min。冷冻干燥后将样品研磨并过100目筛,置于干燥器保存,待用。记为复合物Ⅰ型。
1.2.1.2 高压均质法 准确称取3 g的OSA淀粉和0.3 g EGCG,加入150 mL蒸馏水,将混合乳液置于高压均质机中。处理参数:常温,压力为100 MPa,处理次数为5次[13]。冷冻干燥后将样品研磨并过100目筛,置于干燥器保存,待用。记为复合物Ⅱ型。
1.2.1.3 先均质后加热法 在高压均质机均质后(条件同上)将样品进行95 ℃水浴30 min。冷冻干燥后将样品研磨并过100目筛,置于干燥器保存,待用。记为复合物Ⅲ型。
1.2.2 红外光谱测定 用天平称取3 mg的样品与100 mg溴化钾粉末,混合均匀后在干燥环境下于玛瑙研钵中研磨至颗粒状,在压片机中进行30 s的压片后装片,选用空白溴化钾片作为空白对照,通过Vertex 70型傅里叶变换红外光谱仪进行测试,波数扫描范围为 450~4000 cm−1[14]。
1.2.3 X射线衍射(X-ray diffraction,XRD)测定 采用铜靶 Cu,扫描范围为 3~45°,步长 0.02°,发散狭缝、防散射狭缝、接受狭缝的设置分别为1.0、1.0、0.3 mm。用Ulitma型X射线多晶粉末仪测量,实验结果用MDI Jade 5.0软件进行分析[15]。
1.2.4 黏度测定 利用MCR502高级旋转流变仪测定复合体及OSA玉米淀粉的黏度。将样品用去离子水溶解并制备成4%淀粉浆后,95 ℃下在水浴中连续搅拌糊化20 min,用移液枪将样品滴在流变仪的平板的凹槽内,用纸刮去多余的样品溶液后进行测量。测定条件:测试温度为25 ℃,初始取点为每秒10次,最终取点为每秒1次,间隙500 mm,剪切速率为 0.1~100 s−1[16]。
1.2.5 分子粒径测定 用Mastersizer 3000型激光粒度分析仪对OSA玉米淀粉与三种复合体进行粒度分布测定,先将样品用去离子水溶解并制备成浓度为5 mg/mL的待测液,后清洗一次仪器并初始化仪器调整其吸光度达到70%以上,将样品用移液枪滴入样品槽,根据激光衍射法,每次进行三次测定并取平均值,经软件自动处理数据分析得出粒径分布[17]。
1.2.6 扫描电子显微镜(scanning electron microscope,SEM)观测 用牙签分别蘸取少量EGCG-OSA 淀粉复合体或OSA淀粉并用双面胶固定在铝垫上,用洗耳球吹去多余粉末,喷金,标号,用EVO MA 15型扫描式电子显微镜进行观测[18]。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除率测定 取4.00 mg DPPH固体粉末,用无水乙醇配制成浓度为0.200 mmol/L的DPPH溶液,备用[19]。取5 mg三种复合体溶于5 mL水中,配制成1 mg/mL浓度的样品溶液,备用。将三种复合体溶液与 DPPH溶液等体积混合并且摇匀,编号,常温下置于避光环境中30 min后,测量其吸光度。之后保持常温下避光保存,每隔10 d取样测定吸光度。将测量数据按下列公式进行计算,得到复合体的DPPH自由基清除率[20]。
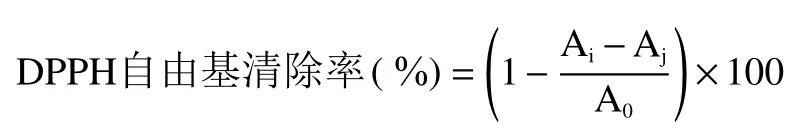
式中,A0为DPPH乙醇溶液在517 nm处的吸光值;Ai为三种复合体溶液与DPPH自由基作用后吸光度值;Aj为三种复合体与无水乙醇混合后的吸光度值。
1.2.7.2 ABTS自由基清除率测定 用天平称取96.0 mg ABTS固体粉末与16.6 mg过硫酸钾固体粉末,用去离子水溶解并定容至25 mL[21];将两种溶液等体积比混合,于室温下避光环境中静置15 h,作为储备液。用去离子水稀释储备液,使其在734 nm波长处的吸光度值为(0.700±0.02)。取5 mg三种复合体溶于5 mL水中,配制成1 mg/mL浓度的样品溶液,备用[22]。用移液枪吸取0.2 mL待测液并滴入装有3.8 mL ABTS工作液的试管中,于避光环境中混合6 min后,在734 nm波长下测量其吸光度。将所得数据按下列公式计算[23]。

式中,A0为ABTS工作液吸光度值;Ai为ABTS自由基与样品溶液反应后的吸光度值;Aj为样品溶液与乙醇混合后的吸光度值。
1.3 数据处理
每组实验至少做3个平行,数据采用SPSS 17.0软件进行统计学处理,用Origin 8.5软件进行绘图,P<0.05为显著差异。
2 结果与分析
2.1 红外光谱分析
由图1可得,和OSA玉米淀粉相比较,三种复合物的制备过程中并没有引入新的化学键和基团,因此吸收峰的位置与种类几乎没有改变。707 cm−1处是淀粉的特征吸收峰,2930 cm−1为C-H特征伸缩振动,3000~3700 cm−1代表不同种类的羟基特征峰,其中3400 cm−1附近是-OH伸缩振动峰[24]。EGCG与OSA淀粉分子内和分子间所产生的氢键会使电子云密度降低,从而伸缩振动频率降低[25],波数为1564、1644、1721 cm−1的三个位置分别表示RCOO-的不对称伸缩振动吸收特征峰、水的弯曲振动特征峰和酯羰基C=O的伸缩振动吸收峰,由图可以看出,与OSA玉米淀粉相比,三种复合体的这三个吸收峰强度均明显降低,说明EGCG中的-OH基与OSA玉米淀粉中的-OH基发生了缔合、叠加,包埋后分子间形成了更多的羟基,产生了更多的氢键[26],从而改变了特征峰峰型。
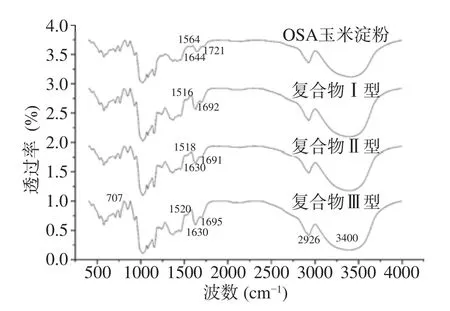
图1 OSA玉米淀粉和三种复合体的FTIR图Fig.1 FTIR chart of OSA corn starch and three EGCG-OSA complexes
2.2 XRD分析
淀粉颗粒包含结晶区域和非晶区域。晶体区域具有相对致密的结构,非晶区主要由直链淀粉分子和直链淀粉的分叉结构形成,而既有结晶区又有非结晶区的结构称为半结晶结构,由含有直链淀粉的无定形区域和以支链淀粉为主要化合物的结晶区域组成,且可以通过广角X射线衍射来确定其相对结晶度[27]。根据衍射峰的位置不同,主要分为A型、B型和C型。
从图2可以看出,OSA玉米淀粉在17°会有特征衍射峰,形成B型结晶[28],而与EGCG通过不同方法复合后,其结晶峰位置并没有发生改变,但衍射峰的形状发生一定改变,且17°的衍射峰强度有所减弱,结晶度减小,这可能是由于在复合时,高温作用与均质剪切力对原OSA玉米淀粉的结晶区产生了一定的破坏。

图2 OSA玉米淀粉与三种复合体的XRD图Fig.2 XRD chart of OSA corn starch and three EGCG-OSA complexes
2.3 三种复合体的流变学特性分析
EGCG-OSA玉米淀粉复合体与OSA玉米淀粉黏度随剪切速率的变化曲线如图3所示。可见其黏度均随着剪切速率的增加而降低,呈现出剪切变稀的特性,为假塑性流体[9]。与EGCG复合后,由于EGCG的羟基与OSA玉米淀粉都具有一定的持水性,以及EGCG与OSA玉米淀粉之间形成的氢键,造成了黏度的降低;除了形成氢键作用外,还有EGCG的疏水基团苯环与OSA玉米淀粉的疏水长链发生疏水相互作用,使得体系的斥力降低,表观上呈现出黏度降低的现象[2]。

图3 OSA玉米淀粉与三种复合体的剪切速率与表观黏度关系曲线Fig.3 Relationship between shear rates and apparent viscosity of OSA corn starch and three complexes
三种复合物粘度相比于OSA淀粉均有所下降,而其中经过高压均质所得复合体的下降幅度比加热法制备的复合体更大,据此推测,经过高压剪切作用后EGCG能与OSA玉米淀粉更好的缔合,产生更多的分子间相互作用。
2.4 三种复合体的粒径分布
由图4可得,与原OSA玉米淀粉相比,采用加热法制备的复合体平均粒径明显增大,这是糊化使淀粉颗粒体积增大并且与EGCG分子结合后的结果。糊化的OSA玉米淀粉通过毛细管作用诱导EGCG分子进入其网状孔结构,之后通过分子间氢键使EGCG被牢牢吸附在OSA玉米淀粉孔中[29];采用高压均质和先高压均质后加热法所制备复合体的平均粒径要明显小于原OSA玉米淀粉,这是由于均质剪切的作用,淀粉颗粒被切割成更小的个体,使得平均粒径明显减小,其中采用先均质后加热糊化制备的复合体粒径呈双峰分布,这是由于经过加热糊化,一部分颗粒由于糊化膨胀与毛细管作用,使其体积增大,因此其平均粒径比仅采用均质法制备的复合体要大。

图4 OSA玉米淀粉与三种复合体的粒径分布Fig.4 Particle size distribution diagram of OSA corn starch and three complexes
由Mastersizer 3000软件分析得出OSA玉米淀粉、复合物Ⅰ型、Ⅱ型、Ⅲ型的平均粒径分别为18.3、27.6、5.4、8.5 μm,与图4 中的结果一致。
2.5 三种复合体的微观形貌
图5 A是OSA玉米淀粉的SEM图,可看出OSA玉米淀粉为较规则的椭圆形或圆形颗粒,其球面结构表面有凹陷,分为多个褶皱曲面,每个褶皱面中间都有明显的棱状线条性结构。图5B和5C分别为经过高压均质与加热制备的复合体微观形貌,可以看出,经过高压均质的复合体被切割成大小不一形状不规则的颗粒;而经过加热的复合体变得破裂、扭曲、表面粗糙且互相粘连,表明加热处理使淀粉内部发生糊化,结晶结构遭到破坏[30]。三种复合体经过研磨后颗粒形态均被破坏,有部分片状EGCG颗粒粘附在受损的淀粉颗粒表面,表面有深浅不一的凹陷、空隙和裂缝等特征,颗粒在形态上的变化可能是由于受到研磨中的摩擦力和冲击作用的影响,其中经过先高压均质后加热的复合体(图5D)表面有圆形孔状结构,可能是高压剪力与高温互相作用的结果[31]。

图5 OSA玉米淀粉和三种复合体的扫描电镜图Fig.5 SEM images of OSA corn starch and three EGCG-OSA complexes
2.6 抗氧化性测定
2.6.1 DPPH自由基清除率 从图6可以看出,在储藏30 d后,未经包埋的EGCG自由基清除率从97.56%下降到41.35%,这是由于未经过包埋的EGCG暴露在氧气与光中,因其易氧化的特性,很快失去了大量的活泼氢,使其DPPH自由基的清除能力也在短时间内急剧下降。而用加热法制备的复合体自由基清除率从92.8%下降到88.36%,用高压均质制备的复合体自由基清除率从93.45%下降到88.75%,而用先高压均质后加热法制备的复合体自由基清除率从93.47%下降到89.63%。说明OSA玉米淀粉与EGCG复合之后,EGCG被包埋于改性淀粉内部的多孔网状封闭环境中,减小了与外界的氧气、光的接触,有效地减缓了其被氧化的速率[32],另一小部分未被包埋的EGCG位于复合体的表面,易于被氧化,造成了抗氧化性的下降[33]。
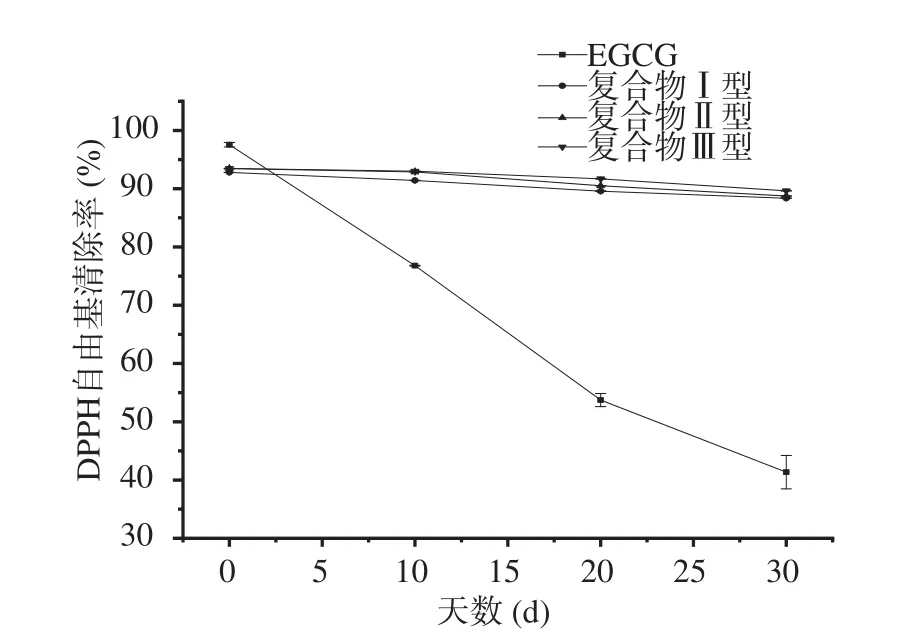
图6 EGCG与各复合体的DPPH自由基清除率随贮藏时间的变化Fig.6 Scavenging rate of DPPH free radicals of EGCG and each complex varies with time
从实验结果可以看出,用先高压均质后加热与高压均质制备得出的复合体的DPPH自由基清除率均高于加热制备的复合体,可推测高压剪切力有助于复合体形成网状结构,具备更高的包裹性,使更多的EGCG分子被OSA玉米淀粉包埋,进入其网状结构。
2.6.2 ABTS自由基清除率 由图7可以看出,在常温下储藏30 d后,未经包埋的EGCG因暴露而使其ABTS自由基清除率呈现出急剧下降的趋势,由99.50%下降到60.72%。而三种复合体的ABTS自由基清除率在储存期内均没有明显变化,表明复合包埋对EGCG活性有良好的保护作用。另外,用高压均质与先高压均质后加热制备的复合体的清除率均稍高于加热法的复合体,其中用先均质后加热制备的复合体拥有最高的ABTS自由基清除率(99.20%),其下降的幅度也最小(30 d后仍达到98.66%),这与DPPH自由基清除率实验结果一致,因此,用先高压均质后加热糊化制备的复合体不仅有较高的抗氧化能力,并且其对EGCG的保护性也最强。
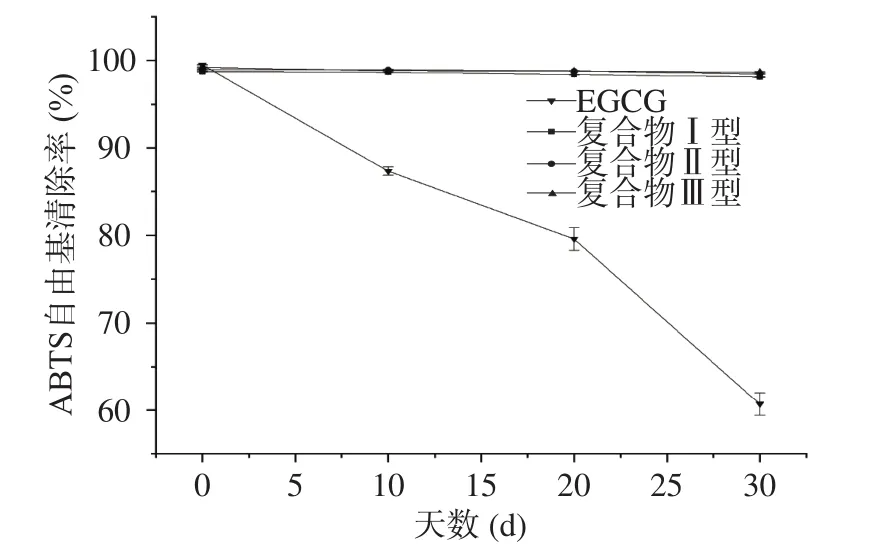
图7 各复合体的ABTS自由基清除率随贮藏时间的变化Fig.7 ABTS free radical scavenging rate of each complex varies with days
3 结论
以OSA玉米淀粉与EGCG为原料,采用加热、高压均质以及先高压均质后加热的方法制备了三种淀粉-多酚复合体,以探究高压均质对EGCG-OSA淀粉复合体的影响。
对三种复合体的抗氧化性研究发现,三种复合体均有较高的抗氧化性,对EGCG起到了很好的保护作用。经过高压均质制备的复合体相较于加热法制备的复合体有更高的抗氧化性,自由基清除率下降的幅度也较小,其中先高压均质后加热制备的复合体在30 d后DPPH清除率达到89.63%,ABTS自由基清除率达到98.66%,在复合体中最高。
傅里叶红外光谱与X射线衍射的结果表明,EGCG与OSA玉米淀粉通过分子间的氢键发生了一定程度的缔合,没有新化学键与官能团的产生。而流变性研究表明经过高压均质的复合体黏度下降的幅度更大,并且分子粒径有所减小。
据此推测,EGCG与OSA淀粉主要通过分子间氢键与疏水作用相缔合,而与加热作用相比,高压均质作用能使EGCG与OSA玉米淀粉形成更稳定的复合体,产生更多的氢键与疏水作用,综合来说,通过先高压均质后加热制备的复合体有最高的抗氧化性以及储藏稳定性,其综合效果最好。本研究为EGCG在淀粉类食品的加工及生产中的应用提供了理论及实验基础。
