蛙皮肤来源抗菌肽Brevinin-2GHk的抗菌作用机制
2021-12-16熊唯琛柴金为吴洁娜田茂林卢万成徐学清
熊唯琛,柴金为,吴洁娜,田茂林,卢万成,徐学清
南方医科大学药学院,广东 广州 510515
致病菌的耐药性已经对人类的健康产生了严重的威胁,因此发现一类不容易产生抗性的新型抗生素至关重要,抗菌肽(AMPs)则是最有希望的候选者之一[1,2]。从细菌到哺乳动物产生的各种天然AMPs是宿主防御的先天免疫系统的重要组成部分,这些通常由少于100个氨基酸组成的AMPs已显示出对革兰氏阳性菌、革兰氏阴性菌、病毒和真菌等具有杀灭能力[3,4]。两栖动物的皮肤是AMPs的重要来源,迄今已从两栖动物皮肤中分离并鉴定出约100种抗菌肽家族[5]。Brevinins家族是最为常见的AMPs之一,具有线性、两亲性和阳离子等特性,这些特性使得多肽可以与带负电荷的细菌细胞膜相互作用,导致膜功能障碍,最终抑制细菌生长或使其死亡[6]。然而,由于AMPs的靶标位于细胞膜上,它们有时也会攻击宿主细胞,这也是其观察到细胞毒性和溶血活性的主要原因[7]。如从Hylarana guentheri中鉴定的brevinin-1GHa和从Amolops hainanensis中分离得到的brevinin-1H具有强大的广谱抗菌活性,但同时也具有较强的溶血作用[8,9]。因此从brevinins家族中发现具有抗菌活性且细胞毒性较低的AMPs对临床应用具有重要意义。
泽陆蛙是一种分布广泛的两栖动物,但目前仅从中发现了一种凝集素样多肽Fejerlecin,因此还有更多具有生物活性的多肽有待发掘[10]。本研究构建了泽陆蛙皮肤cDNA文库,发现其中包含两栖动物brevinins家族的brevinin-2子家族抗菌肽Brevinin-2GHk(BR2GΚ)。BR2GΚ 的截短肽被报道具有有效的抗菌活性,但BR2GΚ的活性和作用机制尚未明确[11]。本研究测试发现BR2GΚ具有较强的体外抗菌活性,且无溶血作用。此外还对其作用机制进行了研究,为进一步设计合成具有更强抗菌活性和更低细胞毒性的抗菌肽提供了指导。
1 材料和方法
1.1 抗菌肽与菌株
泽陆蛙皮肤cDNA文库由本实验室构建与保存;抗菌肽BR2GΚ由上海吉尔生化有限公司合成,经高效液相色谱(HPLC)纯化,纯度≥95%,相对分子质量由快原子轰击质谱法确定。大肠杆菌(Escherichia coli,E.coli,ATCC 25922)、金黄色葡萄球菌(Staphylococcus aureus,S.aureus,ATCC 25923)、痤疮丙酸杆菌(Propionibacterium acnes,P.acnes,ATCC 6919)、枯草芽孢杆菌(Bacillus subtilis,B.subtilis,CMCC 63501)和白色念珠菌(Candida albicans,C.albicans,ATCC 10231)由本实验室保存。
1.2 主要试剂
戊二醛,多聚甲醛,脂多糖(LPS,Sigma),SDS、NaCl(Macklin),细胞活性测定试剂盒(Thermo Fisher Scientific),总抗氧化能力检测试剂盒(ABTS和FRAP法)、一氧化氮检测试剂盒(Beyotime)。
1.3 圆二色谱测定
Jasco-810圆二色谱仪用于分析BR2GΚ在溶剂环境中的二级结构和稳定性。将BR2GΚ分别经下述条件处理:用不同浓度的SDS溶液(0、30、60、90、120 mmol/L)或60 mmol/L的SDS溶液和不同浓度的NaCl(0、100、200、400 mmol/L)分别溶解多肽,然后测定CD光谱;用60 mmol/L SDS溶解BR2GΚ,然后在不同温度(25、37、50、70、90 ℃)下孵育1 h,然后测定CD光谱。上述多肽的终浓度均为100 μmol/L,每个样品连续扫描3次取均值,并减去溶剂信号。CD数据用平均残留椭圆度(θ)表示,单位为deg·cm2·dmol-1。
1.4 BR2GΚ抗菌活性测定
如前所述,采用二倍稀释法测定最低抑菌浓度(MIC)和最低杀菌浓度(MBC)[12]。96孔板中加入50 μL系列稀释的多肽,并加入等体积的浓度为106CFU/mL的细菌。37 ℃培养12 h后,使用酶标仪测定600 nm处吸光度A600nm以确定多肽的MIC。分别取培养后96孔板中培养液10 μL涂布在营养琼脂平板上,37 ℃培养24 h,无菌落生长浓度为MBC。
1.5 膜渗透性和形态变化分析
通过共聚焦激光扫描显微镜(LSCM)和扫描电子显微镜(SEM)探索BR2GΚ对几种细菌可能的作用机制。将大肠杆菌和金黄色葡萄球菌与终浓度为4×MIC的多肽在37 ℃下孵育30 min。将细胞活性测定试剂盒中的SYTO9和碘化丙啶(PI)添加到处理过的细胞中,并在室温下避光保存30 min。使用共聚焦激光扫描显微镜(Leica TCS SP5;Leica Microsystems)对染色的细胞进行观察。具有完整膜的活细菌被SYTO9染色,并发出绿色荧光,而膜受损的死细菌被PI染色,发出红色荧光。将大肠杆菌和金黄色葡萄球菌与终浓度为4×MIC的BR2GΚ在37 ℃下孵育30 min,1000 r/min离心10 min,弃上清,细菌沉淀用6%戊二醛固定4 h,乙醇梯度脱水并真空干燥过夜,镀金后通过S-4800扫描电子显微镜(Hitachi)对样品进行分析。
1.6 BR2GΚ对红细胞作用的测定
使用2%的小鼠红细胞和U型96孔板测定BR2GΚ对红细胞的作用。二倍稀释的BR2GΚ(0.3125~40μmol/L)与2%的红细胞悬液在室温下孵育2 h后进行观察。PBS、刀豆蛋白A(ConA)和Triton X-100分别作为空白、凝集和溶血对照。
1.7 等温滴定量热(ITC)实验
BR2GΚ 和LPS 溶解在pH 7.2 的50 mmol/L PBS中,真空脱气。滴定针中的BR2GΚ(1 mmol/L)在25 ℃下分37次注射到样品池中的LPS(50 μmol/L)溶液中,滴定1 μL/次,每次注射持续时间为2 s,中间间隔90 s,搅拌速度为1000 r/min,选择高反馈模式。使用MicroCal PEAQ-ITCAnalysis软件对数据进行分析。
1.8 表面等离子共振成像(SPRi)分析
将BR2GΚ(2 mmol/L)点样到gold SPRi芯片表面,4 ℃孵育过夜,然后用5%脱脂牛奶封闭过夜。使用不同浓度的LPS(25、50、100 μmol/L)流经芯片表面。每次结合解离过程结束后,使用重生液冲洗芯片表面。所得数据在Plexera SPRi系统上通过SPR Ⅴ3软件进行实时监测分析与实时监控。
1.9 BR2GΚ体外抗氧化活性测定
参照文献方法检测BR2GΚ 的总抗氧化能力(FRAP 法)、NO 清除能力、DPPH 自由基清除能力和ABTS自由基清除能力,按照试剂盒说明书的操作步骤进行测定。
1.10 统计学分析
采用SPSS软件进行统计分析,定量资料以均数±标准差表示,组间比较采用One-way ANOⅤA分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 抗菌肽BR2GΚ的合成
BR2GΚ的成熟肽序列为含33个氨基酸的短肽,并包含一个由两个半胱氨酸构成的二硫键(图1A)。理论等电点和相对分子质量分别为9.79和3.39 kDa。多肽经HPLC纯化,质谱法确定(图1B,C),并用于后续实验。
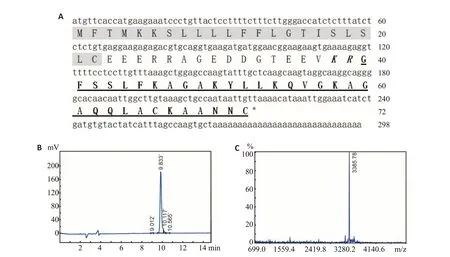
图1 BR2GΚ的鉴定和表征Fig.1 Identification and characterization of BR2GK.A:cDNA and deduced amino acid sequence of BR2GK.The signal peptide is shaded in gray and followed by an acidic spacer domain with KR residues at the end(in red bold).The stop codon is indicated with an asterisk(*),and the sequence of mature fejerlectin is boxed.B:Purity of synthesized BR2GK detected by HPLC.C:Relative molecular mass of synthesized BR2GK confirmed by mass spectrometry.
2.2 圆二色谱分析
为确定不同溶液环境对BR2GΚ结构的影响,测定BR2GΚ 在不同溶液中的圆二色谱。溶解在水中BR2GΚ的圆二色谱在200 nm处有一个负峰(图2A),显示BR2GΚ在水中呈现无规则螺旋构象。而溶解在模拟细胞膜环境的SDS溶液中的BR2GΚ的圆二色谱在195 nm处有明显的正峰,并在208和222 nm处有双负峰,显示此时多肽的二级结构主要是α-螺旋,且在60~120 mmol/L的浓度范围内,随着SDS浓度的增加,图谱变化较小。同样,在60 mmol/L SDS 中,即使还存在400 mmol/L NaCl,BR2GΚ 的主要α-螺旋结构仍然保留。然而在不同温度处理下,BR2GΚ的圆二色谱显示出了较大的差异(图2)。
2.3 抗菌活性测定
通过测定MIC和MBC研究BR2GΚ的抗菌作用,结果显示,BR2GΚ对所测试的革兰氏阴性菌、革兰氏阳性菌和真菌均表现出有效的抗菌活性,其中,BR2GΚ对金黄色葡萄球菌的抑制作用最强,MIC为2.76 μmol/L(表1)。

表1 BR2GΚ的抗菌活性Tab.1 Antimicrobial activities of BR2GK
2.4 BR2GΚ对细胞膜的影响
通过LSCM和SEM观察BR2GΚ对细菌细胞膜完整性的影响,结果显示,完整的大肠杆菌和金黄色葡萄球菌被SYTO9染成绿色,受损的细胞则被PI染成红色,与未经处理的对照组相比,BR2GΚ处理90 min后,红色细菌数量明显增加(图3A)。与SYTO9和PI染色实验结果相一致,SEM观察显示,BR2GΚ处理后的细菌与未经处理的对照组形态具有显著区别。对照组大肠杆菌和金黄色葡萄球菌显示出正常的形态和光滑的表面,在给药组中则观察到明显的细菌肿涨、收缩和变形,并观察到从膜中渗出大量内容物(图3B)。对红细胞作用的测定显示BR2GΚ对红细胞具有一定的凝集活性而不会导致溶血(图3C)。

图3 BR2GΚ对细胞膜的影响Fig.3 Effect of BR2GK on cell membrane of E.coli and S.aureus.A:Confocal laser scanning microscopy of E.coli and S.aureus.B:Scanning electron microscopy of E.coli and S.aureus.C:Effect of BR2GK on erythrocyte membrane.The first row shows the effect of BR2GK on erythrocyte membrane at concentrations between 40 and 0.3125 μmol/L.The third row shows the hemagglutination activity of the control drug ConA at concentrations between 125 and 0.9766 μg/mL.The fourth row shows the hemolytic activity of Triton X-100 at concentrations between 1‰-0.0078‰.
2.5 BR2GΚ的结构预测
使用I-TASSER 服务器预测了BR2GΚ 的结构(图4A),该模型显示BR2GΚ 具有高度螺旋结构,与圆二色谱的结果相一致。通过TM-align 模块识别,BR2GΚ 的结构与PBD 数据库中的三聚体TolC 蛋白(PBD ID:1TQQ)中的一段序列具有较高的相似度(图4B)。
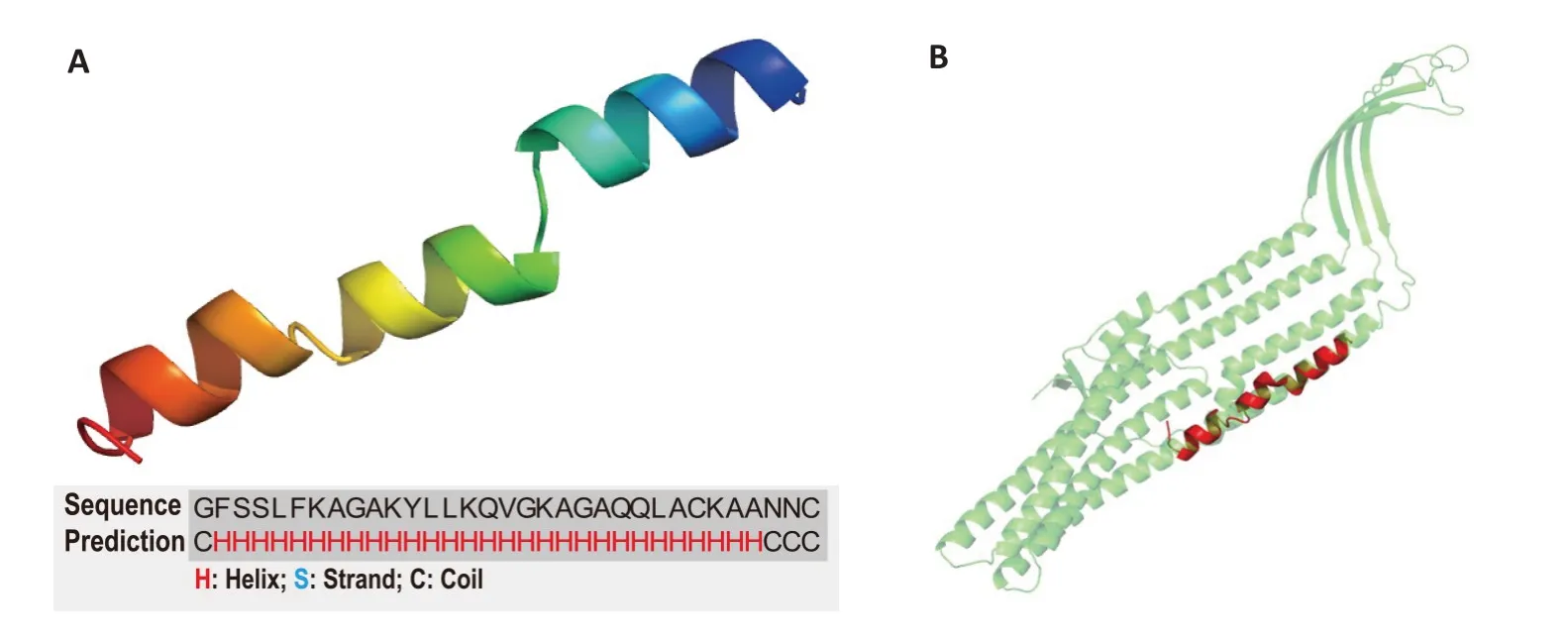
图4 BR2GΚ的结构Fig.4 Secondary structure of BR2GK.A:3D structure prediction of BR2GK using I-TASSER program.B:Similar structure of BR2GK(red)to TolC(green).
2.6 BR2GΚ与LPS结合
使用ITC检测BR2GΚ与LPS的结合亲和力和热力学参数,结果显示,开始滴定时,显示出了较大的信号,随着滴定的进行,信号有明显减小的趋势,并最终趋于平稳,且始终为负值(图5A),另外BR2GΚ和LPS相互作用过程的ΔG<0。通过平衡解离常数测定的结合亲和力ΚD为18.2±0.8 μmol/L,显示两者具有较强的相互所用。与之相一致,SPRi的结果进一步证明了BR2GΚ和LPS的结合反应(图5B)。
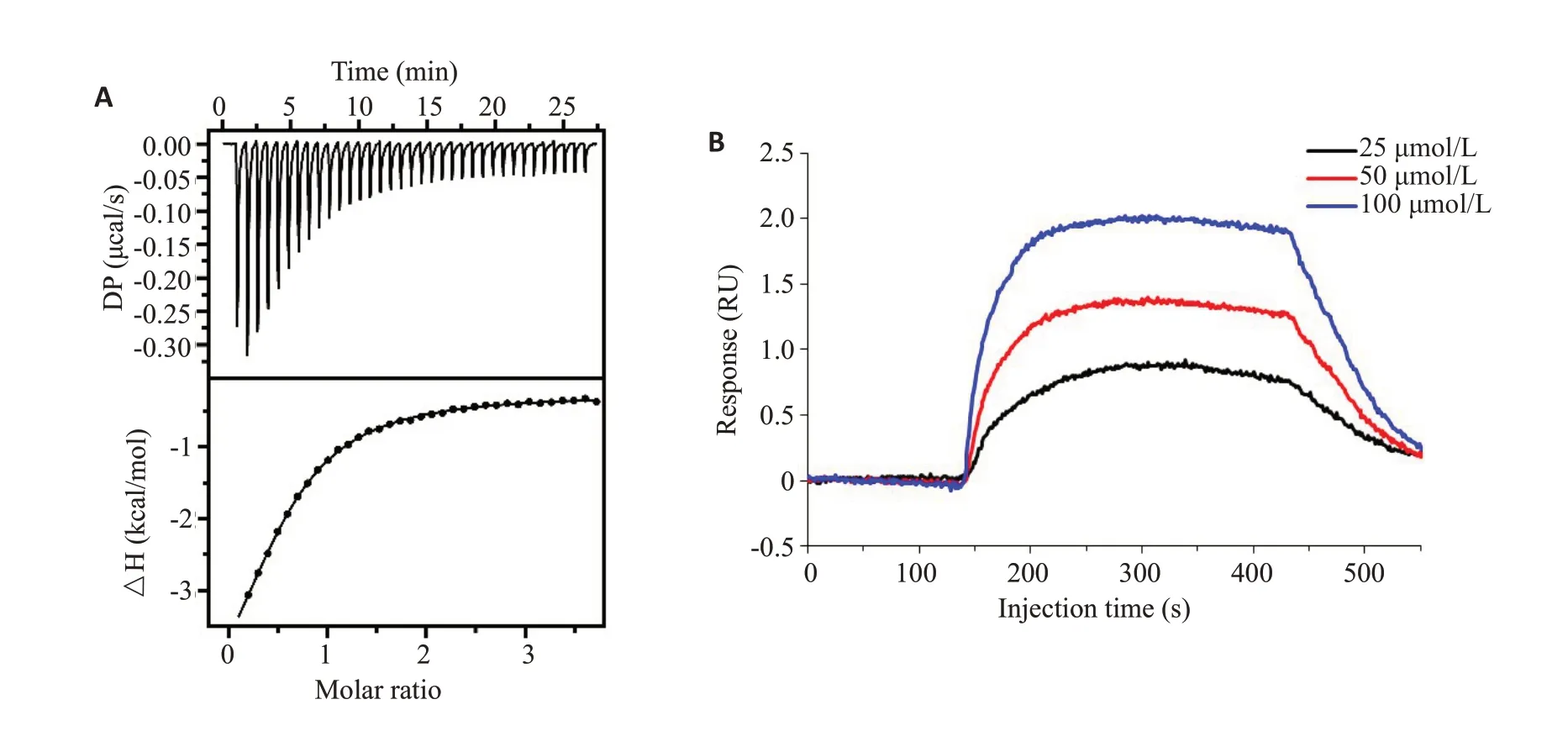
图5 BR2GΚ和LPS的结合Fig.5 Binding of BR2GK to LPS.A:ITC analysis of binding of BR2GK to LPS in 10 mmo/L PBS at 25 ℃.The upper panel displays thermal changes of each injection as a function of time.The lower panel displays a plot of enthalpy change per injection as a function of ligand/target molar ratio.B:SPRi analysis of direct binding of LPS to immobilized BR2GK.
2.7 BR2GΚ的体外抗氧化活性
使用FRAP 法测定总抗氧化活性结果显示,BR2GΚ以浓度依赖的方式表现出有效的抗氧化活性(P<0.01,图6A)。测定BR2GΚ对NO的清除能力结果显示,BR2GΚ同样以浓度依赖的方式清除NO(P<0.01,图6B)。BR2GΚ对ABTS和DPPH自由基清除的反应快速,当浓度为40 μmol/L 时,在1 min 内分别清除了73.51%的ABTS和90.32%的DPPH(图6C,D)。
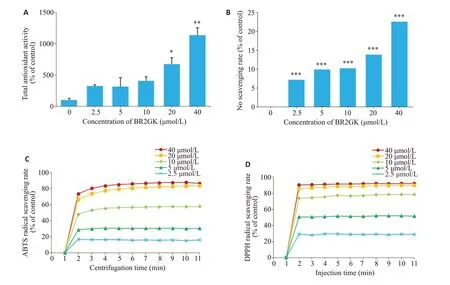
图6 BR2GΚ的抗氧化活性Fig.6 Antioxidant activities of BR2GK.A:Total antioxidant capacity of BR2GK assessed using the FRAP method.B:Effect of BR2GK on NO scavenging.C:ABTS radical scavenging activity of BR2GK.D:DPPH radical scavenging activity of BR2GK.*P<0.05,**P<0.01,***P<0.001 vs control group.
3 讨论
本研究从泽陆蛙皮肤cDNA文库中发现并合成了brevinin-2家族抗菌肽BR2GΚ。阳离子抗菌肽通常通过静电相互作用吸附到细菌细胞膜表面,随后在细胞膜环境中形成稳定的α-螺旋结构,该结构是抗菌肽发挥作用的关键。BR2GΚ带5个正电荷,且圆二色谱结果表明其在SDS溶液环境中能形成稳定的α-螺旋结构,符合抗菌肽的特征。抗菌实验结果也证实BR2GΚ具有广谱的抗菌活性。
进一步的作用机制研究表明BR2GΚ能够破坏细菌细胞膜的稳定性和完整性,这可能导致细胞内的离子和营养物质外渗或抗菌肽进入细胞质中进一步发挥作用,最终导致菌体裂解死亡[15,16]。在通过I-TASSER服务器预测BR2GΚ的结构时,TM-align模块显示BR2GΚ与TolC的一段位于脂质双分子层中的序列具有较高的相似度,TolC是位于大肠杆菌脂质双分子层的长孔状三聚体蛋白,为细胞内物质的流入和流出提供通道[17]。这也印证了BR2GΚ可能像TolC一样插入细菌细胞膜中从而使其裂解。靶向细胞膜的多肽普遍具有细胞毒性和溶血活性等副作用,大量的研究尝试了在保留多肽活性的同时尽可能的消除其毒副作用,如对多肽的氨基酸进行突变或截短、采用机器学习的方法对多肽进行从头设计或在多肽中引入金属离子等[18-20]。然而本研究测试结果显示BR2GΚ不会导致溶血,说明其毒性较小,这表明与其他天然来源的多肽相比,BR2GΚ在抗菌活性和毒性之间有着更好的平衡。
脂多糖又称为内毒素,是革兰氏阴性菌外膜的主要成分,被认为是革兰氏阴性菌感染导致内毒素休克发病机制中的关键分子[21-23]。这种内毒素在细胞分裂和死亡期间从细菌中释放,还会导致脓毒血症[24]。本研究ITC和SPRi的结果显示BR2GΚ与LPS有较强的相互作用,这表明该肽在具有抗菌活性的同时,还能够有效的结合并中和LPS,防止细菌感染导致的内毒素休克和脓毒血症。最后BR2GΚ还具有有效且迅速的抗氧化活性,这可能和两栖动物皮肤分泌的多肽还需要抵御紫外线辐射等外部有害因素有关[25]。
综上所述,本研究发现蛙皮肤来源的多肽BR2GΚ具有广谱的抗菌活性,并通过与细菌细胞膜结合,改变细胞膜的通透性和直接破坏细胞发挥抗菌活性,并不会导致溶血,此外BR2GΚ还能结合LPS,并具有有效且迅速的抗氧化活性。本研究结果对于阐明BR2GΚ的抗菌机制和以此为模板设计合成具有更强抗菌活性和更低细胞毒性的抗菌肽具有重要的指导意义。
