基于线粒体COI基因分析广州市15个白纹伊蚊种群的遗传多样性
2021-12-15郑梓豪吴珊珊钟代斌郑学礼
郑梓豪,吴珊珊,魏 勇,钟代斌,郑学礼
白纹伊蚊(Aedesalbopictus)是登革病毒、寨卡病毒的主要传播媒介[1]。广州市的首个登革热病例报告于1978年,之后广州市登革热疫情就不断出现,在2014年出现了有记录以来最严重的登革热疫情的暴发[2]。而目前针对登革热流行的预防方法主要是对携带登革病毒的白纹伊蚊通过使用化学杀虫剂进行消杀[3-5]。细胞色素c氧化酶亚基Ⅰ(COI)基因在线粒体内,其为母系遗传且遗传进化速率较核DNA快,比核DNA更易受遗传漂变的影响,利用线粒体DNA多态性分析不仅可以在一定层面上了解种群的遗传多样性,还可以探讨形成特定遗传结构的历史原因和地理原因,使其成为研究分子进化遗传常用分子标记物,并能运用于建立物种鉴定的DNA条形码系统的研究,目前已被广泛应用于昆虫的系统进化和种内遗传分化的分析[6-9]。蔡燕丽等利用COI基因及SSCP技术分析了广州市13个区域的白纹伊蚊遗传多态性[10]。郭玉燕等利用COI基因分析了我国部分地区的白纹伊蚊遗传多态性[11]。张瑞玲等报告了不同地理种群白纹伊蚊线粒体基因COI的遗传多样性分析[12]。游丽斌等报告福建省白纹伊蚊 mtDNA-COI基因的系统发育分析[13]。我们在上述文献报道的基础上,开展本项研究,分析白纹伊蚊的系统进化和种内遗传分化,是这项研究的新颖之处。
本文通过采用更大的样本量来分析广州市不同白纹伊蚊种群的线粒体的细胞色素c氧化酶亚基Ⅰ基因(COI)片段的遗传结构,从白纹伊蚊的COI基因多样性,为昆虫的系统进化和种内遗传分化”的理论的提升方面,提供科学参考资料。
1 方 法
1.1 白纹伊蚊的采样 本实验只采集白纹伊蚊样本,采集时间为2020年9月至2020年11月,采样点选取是基于广州市的行政区,行政街道的划分,白纹伊蚊的孳生习性,栖息习性见图1。成蚊采用人诱法,幼虫采用幼虫吸管法,并将幼虫带回实验室饲养至成蚊。形态学鉴定方法参考陆宝麟和吴永厚编著的《中国重要医学昆虫分类与鉴别》[14]。经鉴定为白纹伊蚊的成蚊,在-20 ℃冻死后浸泡在无水乙醇中-80 ℃保存。

图1 广州市白纹伊蚊种群采样地点分布图Fig.1 Distribution of sampling sites of Ae. albopictus population in Guangzhou
1.2 基因组DNA的提取 采用DNA提取试剂盒(Omega,Insect DNA kit)提取单只成蚊的基因组DNA,-80 ℃备用。
1.3 白纹伊蚊线粒体COI基因片段的扩增和测序 扩增COI基因片段的引物参考Folmer[15]等人使用的通用引物,正向引物(5′-GGTCAACAAATCATAAAGATATTGG-3′),反向引物(5′-TGATTTTTTGGTCACCCTG AAGTTTA-3′)。PCR反应扩增体系为25 μL,其中Premix Taq(Takara公司)12.5 μL,正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,模板DNA 2 μL,灭菌ddH2O 8.5 μL。PCR反应条件:94 ℃ 1 min;94 ℃ 40 s,45 ℃ 40 s,72 ℃ 1 min,5个循环;94 ℃ 40 s,53 ℃ 40 s,72 ℃ 1 min,30个循环。72 ℃ 7 min。4 ℃保存。用0.5%TBE电泳缓冲液,取PCR产物3~5 μL, 1.2%琼脂糖凝胶(含有0.5 μg/mL溴化乙锭染料)中电泳,150 V电压30 min后,紫外灯下观察是否有目的条带。出现目标条带的样本送北京擎科新业生物技术有限公司用反向引物测序。
1.4 线粒体COI基因片段分析 将序列在NCBI上的GenBank经过BLAST比对,与白纹伊蚊线粒体COI基因(KX266719.1)匹配度在99%以上的确认为白纹伊蚊(分子生物学鉴定)。用BioEdit 7.2.软件观察序列峰图,用MEGA X[16]基于MUSCLE算法比对序列,使目标序列等长并截去两端测序不准确部分,并统计序列的碱基组成。线粒体COI基因片段的位点多态性和DNA多态性分析,错配分布分析使用DNAsp 6.12[17]软件进行操作。分子变异分析,各种群间的固定系数(Fst)和基因流(Nm)的计算,Mantel检验,中性检验使用Arlequin 3.5软件[18]。系统发育信号检测使用DAMBE 7.2[19]软件进行操作。如果序列未饱和,说明适合系统发育分析,则使用MEGA X软件构建系统发育树,统计方法采用邻接法(Neighbor-Joining)[20],Bootstrap值设置为1 000,替换模型使用Kimura 2-parameter双参数法[21],空位处理使用成对删除(Pairwise deletion),其余选项默认。构建系统发育树时从GenBank中获得了一株埃及伊蚊的序列(外群)和多个不同地理株的白纹伊蚊序列,序列号分别是:NC_035159.1(埃及伊蚊)、KF406541.1(巴基斯坦)、AB738203.1(日本)、MF148287.1(马来西亚1)、MF148279.1(马来西亚2)、JQ235749.1(云南)、KP843400.1(泰国)、GQ143719.1(澳大利亚)。单倍型网络图使用PopART[22]绘制,适用于分析种内数据的Median joining network[23]方法。
2 结 果
2.1 蚊虫样本采集结果 经过了形态学鉴定和分子生物学鉴定,并删去部分峰图质量不佳的样本序列后,最终确定了642只白纹伊蚊用于本次实验。采样地点见图1和表1。白云区包括南方医科大学(SMU)和松南阁(SNG)两个白纹伊蚊种群,海珠区包括南洲花苑(NZHY)和素社(SS)两个白纹伊蚊种群,荔湾区包括东漖(DJ)、广州医科大学附属第三医院(GY)、鹤翔(HX)3个白纹伊蚊种群,天河区(天河山庄,TH)、越秀区(盘福社区,YX)、从化区(从化区第七中学,CH)、番禺区(小平村,PY)、花都区(东镜村,HD)、黄埔区(新田村,HP)、南沙区(潭洲公园,NS)、增城区(南岗村,ZC)各只有1个白纹伊蚊种群。
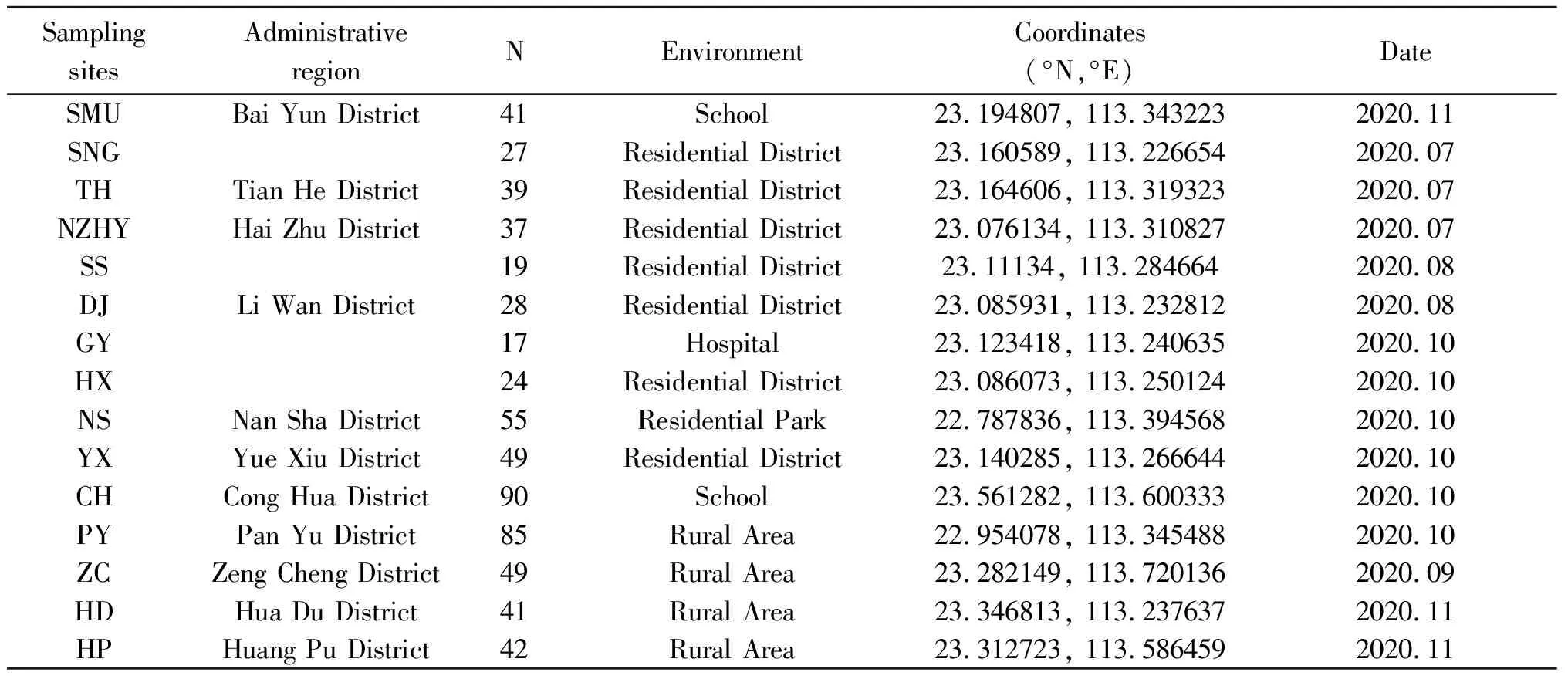
表1 广州市15个白纹伊蚊种群采样点详细信息Tab.1 Information about sampling sites among 15 Ae. albopictus populations in Guangzhou
2.2 线粒体COI基因碱基组成分析 广州市15个种群一共642条核苷酸序列,长度603 bp。A、T、C、G四种碱基组成统计结果显示(表2):第1位和第2位碱基A加T的比例比G加C的比例稍高,第3位碱基的A和T的含量远比G和C的高,A加T的总含量比例更是高达89.6%。4种碱基的平均含量分别为A(28.7%)、T(38.8%)、C(16.9%)、G(15.6%),A碱基和T碱基的平均含量是67.5%,G碱基和C碱基的平均含量是32.5%,表明存在AT偏向性,符合线粒体DNA的特性。根据AT偏斜值公式:(A-T)/(A+T)和GC偏斜值公式:(G-C)/(G+C),得出广州市白纹伊蚊种群的AT偏斜值为:-0.150,GC偏斜值为-0.04。对所有序列基于K2P计算种内距离,发现其范围在0~0.67%,平均为:0.12%。不同采样点之间的白纹伊蚊种群的种内距离范围在0.05%(HX、PY)~0.16%(NZHY、ZC)。
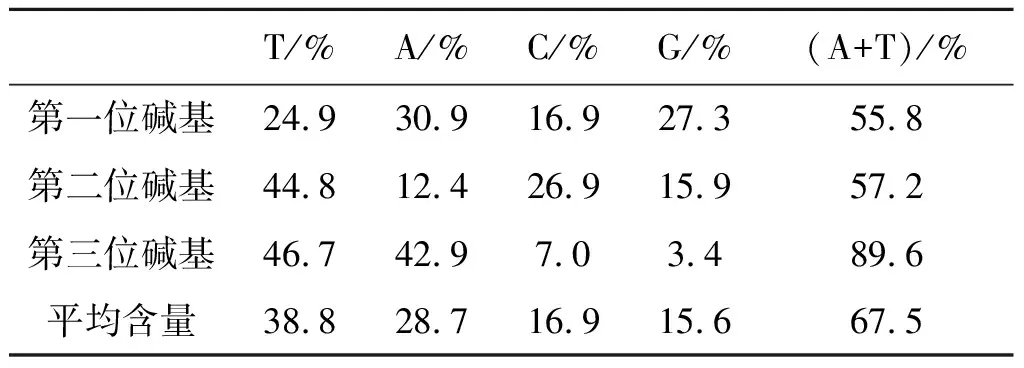
表2 广州市15个白纹伊蚊种群线粒体COI基因核苷酸组成Tab.2 Nucleotide composition of mitochondrial COI gene in 15 Ae. albopictus populations in Guangzhou
2.3 线粒体COI基因序列特征 位点多态性分析结果显示:603个位点中保守位点有564个,变异位点有39个(共有40种突变类型),单态位点有15个,简约信息位点有24个,无插入和缺失,37处出现转换,3处出现颠换,转换/颠换比为7.9,转换远比颠换多。
DNA多样性指数(表3)分别为:广州市整体的白纹伊蚊种群的单倍型多样性(Haplotype diversity,Hd)是0.499,核苷酸多样性(Nucleotide diversity,Pi)是0.001 08,平均核苷酸差异数(Average number of nucleotide difference,k)是0.653。各白纹伊蚊种群单倍型分析如下:单倍型多样性在0.236(HX)~0.725(DJ),核苷酸多样性在0.000 40(HX)~0.001 54(DJ)。平均核苷酸差异数在0.243(HX)~0.931(DJ)。DNA多态性分析结果(表4)显示:642条序列共检出单倍型有45个。其中特有单倍型有33个,共享单倍型有12个,共享单倍型占所有单倍型的26.7%。种群中包含10个个体以上的单倍型有5种,分别是Hap-1(450)、Hap-3(20)、Hap-4(57)、Hap-10(16)、Hap-15(13),其中Hap-1为所有种群共享,Hap-3、Hap-4为部分种群共享。
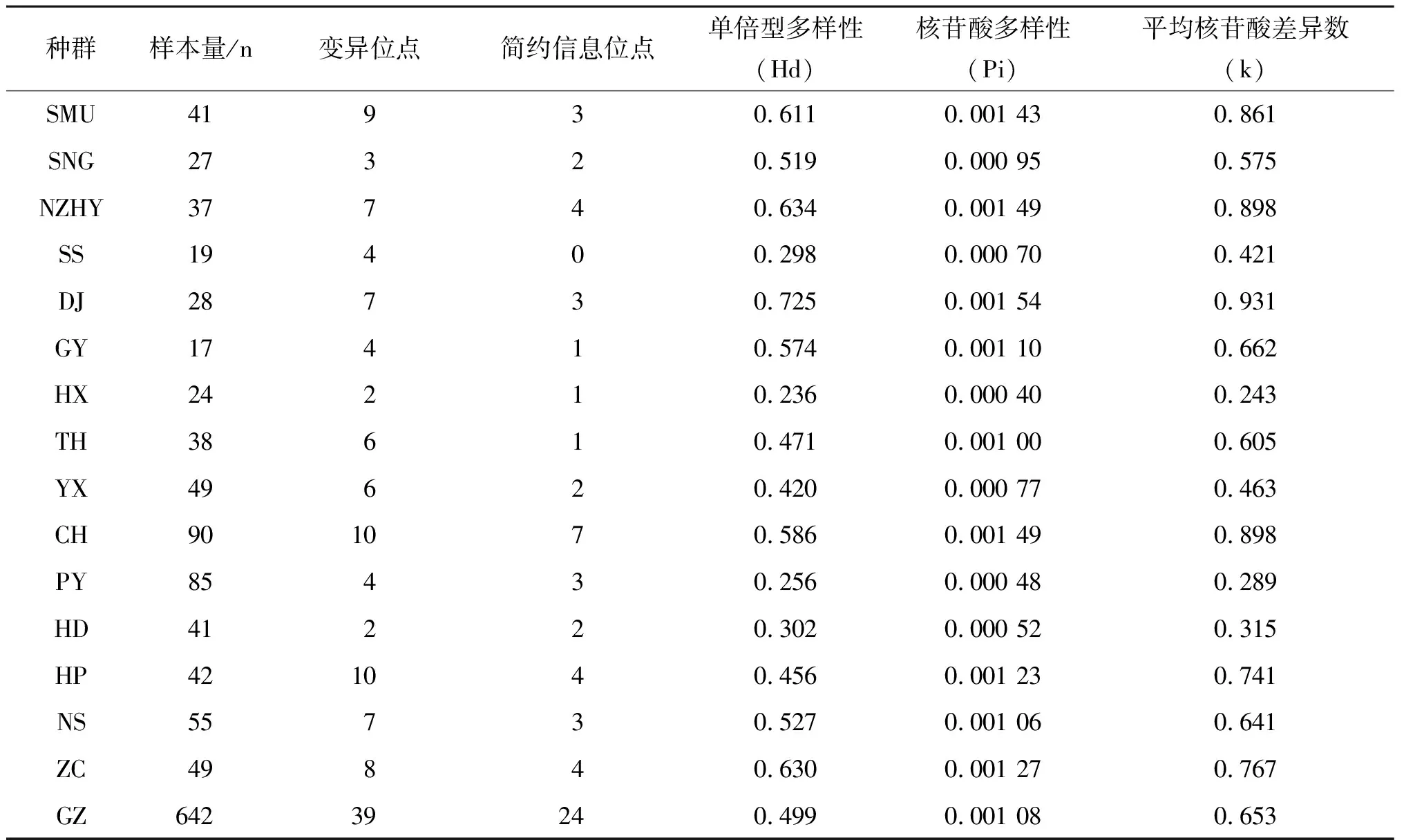
表3 广州市15个白纹伊蚊种群线粒体COI基因遗传多样性Tab.3 Genetic diversity of mitochondrial COI gene of 15 Ae. albopictus populations in Guangzhou

表4 广州市15个白纹伊蚊种群线粒体COI基因单倍型分布及频率Tab.4 Distribution and frequency of mitochondrial COI gene haplotypes in 15 Ae. albopictus populations in Guangzhou
2.4 15个地理种群的遗传结构 分子变异分析(Analysis of molecular variance, AMOVA)结果表明:15个种群间COⅠ基因的遗传差异占4.09%,而种群内部的差异占95.91%。固定系数(Fixation Index,Fst)的值为0.040 9,P<0.01,认为广州市不同种群之间的白纹伊蚊的遗传差异主要来自种群个体内部,而各个种群之间的白纹伊蚊种群则没有表现出大的差异性。两两种群间的固定系数Fst(表5)在-0.02~0.13之间,SS和HP种群间的Fst值最小,PY/HD和SNG种群间的Fst值最大。除去部分Nm值为负值外,所有地点两两配对的Nm值都大于1,而且还有部分地点的两两配对的Nm值大于10,说明广州市11个行政区的的白纹伊蚊都有不同程度的基因交流。
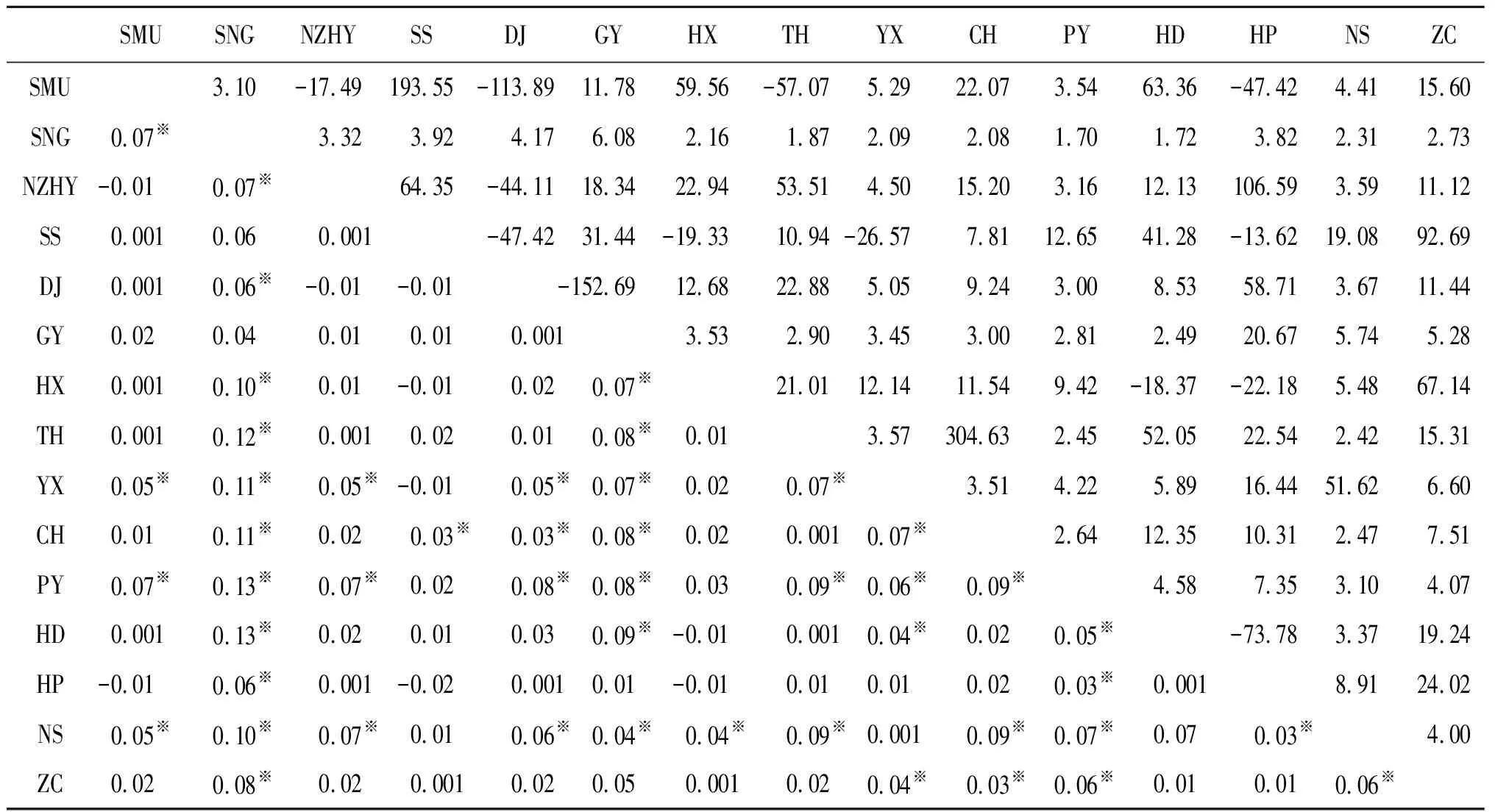
表5 广州市白纹伊蚊种群之间的固定系数(Fst)统计值(左下部分)和基因流(Nm)统计值(右上部分)Tab.5 Statistic of fixation(Fst, bottom left) and Gene flow(Nm, top right) of Ae. Albopictus population in Guangzhou
Mantel检验的回归系数为0.000 127,相关系数为0.072 0,P值为0.354。不能认为地理距离和遗传距离(Fst)这两者存在相关性,即广州市15个白纹伊蚊种群不存在地理隔离现象。
中性检验(表6)显示所有种群的两种检验的统计值都为负值。Tajima’sD检验的统计值的P值

表6 广州市白纹伊蚊种群中性检验Tab.6 Neutral test of Ae. albopictus population in Guangzhou
小于0.05的种群有7个,分别是:SMU、SS、TH、YX、HP、NS、ZC,表明广州市部分白纹伊蚊种群不符合中性理论;Fu’sFS检验的统计值的P值小于0.05的种群有12个,分别是:SMU、NZHY、SS、DJ、GY、HX、TH、YX、PY、HP、NS、ZC,表明了广州市的大部分种群(12/15)都在历史上发生过扩张。
如果错配分布(Mismatch distribution)的实际观察结果与期望值的某个假定模型(恒定或收缩)相吻合,则说明群体状态与期望的假定模型一致,反之,则说明背离期望值的假定模型,群体处于扩张状态(曲线为单峰)。在图2中可见DJ、ZC种群的分布为单峰分布,与期望的分布不一致,认为这些种群经历过扩张,SMU、NZHY、GY种群的分布在图形中有小凸起,结合中性检验的结果来看,可能是曾经经历过种群扩张,其余种群的分布与期望分布基本一致,认为这些种群的发展较平稳。
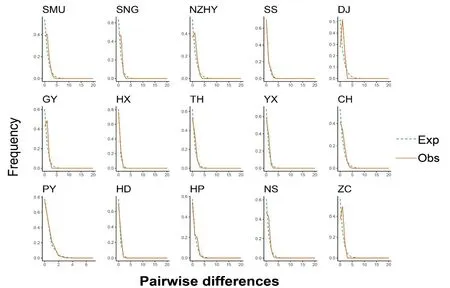
图2 广州市白纹伊蚊线粒体COI基因的错配分布Fig.2 Mismatch distribution of mitochondrial COI gene of Ae. albopictus in Guangzhou
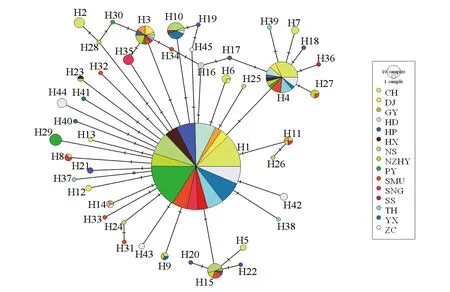
2.5 广州市白纹伊蚊单倍型的系统发育关系 DAMBE的序列饱和度分析会给出Iss和Iss.C两个统计值,当Iss的统计值比Iss.C的统计值小,且具有统计学意义的时候,可以认为序列没有达到饱和。结果为:Iss的值为0.001和0.002,Iss.C的值在0.716~0.804之间,P值小于0.01,表明序列没有达到饱和,可以用来建立系统发育树。各单倍型的聚类关系结果如图3所示,埃及伊蚊与所有的单倍型分开,单倍型34、单倍型3独自成为一支。单倍型16和单倍型17聚成为一个小支,接着其余单倍型则分成3个大支,其他地理种群的白纹伊蚊则分布在这3个大分支。巴基斯坦种群和单倍型21聚成一个小支,日本种群和单倍型15、单倍型5、单倍型22聚成一个小分支,云南种群和单倍型23聚成一个小支。

图3 广州市15个白纹伊蚊种群线粒体COI基因各单倍型间的聚类关系(NJ法)Fig.3 Clustering relationship among mitochondrial COI gene haplotypes of 15 Ae. albopictus populations in Guangzhou (NJ method)
在单倍型网络(图4)可见单倍型1(被全部15个种群所共享)为优势单倍型,基本所有的单倍型都以单倍型1为中心,说明单倍型1可能是祖先序列,其他单倍型则可能从单倍型1演化而来。而单倍型4,单倍型15也成为一个小中心。各单倍型之间只相差一个突变步骤,而单倍型1和单倍型37之间相差两个突变步骤。
3 讨 论
本次实验采样点包括广州市11个行政区,共15个白纹伊蚊种群。广州市15个白纹伊蚊种群的单倍型多样性在0.256~0.759之间,核苷酸多样性在0.000 50~0.001 59之间,平均核苷酸差异数在0.289~1.003 6之间,其中核苷酸多样性和广州市2011年的白纹伊蚊样品(0.000 6)相符合,略高于2017年福建省的白纹伊蚊样品(0.001 26),低于深圳市的白纹伊蚊样品(0.016 7)[13]。
Mantel检验的相关系数为0.033 4,但是没有统计学意义。原因可能有:①基因流(Nm)的计算结果表明广州市的白纹伊蚊种群存在较频繁的基因交流;②分子变异分析表明种群间的遗传距离很小。所以导致了遗传距离和地理距离之间没有相关性。
当两种中性检验的统计值接近0时,说明种群处于稳定阶段,而统计值为负值并且有统计学意义的时候,认为种群在历史上有过扩张迹象,Tajima’D更倾向于揭示古老种群发生扩张的历史,而Fu’sFS对近期种群的扩张更为敏感[24]。当Tajima’D检验为负值且有统计学意义时,可认为不符合中性理论,否则认为符合中性理论,当Fu’sFS检验为负值且有统计学意义时,认为种群在近期经历过扩张,否则认为种群的发展平稳[25]。
错配分布(Mismatch distribution)是关于样品中所有DNA序列之间成对差异数(Pairwise difference)的分布,而来自高度隔离的亚种群的合并样本中的平均序列差异会增加。在长期处于种群平衡状态的种群中,分布变得参差不齐,而不断增长的种群则产生了平滑且具有峰值的错配分布,高峰的位置反映了种群增长的时间[26]。错配分布中并没有太多的种群出现种群扩张的迹象。出现种群扩张迹象的部分种群的单峰也不明显。张瑞玲等[12]有研究显示:较高的单倍型多样性和较低的核苷酸多样性表明白纹伊蚊种群可能经历过“瓶颈效应”,之后伴随着种群快速扩张的历史事件,但由于扩张历史不长,核苷酸变异积累不充分。广州市白纹伊蚊的单倍型多样性远大于核苷酸多样性,这说明广州市的15个不同地点的白纹伊蚊种群可能经历过“瓶颈效应”后发生了种群快速扩张,但扩张历史不长,核苷酸变异积累不充分。
种群分化系数(Fst),又叫固定系数(Fixation index),表示种群之间的遗传分化程度,范围在0~1之间,值越大表明种群的分化程度越高。一般认为Fst<0.05表明种群出现轻度分化,0.05 系统发育树中各单倍型的聚类也没有表现出明显的地域特征,同样提示各个行政区的白纹伊蚊种群遗传差异小。白纹伊蚊虽然飞行距离有限,但是其蚊卵能够耐受恶劣环境,通过便利的交通工具间 注:单倍型间连线上的每条短线代表一个突变步骤。图4 基于Median joining network方法构建的单倍型网络图Fig.4 Haplotype network diagram based on the medium joining network method 接地促进了白纹伊蚊的扩散[29]。同时也有研究表明白纹伊蚊是侵袭性很强的物种,甚至在白纹伊蚊能取代埃及伊蚊而成为优势种群[30-31]。同时由于广州市重要的经济地位,使得广州市的交通运输和经济贸易运输十分发达,同样也可能会促进白纹伊蚊的扩散。 白纹伊蚊可携带并传播多种虫媒病毒,其作为一种侵袭性很强的物种,对人类的健康造成了不可忽视的影响。本研究通过对广州市15个白纹伊蚊种群的COI基因进行分析,发现了广州市的白纹伊蚊种群处于群体扩张阶段,频繁的基因交流使得广州市不同行政区之间的白纹伊蚊种群间分化水平不高,没有发现任意两两白纹伊蚊种群出现高度分化的情况,大部分种群都属于低度分化状态,各个种群间的遗传多样性不高。这些使得不同地理种群的白纹伊蚊具有相似的媒介能力[12]。 利益冲突:无 引用本文格式:郑梓豪,吴珊珊,魏勇,等.基于线粒体COI基因分析广州市15个白纹伊蚊种群的遗传多样性[J].中国人兽共患病学报,2021,37(11):985-994. DOI:10.3969/j.issn.1002-2694.2021.00.141