人抗SARS-CoV-2感染适应性免疫应答的研究进展
2021-12-15杨朝国吴俐莎杨晶艳
杨朝国,吴俐莎,杨晶艳
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)为β属冠状病毒,单正链RNA编码20多种蛋白质,其中结构蛋白主要由刺突蛋白(spikeprotein,S)、包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)和核衣壳蛋白(nucleocapsid,N)组成,S蛋白受体结合区(RBD)与血管紧张素转化酶2(ACE2)特异结合而感染细胞[1-3]。这些病毒蛋白可诱导人体免疫系统产生适应性免疫应答包括细胞免疫应答和体液免疫应答,S蛋白是诱导产生特异性保护免疫的主要甚至唯一成分,为2019冠状病毒疾病 (coronavirus disease 2019,COVID-19)疫苗的有效抗原。常用S蛋白和N蛋白作抗原检测SARS-CoV-2特异性抗体,S蛋白抗体为保护性抗体,N蛋白抗体可区分疫苗与SARS-CoV-2感染免疫。本文将对SARS-CoV-2自然感染诱导人体产生的适应性免疫应答进行综述。
1 人对SARS-CoV-2的T细胞免疫应答
1.1 急性SARS-CoV-2感染诱导的T细胞免疫应答 绝大多数COVID-19康复期患者体内可检出SARS-CoV-2特异性T细胞。严重COVID-19病人T细胞激活增加可能表明呼吸系统中抗原水平增加,但患严重超级炎症的病人早期T细胞免疫应答达到耗竭状态可能检测不到T细胞激活[4]。转基因小鼠模型显示T细胞对SARS-CoV-2感染后的病毒清除和疾病康复十分重要[5]。提示早期T细胞免疫应答可能在清除SARS-CoV-2和减轻COVID-19严重程度中发挥重要作用。T细胞激活为急性COVID-19的特征,是早期SARS-CoV-2特异性细胞免疫应答的结果。但外周血早期检出T细胞激活是否与组织特异事件有关,如血SARS-CoV-2特异性T细胞的延迟检出表明呼吸道中细胞免疫应答迟发,它们是否为涉及疾病严重程度及相互独立的事件,这些都有待阐明。
宿主年龄和性别等可能是早期免疫防御和SARS-CoV-2特异性T细胞免疫应答的重要影响因素。小儿COVID-19住院病人IFN-γ+CD4+T细胞和CD25+CD4+T细胞减少,高龄和男性患COVID-19并发症风险增加,女性SARS-CoV-2感染者T细胞激活稍有增强,年龄较大的COVID-19病人出现T细胞与B细胞的协作紊乱、活化T细胞显示出Ⅰ型IFN应答减少[4]。Ⅰ型IFN是启动抗病毒防御的关键炎症介质,Ⅰ型IFN应答减少导致SARS-CoV-2逃避免疫防御,病毒清除延迟。在患严重COVID-19病人中更常检测到降低Ⅰ型IFN活性的自身抗体和先天性免疫缺陷[4]。推测年龄越大的人SARS-CoV-2特异性T细胞延迟激活的风险越高,加之Ⅰ型IFN应答减少,导致病毒清除减少和COVID-19病情加重。影响早期抗SARS-CoV-2特异性 T细胞免疫应答的宿主因素及病毒因素还有待深入研究。
1.2 SARS-CoV-2特异性T细胞亚型应答 对新冠患者外周血标本的研究显示,大多数COVID-19康复期受试者SARS-CoV-2特异性CD4+T细胞应答强于CD8+T细胞应答[4]。组织(尤其在近上皮的屏障部位)中SARS-CoV-2特异性CD4+T细胞应答是否也占主导地位还需要研究证实。一些严重COVID-19患者Tfh分化减弱,COVID-19死者淋巴结和脾脏中生发中心缺乏Bcl6+Tfh且分化缺陷[4]。COVID-19病人血液中CD4+CXCR5+PD1+/-Tfh与健康献血员无差异,活化CD4+CXCR5+PD1+Tfh和静止CD4+CXCR5+PD1-Tfh都与浆母细胞无相关性[6]。SARS-CoV-2是否减弱Tfh形成、Tfh形成是否影响抗体应答等尚需进一步研究。
1.3 交叉反应性T细胞 在SARS-CoV-2未暴露者内存在识别SARS-CoV-2多肽的CD4+T细胞和CD8+T细胞。SARS-CoV-2多肽图谱分析显示未暴露SARS-CoV-2的血液捐献者预存SARS-CoV-2 T细胞免疫,识别的SARS-CoV-2多肽与季节性人类冠状病毒(HCoVs,如HCoV-NL63、HCoV-229E、HCoV-OC43和HCOV-HKU1)多肽间氨基酸序列具有高度相似性[4]。提示季节性HCoVs可诱导产生与SARS-CoV-2多肽发生交叉反应的CD4+T细胞和CD8+T细胞。交叉反应性T细胞在呼吸道防御致病性冠状病毒感染以及SARS-CoV-2特异性CD4+T细胞和CD8+T细胞的交叉反应性尚需深入研究。
抗SARS-CoV-2细胞免疫应答在个体间存在差异,在SARS-CoV-2扩散到下呼吸道和出现损伤性超级炎症前早期快速免疫应答可控制病毒血症,尤其早期快速T细胞免疫应答起着至关重要作用,但仍有多个未解问题。
2 人对SARS-CoV-2的B细胞免疫应答
2.1 SARS-CoV-2感染诱导抗体应答的抗原 10个SARS-CoV-2感染康复(确诊后10 d~29 d)者中,9人血浆能与S蛋白的胞外区(1~1 208氨基酸)、N-末端S1亚单位、C-末端S2亚单位、受体结合区(RBD)及N蛋白结合,1人血浆仅识别S蛋白胞外区和C-末端S2亚单位[7]。提示诱导产生抗体应答的SARS-CoV-2蛋白存在个体间差异,这可能影响疫苗免疫效果及抗体辅助感染诊断;临床上病人外周血SARS-CoV-2特异性抗体检出、抗体滴度及稳定性与检测用抗原如S蛋白/N蛋白、蛋白区段、单一片段/混合片段、线性多肽/稳定立体多肽等有关。
2.2 外周血SARS-CoV-2特异性抗体动态变化 SARS-CoV-2感染人体后病毒蛋白可诱导产生特异性IgM、IgG和IgA等[6,8-12]。在COVID-19症状出现后20 d内发生IgM、IgG和IgA血清学转换,转换时间中位数约2周,在转换后6 d内抗体滴度达到峰值;在症状出现后前3周血清特异性IgG、IgM和IgA滴度逐渐增加,然后IgM和IgA开始降低,但在症状出现4周后IgG仍为高水平[6,9]。对94例COVID-19康复病人血液抗体随访至症状出现后约6个月,抗体阳性率(96.2%vs58.5%)及中和抗体滴度(平均滴度19.0vs10.0) 较急性期降低[12]。
外周血SARS-CoV-2特异性抗体类别检出先后顺序有4种情况[6,9]:①IgG早于IgM(38.5%);②IgG和IgM同时检出(34.6%);③IgM检出早于IgG(26.9%);④IgA早于IgM和IgG,血清抗RBD-IgA出现阳性的时间明显早于抗RBD-IgG(中位数12vs15 d)。症状出现后前7 d SARS-CoV-2特异性抗体应答以IgA为主,其次为IgG,再次为IgM,血清抗RBD的IgA、IgG和IgM检出率分别为31%、15%和15%,抗N蛋白的IgA、IgG和IgM检出率分别为23%、15%和2%[6]。COVID-19病人血SARS-CoV-2特异性IgG的检出率和浓度均高于IgM[13-14]。
COVID-19病人外周血SARS-CoV-2特异性IgM、IgG和IgA的浓度和检出率因病程不同而异;血清SARS-CoV-2特异性IgM、IgG和IgA都可在感染早期检出,有助于感染早期诊断,但在个体间存在抗体类别差异;在急性感染早期血清SARS-CoV-2特异性IgM、IgG和IgA水平随时间推移而增加,随后IgM和IgA水平下降,IgG在较长时间内维持高水平,故血清特异性抗体动态监测更有意义;对SARS-CoV-2感染诊断,血清IgM、IgG和IgA联合检测阳性率更高;对SARS-CoV-2感染流行病学调查和抗体持久性评估,血清IgG更合适。
2.3 不同临床类型COVID-19患者对SARS-CoV-2的抗体应答 在发病后约2个月,重型和轻型COVID-19病人血清RBD特异性总抗体滴度都维持在高水平[8,10]。重型与非重型COVID-19成人患者比较,症状出现后10 d内血清SARS-CoV-2特异性IgG、IgA和IgM滴度差异无统计学意义,20 d内均可检出病毒特异性抗体[6]。39例重型和246例非重型COVID-19患者,症状出现后17~19 d血清SARS-CoV-2特异性IgG阳性率为100%,20~22 d血清特异性IgM阳性率为94.1%;对63例病人住院期间血清SARS-CoV-2特异性抗体动态监测,最终血清学转换率为96.3%,只有一对母女血清IgG和IgM一直阴性,重型病人血清特异性IgG和IgM滴度均高于非重型病人[9]。83例重型和109例轻型COVID-19病人,在发病后前6 d血清RBD特异性IgM无差异,以后重型病人血清RBD特异性总抗体和IgM的滴度和检出率均高于轻型病人;重型病人血清RBD特异性IgM平均滴度在症状出现后约21 d达峰值,而轻型病人无明显峰值;症状出现后13~18 d重型病人血清RBD特异性IgM检出率为100%,而轻型病人仅57%;症状出现后7~42 d重型病人血清RBD特异性总抗体的检出率为98.7%,而轻型病人为83%[8]。提示重型COVID-19病人对SARS-CoV-2的抗体应答强于非重型病人,但在疾病早期二者无差异。与非ICU幸存者比较,死亡病例血浆IL-6、IL-8、TNFα和MCP-1高水平,与预融合S蛋白结合的IgA高百分比;非ICU和ICU病人康复与RBD抗体和预融合S蛋白抗体亲和性成熟有关;高水平IL-6和IL-8、高血清特异性IgA及抗体亲和性成熟减弱预示疾病结局差[15]。提示SARS-CoV-2抗体可能参与COVID-19病理过程,抗体类型、水平及亲和性可能与疾病严重性和预后有关。这对COVID-19疫苗研发和治疗有重要价值,但还有待进一步研究。
ELISA法检测30 082例轻中度COVID-19患者血浆SARS-CoV-2 S蛋白抗体结果显示,92.88%为中高滴度≥1∶320。1∶80占2.29%,1∶160占4.83%,1∶320占22.49%,1∶960占31.79%,≥1∶2 880占38.60%;95%~99%的SARS-CoV-2核酸PCR试验阳性者产生S蛋白的抗体;滴度至少稳定5个月,可能是骨髓中长寿命浆细胞维持抗体滴度;抗体阴性至滴度≥1∶2 880的120个SARS-CoV-2中和试验结果显示,抗体滴度1∶80~1∶160的50%、1∶320的90%及≥1∶960的100%血浆有中和病毒活性,中和滴度与S蛋白结合滴度高度相关[16]。提示绝大多数轻中度COVID-19患者对SARS-CoV-2 S蛋白产生较强抗体应答,90%以上的血清学转换者产生了中和抗体,滴度至少在感染后几个月内保持稳定。
Long等[11]对37例SARS-CoV-2感染无症状者和37例有症状者研究显示,前者排毒期中位数为19 d[四分位数间距(IQR)15~26 d,最短6 d,最长45 d],后者为14 d(IQR 9~22 d),无症状者排毒期显著长于有症状病人;在暴露后3~4周血浆SARS-CoV-2 N蛋白和S蛋白的抗体联合检测,无症状者血清IgM和IgG阳性率分别为62.2%和81.7%,有症状者分别为78.4%和83.8%;在急性感染期和康复早期(出院后8周)无症状者血清SARS-CoV-2特异性IgG水平均显著低于有症状病人;在康复早期,大多数无症状者和有症状病人血清SARS-CoV-2特异性IgG及中和抗体水平都下降,无症状者下降分别为93.3%和81.1%,有症状病人下降分别为96.8%和62.2%,40%的无症状者和12.9%的有症状病人血清IgG变为阴性。提示与COVID-19病人比较,无症状感染者对SARS-CoV-2产生的免疫应答较弱,病毒清除慢,排毒期更长。
对SARS-CoV-2的特异性抗体应答强度、动力学、功能性及持久性等对血清学监测、认识免疫应答的保护效果、保护机体免受再感染、制订防控措施及免疫策略等至关重要,因此阐明不同人群对SARS-CoV-2免疫应答特征具有重要意义。
2.4 交叉反应性抗体 20例2003年SARS康复者血清可与SARS-CoV-2 S蛋白膜外区、S2、RBD和S1的重组蛋白发生反应,1∶100血清与SARS-CoV-2的重组N蛋白显示高反应性,对SARS-CoV-2假病毒的交叉中和滴度为1∶20~1∶360;SARS-CoV全长S蛋白和RBD免疫小鼠和兔制备的抗血清对SARS-CoV-2假病毒有交叉中和作用[17]。COVID-19患者血清与SARS-CoV S蛋白的S1亚单位无交叉结合,但与N蛋白有交叉反应性[9]。7种人冠状病毒N蛋白和S蛋白的氨基酸序列同源性的相似指数分别为≥24.1%和≥29.3%,与SARS-CoV-2相似指数最高的是SARS-CoV,分别为90%和75.3%,相似指数23.2%即可发生交叉反应[18]。提示SARS-CoV-2与SARS-CoV抗体存在交叉反应,可交叉中和SARS-CoV-2,但对SARS-CoV-2的抑制作用低于SARS-CoV;其它HCoVs抗体可引起SARS-CoV-2抗体试验假阳性反应;研究开发冠状病毒通用疫苗值得期待。
灵长动物模型感染SARS-CoV-2后在一段时间内可保护机体免受再次感染,给动物输入康复动物血浆或中和单克隆抗体有保护作用并显著降低病毒复制[16]。提示人感染SARS-CoV-2后可获得抵抗再感染的免疫力。但在感染SARS-CoV-2的各类人群中都存在低比例的不发生血清学转换者而未获得免疫力,这也导致血清SARS-CoV-2特异性IgM、IgG、IgA及总抗体试验阴性。对SARS-CoV-2的抗体应答强度在个体间存在差异,这可能与年龄、性别、免疫功能状态、遗传因素(如HLA型别)、基础疾病等有关。康复期血清特异性IgM和IgA抗体水平下降,但IgG水平可稳定较长时间[6]。这些影响感染诊断、血清学监测和防控措施,对疫苗研发与免疫方案具有参考价值。机体对SARS-CoV-2感染的抗体应答强度、功能性、中和效应、持久性及冠状病毒间交叉免疫保护等诸多问题仍不确定。
3 SARS-CoV-2感染诱导的免疫记忆
免疫记忆是感染或疫苗接种后持久免疫保护的基础,由抗体、记忆B细胞、CD4+记忆T细胞和CD8+记忆T细胞组成[19]。对COVID-19康复者血液中SARS-CoV-2特异性的抗体、记忆B细胞、CD4+记忆T细胞和CD8+记忆T细胞研究结果显示,感染后1~8个月SARS-CoV-2 S蛋白特异性记忆B细胞增加,主要为IgG+记忆B细胞,其次为IgA+记忆B细胞,IgM+记忆B细胞寿命短暂;感染后1个月时~70%受试者可检出SARS-CoV-2特异性CD8+记忆T细胞,93%受试者可检出SARS-CoV-2特异性CD4+记忆T细胞,6~8个月时CD8+记忆T细胞下降到~50%(半衰期为3~5个月),CD4+记忆T细胞仍有92%,能辅助B细胞的S蛋白特异性CD4+记忆T细胞(Tfh细胞)仍存在;随访至感染后8个月,S蛋白抗体和RBD抗体适度下降,抗S蛋白-IgG、抗RBD-IgG及中和抗体的动力学相似,感染后6~8个月绝大多数受试者体内仍有抗S蛋白-IgA[19]。SARS-CoV-2感染者血液中抗S蛋白-IgG滴度至少稳定5个月,中和抗体、记忆B/T细胞可稳定6个月,可能是骨髓中长寿命浆细胞维持循环抗体滴度[11,16,20]。但也有多个研究显示在4~6个月内血液特异性抗体显著降低,94例COVID-19康复者在症状出现后约6个月时血液特异性抗体阳性率(96.2%vs58.5%)及中和抗体滴度(GMTs,19.0vs10.0) 较急性期都显著降低[12];轻中度COVID-19病人血清中结合抗体及中和抗体在感染后前4个月衰减,S蛋白特异性CD4+T细胞和循环Tfh细胞类似下降,但IgG+记忆B细胞随时间推移而增加,免疫动力学模型预测在感染后74 d时50%康复者血清中和活性大于1∶40[21];轻度到重度COVID病人在120 d内血清SARS-CoV-2中和抗体滴度快速衰减,但S蛋白特异性IgG+记忆B细胞稳定或随时间推移而增加,再次应答表现出体细胞高频突变、抗体亲和性及中和效力随时间推移而增加[22]。提示绝大多数COVID-19康复者形成记忆细胞,CD4+记忆T细胞和IgG+记忆B细胞稳定时间较长,血液抗体滴度可稳定3~6个月,但持久性有待进一研究。
组织定居记忆T细胞(TRM)为一特殊记忆T细胞,定居于非淋巴组织,不参与淋巴细胞再循环,被称为快速防御再感染的“局部哨兵”。TRM可对呼吸道感染提供抗严重肺部疾病保护,目前没有证据支持TRM提供“消除性免疫”,但TRM能促进上呼吸道SARS-CoV-2感染、复制和扩散的快速控制[4]。COVID-19康复者是否产生SARS-CoV-2特异性TRM,TRM是否提供长期保护,季节性HCoVs诱生的TRM是否能阻止SARS-CoV-2从上呼吸道向肺扩散而减少重型COVID-19,这些仍不清楚。
SARS-CoV-2 S蛋白特异性记忆B细胞和CD4+记忆T细胞持续时间相对较长,至少可以维持6~8个月。但记忆细胞是否能对SARS-CoV-2产生保护性免疫,功能记忆细胞是否可持续存在到感染后多年并保护机体免受再次感染,SARS-CoV-2感染或患COVID-19后免疫记忆的持续时间,这些还需进一步研究。对COVID-19疫苗可能要求比自然感染更强的免疫原性和更长的持久性以获得长期免疫保护。
4 SARS-CoV-2再感染
SARS-CoV-2感染康复后数天~数月呼吸道可再次检出SARS-CoV-2核酸和(或)出现COVID-19症状[6,8-9,11,16]。病毒基因组序列比对可判断先后感染病毒的差异性[20]。到2020年10月底再感染病例数至少荷兰50例、巴西95例、瑞典150例、墨西哥285例、卡塔尔243例、韩国25例等[20]。因时间或经济原因,基因组序列分析证实的再感染数低于疑似再感染数[20]。意大利对普通人群随访平均280(SD41)d,再感染率为0.31%(5/1 579,95%CI: 0.03%~0.58%)[23]。英国对保健工作者随访7个月,再感染率为1.87%(155/8 287)[24]。提示SARS-CoV-2感染诱导产生的免疫力具有保护作用,COVID-19康复者再感染SARS-CoV-2为低风险事件。
SARS-CoV-2再感染的可能原因[6,8-9,11,16,20,25-26]:①同时感染二种病毒或各种压力等因素影响机体免疫系统功能导致病毒被抑制但并未被完全清除,残留的原感染病毒非复制RNA引起再次试验SARS-CoV-2 RNA阳性。一些未确认的再感染实际上是原病毒复苏;②首次SARS-CoV-2感染诱导产生的免疫力在几个月内显著下降,使再感染风险增加。如果疫情早期病例开始丧失免疫力,再感染可能更常见;③首次患危重型COVID-19病人产生无效抗体,使他们易再感染,但尚无来自再感染病人的证据;④首次SARS-CoV-2感染时低水平/无适应性免疫应答,未获得免疫力;⑤再感染变异病毒,首次SARS-CoV-2感染诱导机体产生的免疫力对变异病毒无/低效而发生免疫逃逸。研究发现疫苗诱导的抗体对B1.1.7、P.1、B.1.351和B.1.617.2变异株的中和滴度降低[27-29];B.1.617变异株对疫苗和感染诱导的抗体敏感性降低而发生免疫逃逸[30-31];B.1.351变异株假病毒完全逃逸三类治疗相关抗体及康复者血浆中和作用[32];多个单克隆抗体、多数康复者血清和BNT162b2 mRNA疫苗受试者血清对S蛋白E484K突变病毒抑制活性降低,结合S蛋白受体结合区和N-末端区(NTD)的抗体对一些变异株的中和作用下降[33]。提示存在再感染截然不同的变异病毒的可能性,预示野生毒株S蛋白疫苗的保护力降低,需要调整S蛋白序列以防止疫苗保护效力丧失。但对感染祖先株COVID-19康复者、mRNA-1273或BNT162b2疫苗受试者SARS-CoV-2特异性CD4+T细胞和CD8+T细胞应答分析显示,B.1.1.7、B.1.351、P.1和CAL.20C四个变异株仅有微弱影响,绝大多数T细胞表位序列未受到变异株突变的影响[34]。提示T细胞免疫应答基本不受已发现SARS-CoV-2突变的影响。
有研究认为再次感染比首次感染症状更轻,可能是首次感染产生了免疫力,这可能也是再感染少见的原因。但也有SARS-CoV-2再感染时疾病加重的报道(表1)[25]。突变可使病毒的致病性更强或帮助病毒逃逸机体免疫监视,若再次感染毒力更强的病毒或抗体增强效应(ADE)可促进感染或疾病加重甚至致死性再感染。研究发现针对S蛋白NTD特定位点的抗体增强S蛋白与ACE2结合能力和SARS-CoV-2感染性,这种抗体在重型病人中高水平检出[35]。提示SARS-CoV-2感染可诱生中和抗体也可产生感染增强性抗体。某些疾病首次感染诱导产生无效的非中和抗体及T细胞,阻碍再次感染时产生更有效的免疫应答,但再感染也可使免疫系统得到继续增强和训练[20]。
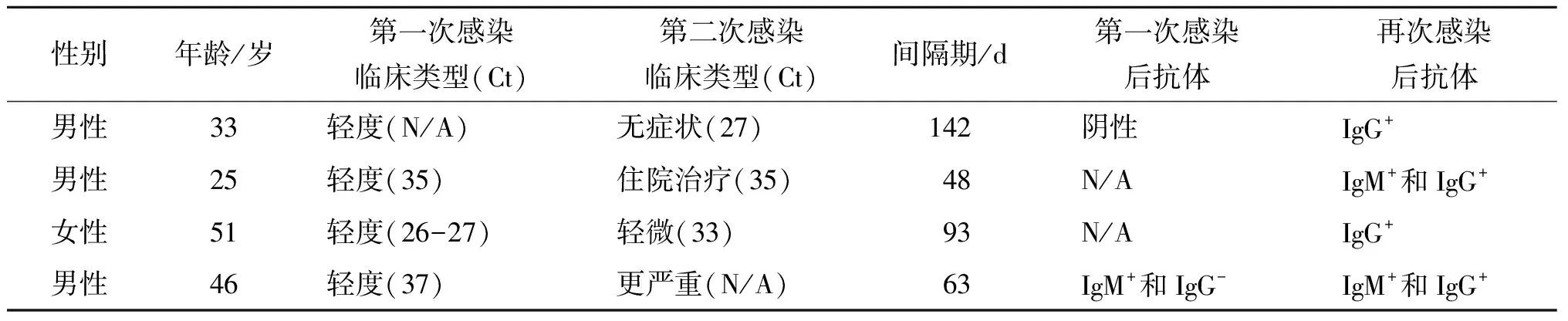
表1 SARS-CoV-2再感染的特征[25]Tab.1 Characteristics associated with reinfection with SARS-CoV-2
COVID-19流行结束的关键是免疫应答保护宿主免受再感染的效力和时长。抗体水平与暴露后时间高度相关,未来的关键是查明再感染时S蛋白抗体水平和特异性,再次暴露前预存免疫应答及病毒量也需要进一步研究。再感染提示一些个体感染SARS-CoV-2获得的免疫力可能不牢固或较快减弱,不能依靠自然感染SARS-CoV-2来获得群体免疫,要靠安全、有效的疫苗[25-26]。再感染的深入研究将有助于更好地了解自然感染SARS-CoV-2诱导的免疫水平与保护作用的关系,这将对疫苗研发与应用以及疫苗接种形成个体免疫和群体免疫的阈值提供重要信息。
5 COVID-19长期症状(Long COVID-19)
约10%COVID-19病人经历持续1个多月的各种各样的症状,一些病人功能障碍和并发症至少持续6个月[4,20]。许多表现被认为是严重COVID-19持续组织损伤所致,但许多较轻微COVID-19患者也经历心血管、神经和呼吸系统的慢性、缓慢消失的症状[4]。高水平中和抗体的个体也有胃肠道疾病、疲劳和认知障碍[20]。提示持续免疫激活/炎症可能在COVID-19长期症状中发挥作用。这可能涉及多种机制,COVID-19长期症状在女性中的发生率高于男性,这与自身免疫性疾病类似,T细胞可能通过自身免疫或炎性疾病的类似机制参与COVID-19长期症状;鉴于HCoVs特异性T细胞可与多发性硬化症病人髓鞘质发生交叉反应,可能通过分子模拟引起COVID-19后的自身免疫相关疾病,但SARS-CoV-2特异性T细胞抗自身物质尚未确定;HLA型别可能影响机体对COVID-19敏感性/严重性[4]。有研究显示SARS-CoV-2能在消化道持续存在数月,持续感染可能也是一些COVID-19长期症状的原因[20]。抗体或T细胞免疫应答是否在COVID-19长期症状中发挥作用仍不清楚,HLA或其它免疫相关基因是否与发展为COVID-19长期症状风险增高有关尚需大量的免疫遗传学研究。
6 总结与展望
全面了解人体对SARS-CoV-2的B细胞免疫应答有助于疾病诊断、治疗及疫苗开发。血液中SARS-CoV-2特异性抗体对人体具有保护作用,可辅助诊断SARS-CoV-2感染,也可用于SARS-CoV-2感染流行病学调查等。非中和抗体是否能有效清除人体内病毒,其是否对人体有害:如促进感染或加重疾病,抗体的特异性、类型及亲和性成熟等是否与COVID-19严重性或康复相关,抗体在人体内持续存在时间,SARS-CoV-2再感染机制等诸多方面尚需进一步研究。人体抗SARS-CoV-2感染适应性免疫应答的主要特征见表2。

表2 人抗SARS-CoV-2适应性免疫应答的主要特征Tab.1 Main characteristics of adaptive immune responses against SARS-CoV-2 in humans
因感染诊断、治疗、疫苗等研究的需要,人抗SARS-CoV-2感染适应性免疫应答的研究最初集中于抗体应答。T细胞对呼吸系统许多病毒感染的早期控制和病毒清除至关重要,CD4+T细胞激活对抗体应答和CD8+T细胞激活对病毒清除至关重要,CD4+T细胞应答和CD8+T细胞应答在COVID-19严重性及康复中也起着重要作用。SARS-CoV-2诱导的T细胞免疫应答对人体是否有害?T细胞免疫应答对人体抵抗SARS-CoV-2感染是否有保护作用?如果有,诱导T细胞免疫应答的关键抗原是什么?SARS-CoV-2是否诱导Tfh应答?SARS-CoV-2特异性记忆T细胞在人体内持续存在时间有多久?这些问题的阐明对明确COVID-19疫苗的安全性、免疫原性、保护效力以及不同疫苗间比较性评价都有重要意义,深入研究SARS-CoV-2诱导的T细胞免疫应答对弄清COVID-19长期症状发生机制也有价值。
利益冲突:无
引用本文格式:杨朝国,吴俐莎,杨晶艳.人抗SARS-CoV-2感染适应性免疫应答的研究进展[J].中国人兽共患病学报,2021,37(11):1022-1028,1036. DOI:10.3969/j.issn.1002-2694.2021.00.145
