水合硝酸镁热解过程研究
2021-12-15张孟辉王德喜
陈 雪,张孟辉,赵 亮,董 辉,王德喜
(1.东北大学国家环境保护生态工业重点实验室,辽宁沈阳110819;2.沈阳工业大学)
世界上红土镍矿约占镍矿总资源量的55%,是镍冶炼的主要原料之一,仅2019年中国进口红土镍矿达到5 615万t。随着硫化镍矿的日渐枯竭,红土镍矿在镍冶炼中的比例逐年增加[1-2]。硝酸加压浸出工艺是目前红土镍矿冶炼技术的研究热点[3],其中中间产物水合硝酸镁的资源化利用是实现该浸出工艺绿色化的关键。水合硝酸镁[Mg(NO3)2·nH2O]通过热分解生成MgO和NOx,MgO和NOx制酸后回用是目前水合硝酸镁资源化利用的主要工艺。因此,探究水合硝酸镁的热解反应过程尤为重要。
目前有关Mg(NO3)2·2~3H2O热解过程的研究尚未见文献报道,原因之一是Mg(NO3)2·2~3H2O易吸潮,常温下变成稳定的Mg(NO3)2·6H2O。有关Mg(NO3)2·6H2O的热解研究较少,MADARASZ等[4]对Mg(NO3)2·6H2O热解气相产物开展了研究,确定了Mg(NO3)2·6H2O热解气相的成分;PRADITA等[5]使用TGA、XRD和扫描电镜(FE-SEM)等对Mg(NO3)2·6H2O雾化热解产生的MgO颗粒进行表征,在700~900℃雾化条件下获得了MgO粉末,且在900℃时获得MgO颗粒的粒度最小。二者仅研究了Mg(NO3)2·6H2O的气相产物及MgO粉末,尚未对Mg(NO3)2·6H2O热解阶段的划分、各阶段气相与固相产物进行研究。基于此,笔者拟研究Mg(NO3)2·6H2O热解反应过程,为后续技术实施提供理论指导。
1 实验部分
1.1 原料和仪器
原料:Mg(NO3)2·6H2O,分析纯,纯度为99%,密度为1 630 kg/m3,经粉碎机粉碎、研钵细磨至一定的粒度,然后在60℃干燥4 h,除去自由水,接着细磨、干燥,用于热分析实验研究。
仪器:TG209F1热重分析仪;STA409PC同步热分析仪;TENSOR-27傅里叶红外光谱仪;X-Pert Pro X射线衍射仪;Q20差示扫描量热仪。
1.2 实验方法
在镁资源化利用技术研究中,对Mg(NO3)2·nH2O热解反应原理的研究是一项重要的基础研究工作,其对红土镍矿硝酸加压浸出工艺的研发和工程应用有着重要的指导意义。TG、FT-IR、XRD与DSC是研究样品的物理性质随温度或时间变化关系的一类热分析技术,在分析样品化学反应方面的应用非常广泛[6-7]。笔者拟采取该分析手段研究Mg(NO3)2·6H2O的热解过程。
1)采用热重-傅里叶红外光谱联用仪[8-9]分析Mg(NO3)2·6H2O的热解过程。采用的仪器分别为TG209F1热重分析仪、STA409PC同步热分析仪、TENSOR-27傅里叶红外光谱仪。热重分析使用的坩埚为Φ6 mm×4 mm圆柱形Al2O3坩埚。在热重分析仪中以10℃/min的升温速率将Mg(NO3)2·6H2O粉末热解,将产生的气体通过传输管道引入红外光谱仪的气体检测池中,载气为高纯氮气,流量为30 mL/min。由于传输管道较短,气体传输速度很快,不会对气相产物检测结果造成影响,故将气体的传输延迟时间忽略。分析Mg(NO3)2·6H2O样品在热解过程中的质量损失及气相演变。实验条件:样品质量为5 mg,温度范围为室温~600℃,扫描波数范围为400~4 000 cm-1,分辨率为4 cm-1,气体输送线路温度为180℃,气体池温度为190℃。
2)采用X射线衍射仪[10]分析Mg(NO3)2·6H2O热解过程的固相产物。将Al2O3坩埚中Mg(NO3)2·6H2O粉末的热解样品研磨至粒径<75μm,然后装样压片,放入XRD样品台分析热解固相产物的物相。实验条件:Cu靶-Kα1射线源,步长为0.02°,扫描速度为8(°)/min,电压为40 kV,电流为30 mA。
3)采用差示扫描量热仪分析Mg(NO3)2·6H2O热解过程的吸放热情况。实验条件:N2气氛,样品质量为21.13 mg,温度范围为室温~800℃,升温速率为10℃/min。
2 结果与分析
2.1 Mg(NO3)2·6H2O分解反应阶段
图1为Mg(NO3)2·6H2O的TG-DTG曲线。从图1看出,Mg(NO3)2·6H2O的热解过程可以分为3个阶段:Ⅰ阶段,DTG曲线上出现1个质量损失强峰,此阶段质量损失率高达31.53%,质量损失速率随着温度的升高而逐渐增大,随后又减小直至平缓;Ⅱ阶段,DTG曲线变化很小,此阶段质量损失率为15.29%,在200~300℃质量损失速率为常数,质量损失较小,随后DTG曲线出现一个小峰,随着温度的升高质量损失速率逐渐增大后又逐渐减小;Ⅲ阶段,样品的质量损失率高达38.92%,DTG曲线出现一个最强峰,质量损失速率随着温度的升高而迅速增大,随后又减小直至0,并且在450℃达到整个热解过程的最大质量损失速率7.8%/min,最后样品的残余质量为原料质量的14.26%。各阶段特征参数见表1。

图1 Mg(NO3)2·6H2O的TG-DTG曲线Fig.1 TG-DTG curve of Mg(NO3)2·6H2O
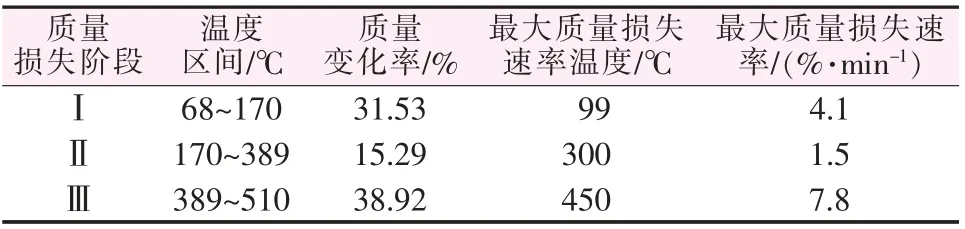
表1 Mg(NO3)2·6H2O热解过程数据Table 1 Data of Mg(NO3)2·6H2O pyrolysis process
2.2 Mg(NO3)2·6H2O热解气相产物
Mg(NO3)2·6H2O主要结构和官能团的红外吸收峰及对应的波长范围见表2[11-12]。
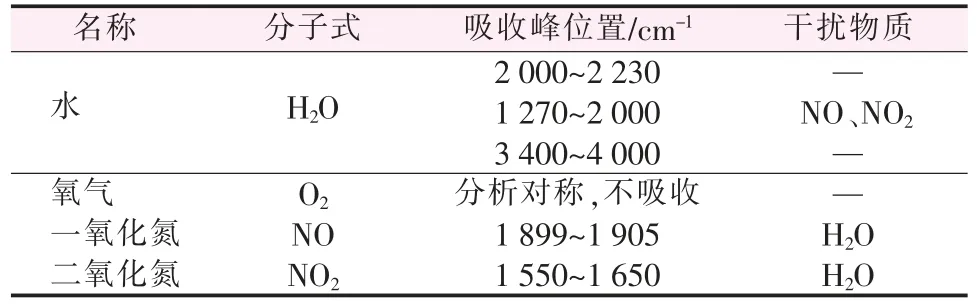
表2 Mg(NO3)2·6H2O热解气相产物的红外吸收峰Table 2 Infrared absorption peaks of gas products for pyrolysis of Mg(NO3)2·6H2O
图2为Mg(NO3)2·6H2O热解过程产生气体的三维红外光谱图;图3为Mg(NO3)2·6H2O热解过程各阶段质量损失率最大时产生气体的红外光谱图。图中的吸光度越大,表明此红外吸收峰对应的气相产物的体积分数越大[13]。
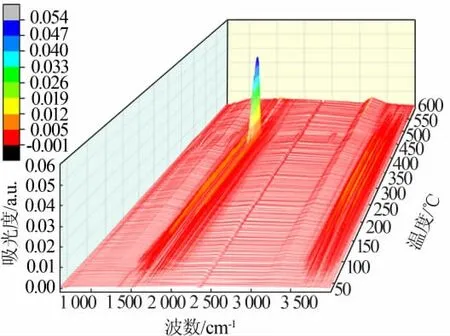
图2 Mg(NO3)2·6H2O热解气相产物的三维FT-IR图Fig.2 The FT-IR spectra of gas products for pyrolysis of Mg(NO3)2·6H2O
从图3a看出,1 300~1 800、3 038~3 964 cm-1处的峰是H2O的特征吸收峰,并且没有NO2的特征吸收峰,说明Ⅰ阶段主要发生结晶水的脱除,Mg(NO3)2·6H2O还没发生热解。从图3b看出,析出的气相主要也是H2O,其特征吸收峰波数范围为1 300~1 800、3 038~3 964 cm-1,并且没有NO2的特征吸收峰,说明Ⅱ阶段主要发生结晶水的脱除,Mg(NO3)2·6H2O还没发生热解。从图3c看出,析出的气相主要是NO2,其特征吸收峰波数范围为1 550~1 650 cm-1,说明Ⅲ阶段Mg(NO3)2·6H2O开始发生热解,生成NO2。

图3 Mg(NO3)2·6H2O热解各阶段气相产物的FT-IR图Fig.3 The FT-IR spectra of gas products for each stage of pyrolysis of Mg(NO3)2·6H2O
2.3 Mg(NO3)2·6H2O热解固相产物
Mg(NO3)2·6H2O热 解 过 程 产 生 的 固 相 产 物XRD谱图见图4。从图4a看出,Mg(NO3)2·6H2O经170℃热解产生的固相产物的主要物相为Mg(NO3)2·6H2O。Ⅰ阶段的FT-IR图表明,该阶段生成的气相产物为H2O,故该阶段主要发生结晶水的脱除,Mg(NO3)2·6H2O还没有发生热解。结合TG-DTG曲线表明,Ⅰ阶段实际质量损失率为31.53%,故由此可知Mg(NO3)2·6H2O在该阶段失去4个结晶水,但是由于硝酸镁的二水合物在常温下不稳定,所以失去的结晶水在常温时又重新形成六水结晶物,故Ⅰ阶 段 生 成 的 中 间 产 物 为 二 水 硝 酸 镁[Mg(NO3)2·2H2O]。Ⅱ阶段的FT-IR图表明,该阶段生成的气相产物为H2O,故该阶段主要发生结晶水的脱除,并且没有NO2产生,表明Mg(NO3)2·2H2O还没有发生热解。结合TG-DTG曲线表明,Ⅱ阶段实际质量损失率为15.29%,故由此可知Mg(NO3)2·2H2O在该阶段失去2个结晶水,该阶段生成中间产物无水硝酸镁[Mg(NO3)2]。从图4b看出,Mg(NO3)2·6H2O经500℃热解产生的固相产物的主要物相为MgO,结合TGDTG曲线表明Ⅲ阶段实际质量损失率为38.92%、FT-IR图表明Ⅲ阶段生成的气相产物为NO2,故由此可知Mg(NO3)2·6H2O在该阶段发生化学分解反应,生成MgO和NO2。
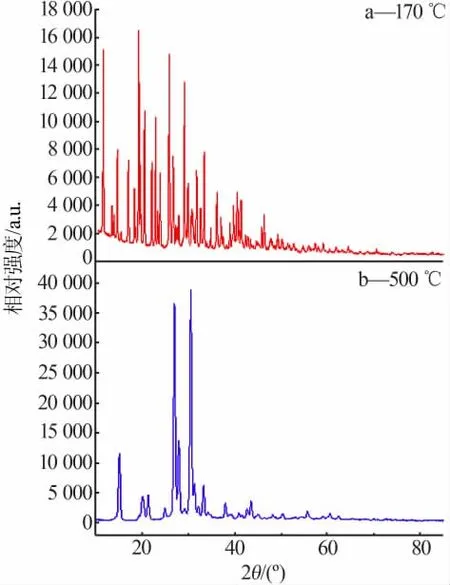
图4 Mg(NO3)2·6H2O热解固相产物的XRD谱图Fig.4 XRD patterns of solid products for pyrolysis of Mg(NO3)2·6H2O
2.4 Mg(NO3)2·6H2O热解反应热
Mg(NO3)2·6H2O的DSC曲线见图5。从图5看出,样品DSC曲线有两个吸热峰,表明Mg(NO3)2·6H2O热解是吸热反应,通过峰面积获得Mg(NO3)2·6H2O热解吸收热量为940.50 J/g。观察DSC曲线得知在389~510℃热解吸热最多,占总吸收热量的85.88%,说明Mg(NO3)2·6H2O热解所需热量主要消耗在热解的Ⅲ阶段,即生成NO2阶段。此外,根据Mg(NO3)2·6H2O的热解现象,90~115℃吸收热量主要与Mg(NO3)2·6H2O的融化吸热有关。
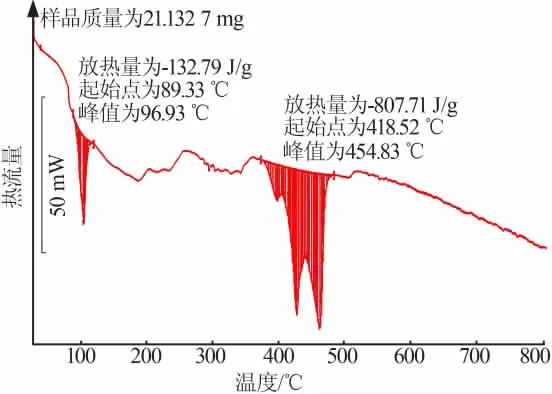
图5 Mg(NO3)2·6H2O的DSC曲线Fig.5 DSC curve for Mg(NO3)2·6H2O
3 结论
利用TG-DTG、FT-IR、DSC与XRD等技术手段探究了水合硝酸镁热分解的基本过程,得到结论:水合硝酸镁热解是一个复杂的多步反应,包括两个脱水阶段和一个热解阶段。Mg(NO3)2·6H2O在第一脱水阶段(68~170℃)失去4个结晶水生成Mg(NO3)2·2H2O;在第二脱水阶段(170~389℃)失去2个结晶水 生 成Mg(NO3)2;Mg(NO3)2在 热 解 阶 段(389~510℃)生成氧化镁,并伴有NO2和O2析出。水合硝酸镁热解是一个吸热反应,吸热量为940.50 J/g。其中,分解阶段所需热量最多,占总吸热量的85.88%。其热解方程式:

