烷基糖苷中残余葡萄糖含量测定方法研究
2021-12-15叶丹妮车国勇张豫红姚永毅
邢 捷 叶丹妮 车国勇 张豫红 姚永毅,2
(1.成都科宏达化学有限责任公司,四川成都,610000;2.四川大学轻工科学与工程学院,四川成都,610065)
随着人们环保理念的增强,新型绿色环保型表面活性剂受到越来越多科研工作者的重视。烷基糖苷(Alkyl Polyglycoside,简称APG)作为一种植物源性绿色表面活性剂[1],因其性能温和且具有极好的环境友好性而被广泛应用于化妆品、洗涤剂、涂料和食品工业等多个领域。但初步合成的烷基糖苷体系中残余葡萄糖的存在不仅会降低糖利用率造成APG生产成本增高、产品色泽加深,还会由于自身的聚合或降解导致在脱醇过程中引入副产物[2-3],严重影响产品的溶液性能。因此,建立一套快捷准确的残糖分析方法是很有必要的。
目前在制定的烷基糖苷国家标准GB/T 19464-2004(烷基糖苷)[4]中并未涉及残糖分析方法这一内容,但残余葡萄糖含量这一产品指标却对产品性能起着重要影响。有不少工作者通过创新或方法嫁接仍在探寻一种便捷的残糖分析方法。近年来,一般采用高效液相色谱法[5]、DNS比色法[6]以及滴定法等方法对烷基糖苷中的残余葡萄糖含量进行分析。但前两种检测方法所使用的仪器造价高,增加了生产成本,一般工厂也不具备这种条件,而滴定技术则成本低廉,对操作人员的素质要求也相对较低,极大地节约了测试成本。因此寻找一种简便快捷、低成本且准确的分析方法对烷基糖苷产品走向工业化大规模生产有着重要意义。食品中还原糖直接滴定法GB5009.7-2016(食品中还原糖的测定)[7]中的第一法,即直接滴定法,多被用于还原糖的测定。因烷基糖苷样品中含具有还原性的葡萄糖,而将其应用到烷基糖苷体系的残糖含量[8-9]测定中。碘量法[10]是测定葡萄糖含量的常规分析方法,基于其氧化还原滴定的原理,也将其引入烷基糖苷残糖含量的测定中。
本文通过烷基糖苷样品对两种测定方法进行了精密度及准确度试验,验证了检测方法的可靠性,并对还原糖直接滴定法的测定条件进行了探讨,指出了影响测定结果的关键因素,使测试结果更具备可比性,可为采用本文涉及方法进行烷基糖苷体系中残余葡萄糖含量分析测定的人员提供参考。
1 实验
1.1 主要仪器与试剂
仪器:全自动电位滴定仪(T960型,海能未来技术集团股份有限公司);电热鼓风干燥箱(DHG-9240A型,上海一恒科学仪器有限公司);实验室可调电炉(DLL-1型,上海雷韵试验仪器制造有限公司)。
试剂:硫代硫酸钠标准溶液(0.1007mol / L,成都科宏达科技有限公司);五水硫酸铜(纯度为99%,四川西陇科学有限公司);亚甲基蓝(纯度为98.5%,四川西陇科学有限公司);酒石酸钾钠(纯度为99%,四川西陇科学有限公司);氢氧化钠(纯度为96%,四川西陇科学有限公司);正癸醇(纯度为98%,阿拉丁试剂有限公司);亚铁氰化钾(纯度为98.5%,成都科隆化学品有限公司);无水葡萄糖(纯度为99%,四川西陇科学有限公司);碘(纯度为99.5%,四川西陇科学有限公司);碘化钾(纯度为99%,四川西陇科学有限公司)。
实验中所涉及的试剂均采用分析纯试剂,实验用水为去离子水且符合3级实验用水规格。
1.2 溶液配制
(1)碱性酒石酸铜甲液:称取15.0002g 五水硫酸铜和0.0507g亚甲基蓝,用水溶解后定容至1000mL。
(2)碱性酒石酸铜乙液:称取50.0005g 酒石酸钾钠和75.0000g 氢氧化钠,加适量水待完全溶解后,再加入4.0003g亚铁氰化钾,定容至1000mL。
(3)葡萄糖标准溶液(1mg / mL):准确称取1.0000g经100℃烘箱干燥2h的无水葡萄糖样品,溶解后加入5mL 盐酸溶液并用水定容至1000mL。
(4)碘标准溶液:称取13.0002g碘及35.0001g KI,加水溶解后移入棕色试剂瓶中,定容至1000mL。
(5)葡萄糖水溶液(4.95%):使用万分天平准确称取5.0000g经干燥至恒重且含量为99%的无水葡萄糖样品,加水至100.0001g后,分散溶解后备用。
1.3 实验方法
1.3.1 还原糖直接滴定法
碱性酒石酸铜溶液的标定:吸取碱性酒石酸铜甲液及乙液各5mL,加水10mL,两粒玻璃珠,作为实验空白。加入约9mL葡萄糖标准溶液,两分钟内加热至沸后,趁热以2秒/滴的速度进行滴定,蓝色消失即为滴定终点,记录消耗葡萄糖标准溶液的总体积V1。
试样溶液测定:首先进行试样溶液的预滴定,称取m克样品,加水定容至100mL,此为用于滴定的样品溶液。按上述配制实验空白,加热至沸后以先快后慢的速度滴加样品溶液,记录到达滴定终点时消耗样品溶液的体积。正式进行试样溶液测定时,预先滴加比预测体积少1mL的样品溶液,两分钟内加热至沸后以2秒/滴的速度滴定样品溶液,记录所消耗的体积V2。平行测定三次,按下列公式进行葡萄糖含量计算:
(1)
式中:
V1——标定10mL碱性酒石酸铜溶液消耗的葡萄糖标准溶液体积,单位为毫升(mL);
V2——测定时平均消耗试样溶液体积,单位为毫升(mL);
m样——样品的称样质量,单位为克(g)。
1.3.2 碘量法
准确称取约4g样品于250mL碘量瓶中,加入25mL碘标准溶液,边摇动边逐滴加入10mL 1mol/L的氢氧化钠溶液至溶液呈浅黄色,盖好瓶塞封水后置于暗处放置20分钟。再加入5mL 3mol/L的盐酸溶液,立即用硫代硫酸钠标准溶液滴定至溶液呈浅黄色,加入3mL淀粉指示试剂,继续滴定至溶液由蓝色变为无色。平行测定三次,按下列公式进行葡萄糖含量计算:
(2)
式中:
C1——碘标准溶液的浓度,单位为摩尔每升(mol/L);
C2——硫代硫酸钠标准溶液的浓度,单位为摩尔每升(mol/L);
V1——加入碘标准溶液的体积,单位为毫升(mL);
V2——消耗硫代硫酸钠标准溶液的体积,单位为毫升(mL);
M——无水葡萄糖的摩尔质量,单位为克每摩尔(g/mol);
m样——样品的称样质量,单位为克(g)。
2 结果与讨论
2.1 两种检测方法的实验结果
如表1所示,分别采取还原糖直接滴定法和碘量法两种方法对本公司自行合成的烷基糖苷样品(A1)及产于上海发凯化工有限公司的烷基糖苷样品(A2)进行了残余葡萄糖含量的检测,两种检测结果存在较大差异,碘量法的实验测定值要远高于还原糖直接滴定法的测定结果,且其平行测定三次的相对标准偏差也较高。
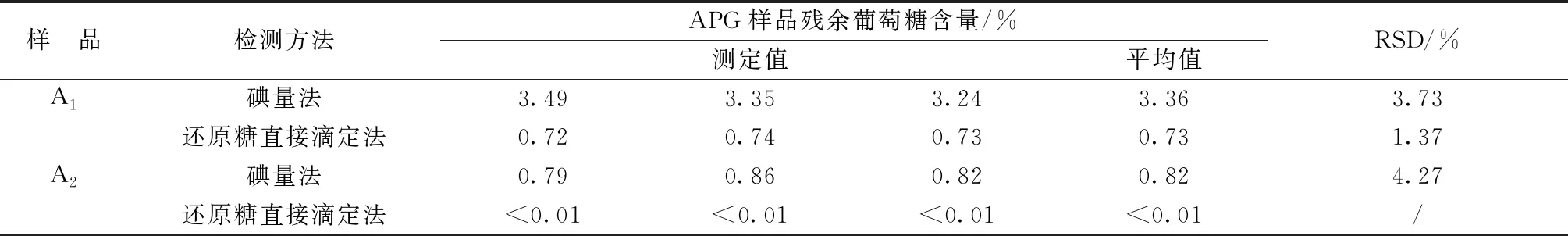
表1 烷基糖苷样品残糖测定方法的精密度试验结果
为进一步验证两种检测方法的准确性及适用性,以A1作为样品,分别对两种检测方法进行了加标回收试验,实验结果如表2所示,直接滴定法的回收率高达97.06%且操作计算简便,适用于烷基糖苷样品残糖含量的测定,碘量法则回收率差,说明碘量法并不适用于烷基糖苷样品中的残余葡萄糖含量的分析。
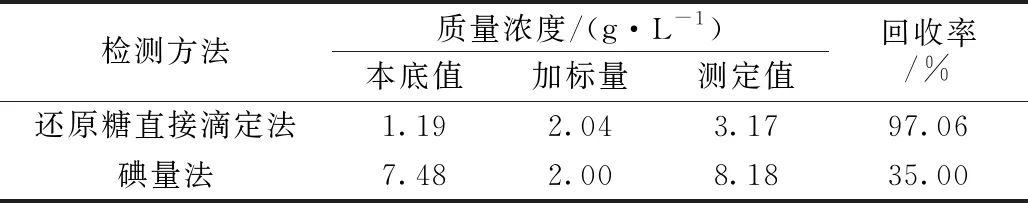
表2 烷基糖苷样品残糖测定加标回收试验结果
2.2 还原糖直接滴定法在APG残糖含量测定中的关键因素分析
2.2.1 消耗试样溶液体积对测定结果的影响
图1a展现了葡萄糖测定含量随还原糖直接滴定法中消耗样液体积的变化过程。本实验样品采用4.95%的葡萄糖溶液,标定碱性酒石酸铜溶液(空白)消耗的葡萄糖标准溶液的体积为10.6mL。从图中可以看出,消耗样液的体积与标定空白实验体积相差越大,结果越不准确,当两者体积差控制在1mL以内时,检测数据更为精准。这是由于样品溶液浓度对实验测定结果的准确性至关重要,当溶液浓度过小时,样液沸腾时间随滴定时间的延长而增大,从而导致耗样量增大,且不断挥发的溶剂也会使结果误差增大;而当溶液浓度过大时,样液消耗量偏大,进而使测定结果偏小。因此,当消耗样液体积与标定碱性酒石酸铜溶液所消耗的葡萄糖标液体积相近时,才能更好地控制滴定时间对测定结果的影响。
2.2.2 分散溶剂对测定结果的影响
对于未除去长链醇的烷基糖苷样品,其水溶性差,故不能用样品溶液直接滴定。而其溶于无水乙醇,因此考察了不同比例下的无水乙醇-水溶液作为分散溶剂时对葡萄糖含量测定的影响。如图1b所示,分散溶剂的变换对使用直接滴定法进行葡萄糖含量的测定并无影响。
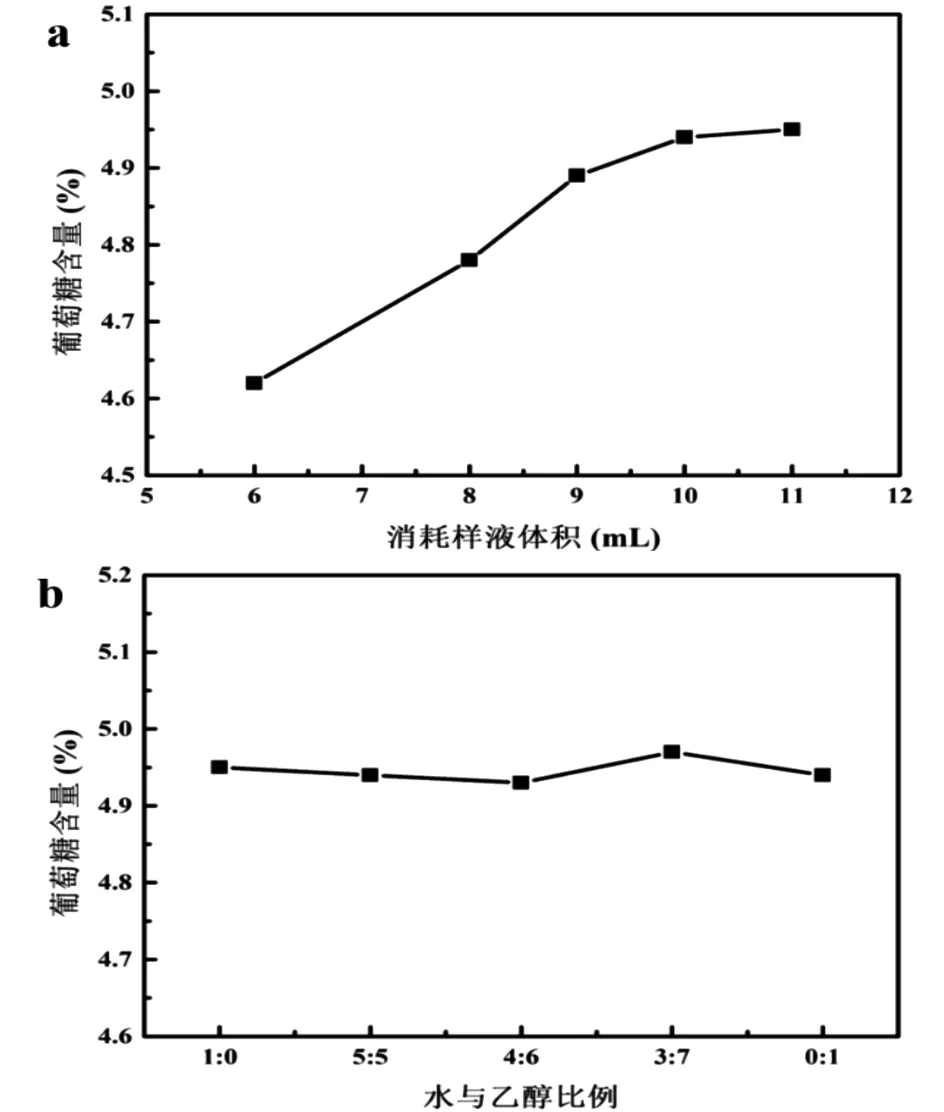
图1 葡萄糖测定含量随不同消耗样液体积及分散溶剂的变化曲线
2.2.3 残醇含量对测定结果的影响
本实验采取在4.95%的葡萄糖溶液样品中添加不同比例的正癸醇进而模拟具有不同残醇含量的烷基糖苷体系。从图2中可以看出还原糖直接滴定法的测定结果随残醇含量的增加基本呈一条平稳的直线,这表明样品中的残醇含量变化对还原糖直接滴定法基本不存在影响。这可能是由于还原糖直接滴定法以次甲基蓝为指示剂,指示剂颜色呈无色或亮黄色时为滴定终点,通过观察指示剂颜色变化即可判断滴定终点,因此正癸醇的存在对还原糖直接滴定法影响不大。
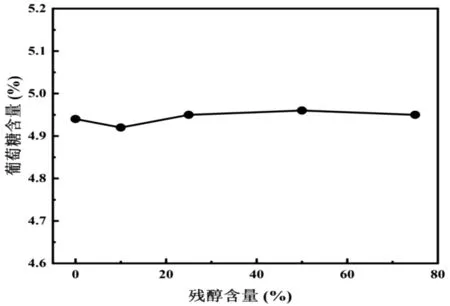
图2 还原糖滴定法测定结果随样品体系中残醇含量的变化过程
2.2.4 其他因素对测定结果的影响
为避免实验过程中次甲基蓝被空气氧化,整个实验必须在沸腾状态下进行且滴定过程中勿摇晃锥形瓶或使锥形瓶离开热源从而引入空气,使测定结果偏小。另外由于沸腾时间不同,反应液蒸发的速度也不同,样品测定的平行性会受到影响,所以须控制在2min内将锥形瓶内液体加热至沸腾。
3 结论
本文将食品中还原糖直接滴定法和碘量法两种方法引入烷基糖苷样品的残余葡萄糖含量测定中,通过相同的烷基糖苷样品验证了两种检测方法的差异性,并对还原糖直接滴定法在烷基糖苷样品中的检测条件进行了探讨。经上述分析与讨论,碘量法操作步骤繁多,更易产生测定误差且回收率差,并不适用于烷基糖苷样品中的残糖测定。还原糖直接滴定法则操作简便且容易控制操作过程对结果准确性的影响,更适用于烷基糖苷样品中残糖含量的分析。本论文的研究对于烷基糖苷体系中残余葡萄糖含量的快速分析测定方面具有一定的参考价值。
