虎杖中蒽醌类和二苯乙烯类成分闪式提取工艺优化
2021-12-15黄湘杰
朱 芹,黄湘杰
(1. 湖南省湘潭市食品药品检验所,湖南 湘潭 411000; 2. 湖南省湘乡市人民医院药剂科,湖南 湘潭 411400)
虎杖源于蓼科植物虎杖 Polygonum cuspidatum Sieb.Et Zucc. 的干燥根茎和根,又名红三七,始载于《本草纲目》[1],我国资源量大,具有利湿退黄、止咳化痰、散瘀止痛功效,临床常用于治疗湿热黄疸、风湿痹痛、水火烫伤、跌打损伤、肺热咳嗽等症[2]。虎杖含有二苯乙烯类、蒽醌类、黄酮类等多种活性成分,前2 种活性成分具有抗病毒、抗肿瘤、抗炎、调节代谢等多种药理学作用。2020 年版《中国药典(一部)》中虎杖的含量测定指标性成分为大黄素和虎杖苷,大黄素和大黄素甲醚属蒽醌类,白藜芦醇和虎杖苷属二苯乙烯类[3-5]。目前,虎杖有效成分的提取方式主要有煎煮法、酶解法、超声提取法[6-7]等,均存在耗时长、操作烦琐等缺点,且二苯乙烯类成分遇热不稳定,易降解[8]。闪式提取法在室温下利用超动分子渗透技术和高速剪切力,快速、高效地将中药材粉碎,并使有效成分迅速溶解平衡,达到高效提取目的[9-10];Plackett-Burman(PB)试验可快速、有效地筛选出最明显的关键影响因素[11],Box - Behnken Design(BBD)响应面法可解决非线性数据问题。本研究中采用闪式提取法提取虎杖的有效成分,通过PB 试验筛选出显著影响因素,采用BBD 响应面法优化虎杖中蒽醌类和二苯乙烯类成分的最佳提取工艺,为进一步开发虎杖的药用价值奠定基础。现报道如下。
1 仪器与试药
1.1 仪器
E2695 型高效液相色谱仪(美国 Waters 公司),配有四元超高压溶剂系统、2695 型自动进样器、2998 PDA 型二极管阵列检测器、Empower3 型色谱工作站;AUW-220D型电子天平(日本岛津公司,精度为0.01 mg);JHBE-50C 型闪式提取器(西安麒麟实验仪器有限公司,功率为 3 000 W,转速为 10 000 r/min);Milli- QAcademic 型超纯水系统(美国密理博公司)。
1.2 试药
大黄素对照品(批号为110756-201912,含量为98.9%),大黄素甲醚对照品(批号为 110758-201817,含量为99.5%),虎杖苷对照品(批号为 11575-201803,含量为 89.5% ),白藜芦醇对照品(批号为 111535 -201903,含量为99.3%),均购自中国食品药品检定研究院;虎杖药材购自河北省安国中药材专业市场,经湖北省食品药品研究院蔡波主任药师鉴定为正品;乙腈、甲醇均为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 提取工艺
取干燥的虎杖药材适量,粉碎,过4 号筛,取粉末50 g,精密称定,投入闪式提取器中,设置仪器参数,加入溶剂适量,充分提取,提取液减压浓缩至近干,真空干燥,得药材浸膏粉末。
2.2 虎杖 4 种指标性成分含量测定[12-14]
2.2.1 色谱条件
色谱柱:WatersXterraC18柱(250mm×4.6mm,5μm);流动相:乙腈(A)-0.18% 磷酸水溶液(B),梯度洗脱(0 ~ 9 min 时 11%A,9 ~ 25 min 时 11%A→45%A,25 ~35 min 时 45%A→66%A,35 ~48 min 时 66%A→82%A,48 ~ 60 min 时 82%A→10%A);流速:1.0 mL /min;检测波长:254 nm(大黄素和大黄素甲醚),303 nm(白藜芦醇和虎杖苷);柱温:28 ℃;进样量:10 μL。
2.2.2 溶液制备
取大黄素、大黄素甲醚、白藜芦醇和虎杖苷对照品各适量,精密称定,以甲醇为溶剂配制质量浓度分别为0.102 3,0.241 5,0.337 8,0.516 9 mg /mL 的混合对照品溶液,经 0.45 μm 微孔滤膜滤过,取续滤液,备用。取2.1 项下制备的浸膏粉末 1.0 g,精密称定,置 100 mL 棕色容量瓶中,加75%乙醇溶解并定容,摇匀,经0.45 μm 微孔滤膜滤过,取续滤液,即得供试品溶液。
2.2.3 方法学考察
线性关系考察与定量限确定:分别精密吸取2.2.2项下混合对照品溶液 2,5,10,15,20,25 μL,按 2.2.1项下色谱条件进样测定。以混合对照品溶液进样量(X,μg)为横坐标、峰面积(Y)为纵坐标进行线性回归,绘制标准曲线。结果大黄素、大黄素甲醚、白藜芦醇和虎杖苷的回归方程分别为 Y1=101.18 X1-22.73(r1=0.999 6),Y2= 68.65 X2+ 19.36(r2= 0.999 5),Y3=94.24X3-18.19(r3=0.999 7),Y4=70.16 X4+9.83(r4=0.9998),线性范围分别为 0.2046 ~2.5580μg、0.483 0 ~6.037 0 μg、0.675 6 ~ 8.445 0 μg、1.034 0 ~12.920 0 μg。表明大黄素、大黄素甲醚、白藜芦醇、虎杖苷在各自线性范围内与峰面积线性关系良好。精密量取2.2.2 项下混合对照品溶液各适量,用甲醇倍比稀释,按2.2.1 项下色谱条件进样分析,取峰面积信噪比( S / N)为 10 ∶1 时混合对照品溶液的进样量为定量限,结果定量限分别为1.76,3.28,6.44,9.20 ng。
稳定性试验:取 2.2.2 项下供试品溶液,分别于0,6,12,15,20,24 h 时按 2.2.1 项下色谱条件进样测定,记录峰面积。结果大黄素、大黄素甲醚、白藜芦醇、虎杖苷峰面积的 RSD 分别为 0.88% ,1.03% ,0.91% ,0.96%(n = 6),表明供试品溶液在室温下 24 h 内稳定。
精密度试验:精密量取2.2.2 项下混合对照品溶液,按2.2.1 项下色谱条件连续进样测定6 次,记录峰面积。结果大黄素、大黄素甲醚、白藜芦醇和虎杖苷峰面积的 RSD 分别为 0.67% ,0.54% ,0.73% ,0.49%(n =6),表明仪器精密度良好。
加样回收试验:取2.1 项下已知含量的虎杖浸膏粉适量,精密称定,共 6 份,分别精密加入 2.2.2 项下混合对照品溶液 2.0 mL,依法制备供试品溶液,按 2.2.1 项下色谱条件进样测定,记录峰面积,并计算回收率。结果大黄素、大黄素甲醚、白藜芦醇、虎杖苷的平均回收率分别为 99.89% ,99.12%,99.65%,99.71%,RSD 分别为0.71% ,0.89% ,1.01%,0.97% (n =6),表明方法准确可靠。
2.3 PB 试验筛选主要影响因素
PB 试验设计:按PB 试验设计表设置仪器参数,采用Design Expert 8.0.5 软件拟合影响大黄素、大黄素甲醚、白藜芦醇、虎杖苷提取率的二次回归方程,作出相互作用影响4 种有效成分提取率的3D 响应面图和2D 等高线图,并预测4 种有效成分提取率的最大理论值。选定的6 个影响因素为乙醇体积分数(因素A,%),提取次数(因素 B,次),液料比(因素 C,mL /g),药材粒度(因素 D),提取时间(因素 E,min),提取温度(因素F,℃),PB 试验设计因素水平见表 1。
结果与分析:取12 份虎杖药材,各100 g,置闪式提取器中,按表1 的试验设计快速提取,并测定大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率。结果见表2。由表3 可知,模型显著;各因素对大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率影响的显著性顺序依次为提取时间(E) > 料液比(C) > 乙醇体积分数(A) > 提取次数(B) > 药材粒度(D) > 提取温度(F)。其中,对蒽醌类成分和二苯乙烯类成分提取率影响较显著的因素为因素A,C,E,故上述3 个关键因素进行响应面优化和设计。

表1 PB 试验设计因素水平表Tab.1 Factors and levels of the PB test

表2 PB 试验设计及结果Tab.2 Design and results of the PB test
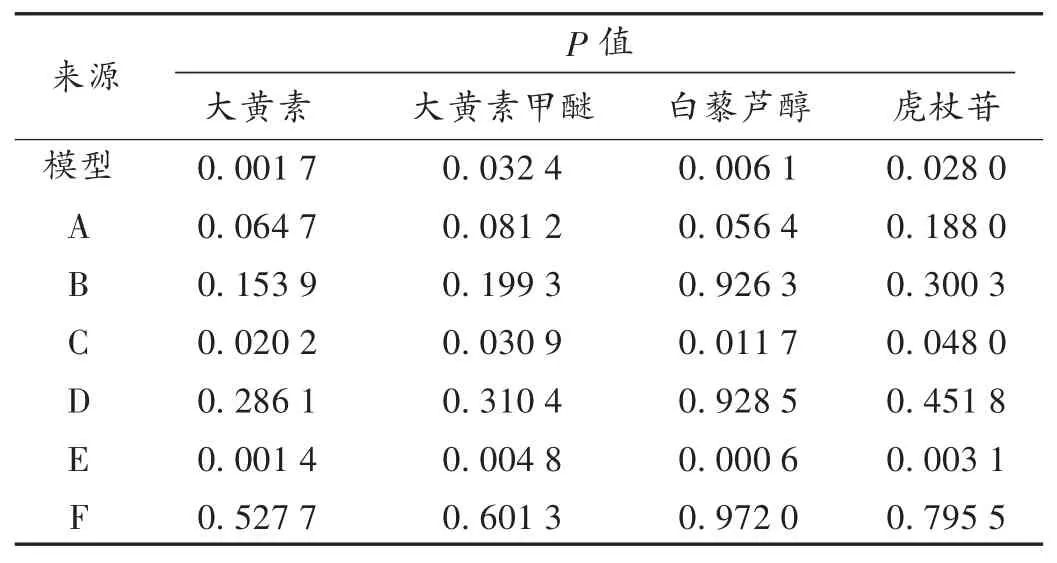
表3 PB 试验设计各因素水平显著性分析Tab.3 Significance analysis of each factor level according to the PB test
2.4 最陡爬坡试验设计及结果
本研究中采用提取时间(步长设为2 min)、液料比(步长设为 10 mL /g)、乙醇体积分数(步长设为 5%)3 个自变量设置正向爬坡模式,以大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率为观察值寻求最优参数值。结果见表4。
由表4 可知,第4 次试验时,大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率最大,分别为6.762,4.095,8.095,12.888 mg/g,即提取参数为液料比 40 mL /g,提取12 min,乙醇体积分数65%。

表4 最陡爬坡试验设计与结果Tab.4 Design and results of the steepest ascent test
2.5 BBD 响应面法优化试验
2.5.1 BBD 响应面法设计
BBD 响应面法采用多元二次回归方程模型预测各拟合响应值与最优因素间的试验条件及数理函数关系[15]。根据最陡爬坡试验结果,并结合BBD 响应面法原理,以乙醇体积分数(因素A)、液料比(因素C)、提取时间(因素E)为考察因素,以虎杖提取物中大黄素、大黄素甲醚、白藜芦醇、虎杖苷提取率的加权评分(OD)值为评价指标,运用Design Expert 8.0.5 统计学软件,设计虎杖提取工艺三因素三水平响应面分析模型,对二次多项方程进行显著性分析。BBD 响应面法设计因素水平见表5。

表5 BBD 响应面法设计因素水平表Tab.5 Factors and levels of BBD response surface method
2.5.2 回归模型的建立及分析
采用2.2.1 项下方法测定17 组试验大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率,根据Hassan 法计算各试验4 个指标性成分的 OD 值,并对模型进行综合分析。结果见表6 至表7。

表6 BBD 响应面法设计与结果Tab.6 Design and results of the BBD response surface method
采用 Design Expert 8.0.5 统计学软件进行方差分析,得二次多项回归方程 Y =0.75 + 0.22 A + 0.33 C +0.021E +0.028AC +0.076AE -0.008 255CE -0.24A2-0.052 C2- 0.16 E2。式中,因变量为大黄素、大黄素甲醚、白藜芦醇和虎杖苷提取率 OD 值,因素A,C,E 分别为自变量乙醇体积分数、液料比及提取时间。综合评价OD 值的相关系数 R2= 0.992 8,数学模型拟合良好。由表 7 可知,所建立模型有意义(P< 0.01),表明模型拟合度高,预测性较好。因素A 和因素C 对模型影响均显著。模型验证得大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率预测值分别为 6.902,5.158,9.799,13.890 mg /g。

表7 BBD 响应面法设计方差分析结果Tab.7 Results of ANOVA of the BBD response surface method
2.5.3 BBD 响应面法分析与最佳工艺确定
采用 Design Expert 8.0.5 软件,绘制影响 OD 值的各因素相互作用的3D 响应面图和2D 等高线图。由图1可知,曲线面升降变化均较明显,因素A,C,E 之间显著交互。最佳提取工艺条件为,乙醇体积分数68%,液料比35 mL/g,提取10 min。取虎杖药材3 份,按最佳提取工艺提取,实测大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率分别为 6.867,5.127,9.736,13.850 mg/g,RSD 分别为 0.41% ,0.63% ,0.71% ,0.58% (n =3),预测值和实则值偏差分别为 0.25%,0.30%,0.32%,0.14%。

图1 各因素交互作用的3D 响应面图和2D 等高线图Fig.1 3D response surface plot and 2D contour plot of the interaction of various factors
3 讨论
由图1 可知,提取时间显著影响 OD 值,在各曲线图中均是先低后高,而乙醇体积分数和液料比曲线面随自变量增加呈上升趋势。预测值与实测值偏差较小,表明理论模型预测较准确,优选提取工艺可行。
曾考察影响大黄素、大黄素甲醚、白藜芦醇、虎杖苷提取率综合评价指标相互作用的三因素(乙醇体积分数、提取时间、液料比),通过PB 试验联合BBD 响应面法进行试验设计,采用Design Expert 8.0.5 统计学软件拟合二次多项方程,采用方差分析拟合程度,推导最佳提取工艺条件,并预测大黄素、大黄素甲醚、白藜芦醇、虎杖苷的提取率。由含量测定方法学考察结果可知,方法准确可靠,精密度、稳定性均较好,可准确测定虎杖中蒽醌类和二苯乙烯类成分的含量;由提取工艺优化结果可知,液料比对提取率影响较大,乙醇体积分数为68 %,液料比为35 mL/g,提取时间为10 min,基本可将蒽醌类有效成分提取完全,可为虎杖中蒽醌类和二苯乙烯类成分的提取提供参考。
