非洲爪蟾驱动蛋白样蛋白2靶蛋白对非小细胞肺癌细胞迁移侵袭的影响及其机制
2021-12-15刘雷施民新陆海敏王伟
刘雷,施民新,陆海敏,王伟
目前,非小细胞肺癌的治疗方法不断取得进步,但非小细胞肺癌的疗效依然不理想。术后复发和转移是引起非小细胞肺癌疗效不佳的主要原因。非小细胞肺癌的复发和转移除了与临床病理分期相关外,还涉及多种基因的变化。
在前期研究中,本课题组挖掘出一个在非小细胞肺癌中高表达并对预后判断有指导意义的基因非洲爪蟾驱动蛋白样蛋白2 靶蛋白(TPX2)。TPX2是一个与中心体密切相关的蛋白,在肿瘤细胞染色体20q 经常出现基因的扩增。此外,TPX2 也是一个微管相关蛋白,主要在细胞着丝粒处负责微管的组装和形成。既往研究发现TPX2 在肾母细胞瘤和胃癌组织中均呈高表达水平,其过表达常提示预后不良。TPX2 可以通过激活Akt 信号通路进而促进胶质瘤细胞的增殖和迁移。鉴于TPX2基因作为一种促癌基因,其在非小细胞肺癌中高表达,且与病人预后密切相关。然而,其在非小细胞肺癌中的生物学功能还未详细阐明。因此,本研究于2018年10月至2019年8月通过抑制TPX2 表达,观察其对非小细胞肺癌细胞的迁移侵袭性及可能相互作用蛋白之间的影响,以明确TPX2 在非小细胞肺癌发展过程中的生物学功能及可能的分子机制。
1 材料与方法
1.1 材料
RPMI 1640 培养液及新生牛血清购自杭州吉诺生物医药有限公司。蛋白裂解提取试剂和BCA 蛋白浓度测定试剂盒购自美国Pierce 公司。逆录试剂盒和Gotaq 酶购自美国promega 公司。Trizol试剂、Lipofectamin 3000脂质体转染试剂、人胆囊收缩素/缩胆囊素八肽(CCK-8)试剂盒购自美国invitrigen 公司。Transwell 培养板购自Corning 公司。TPX2、PI3K p85 抗体购自Abcam 公司。基质金属蛋白酶9(MMP9)、基质金属蛋白酶12(MMP12)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)、内参甘油醛-3-磷酸脱氢酶(GAPDH)抗体及二抗购自Santa Cruz 公司。激活剂胰岛素生长样因子1(IGF-1)购自R&D System。非小细胞肺癌细胞A549 和H1299购自上海奥陆生物科技有限公司。1.2 细胞培养
将细胞接种至含10% 胎牛血清和1% 双抗的RMI 1640 培养基中,置于37 ℃,5% 二氧化碳培养箱中培养,待细胞融合度达70%~80% 时,消化收集细胞用作后续实验。1.3 细胞转染及分组
由上海吉玛公司合成一对针对TPX2 基因的小干扰RNA(siRNA)和一对非特异性阴性对照的siRNA。前者序列:正向引物5’-UGCAGCAAGAGGUGGUGGATT-3’,反向引物3’-TTACGUCGUUCUCCACCACCU-5’;后者序列:正向引物5’-UUCUCCGAACGUGUCACGUTT-3’,反向引物3’-ACGUGACACGUUCGGAGAATT-5’。于转染前24 h,取对数生长期的非小细胞肺癌细胞A549和H1299分别接种于6 孔板中,使转染实验时细胞融合度达到70%。用Lipofectamine3000 将siRNA 转入细胞。实验分为三组:(1)空白对照组:未经转染的细胞;(2)阴性对照组:转染非特异性的siRNA 的细胞;(3)siRNA-TPX2 组:转染TPX2 特异性的siRNA的细胞。每组3个孔。1.4 实时荧光定量逆转录聚合酶链反应(qRTPCR)检测TPX2 mRNA 的表达
用Trizol 法提取细胞总RNA,逆转录为互补DNA(cDNA)后进行qRT-PCR 反应。 TPX2 引物序列为:正向’-ATGGAACTGGAGGGCTTTTTC,反向’-TGTTGTCAACTGGTTTCAAAGGT,内参GAPDH 引物序列为:正向’-GACATCAAGAAGGTGGTGAA,反向’-TGTCATACCAGGAAATGAGC。反应条件为:95 ℃预变性10 min,94 ℃15 s,58 ℃退火15 s,72 ℃延伸30 s,共40个循环。每个样本设置3个复孔,以GAPDH 为内参,采用2法计算TPX2 mRNA表达量。1.5 蛋白质印迹法(Western blotting)检测蛋白表达
收集细胞,加入细胞裂解液,抽提蛋白后用BCA 法测定蛋白浓度。取50 μg 蛋白样品进行电泳,电泳结束后转膜,室温封闭1.5 h,加入一抗(1∶100 稀释),同时以GAPDH(1∶5000 稀释)为内参,4 ℃孵育过夜。用等渗缓冲盐溶液(TBST)洗膜3次,加入辣根过氧化物酶(HRP)标记的二抗(1∶5000 稀释)室温孵育1 h,再用TBST 洗膜3 次。用凝胶成像系统进行显影。1.6 CCK-8法检测细胞增殖
各组细胞以1.0×10/mL 的密度接种于96 孔板,将培养板在培养箱分别孵育24、48、72 h,并在每个时间点加入10 μL CCK-8溶液,置37C 培养箱内孵育4 h。用酶标仪测定450 nm波长下各孔的吸光度。每组3个复孔。1.7 细胞迁移实验
将Transwell 小室套于24 孔板上。取细胞悬液100 μL(含1×10个细胞)加入Transwell 小室上室中,下室中加入500 μL 含血清的RPMI 1640 培养液。在37 ℃培养箱温育36 h,用棉签去除小室上层细胞,用结晶紫溶液室温下染色后以磷酸缓冲盐溶液(PBS)浸洗。显微镜100 倍视野下计数移至微孔膜下层的细胞数目,每个样本随机选择5个视野计数后取均值。1.8 细胞侵袭实验
将人工合成的基底膜材料Matrigel 胶用无血清培养液稀释(体积1∶8)后,取60 μL 加于每个小室的膜上,4 ℃风干干燥。取细胞悬液100 μL(含1×10个细胞)加入Transwell小室上室中,下室中加入500 μL 含血清的RPMI 1640 培养液。37 ℃培养48 h。用棉签擦去Matrigel 胶后,在室温下用结晶紫溶液染色并用PBS浸洗。显微镜观测计数同上。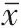
2 结果
2.1 siRNA 干扰TPX2 对TPX2 的抑制作用
为了验证干扰效果,本研究检测了转染siRNA-TPX2 后,A549 和H1299 细胞中TPX2 的mRNA 和蛋白表达情况。qRT-PCR 结果表明,与空白对照组及阴性对照组相比,转染siRNA-TPX2后,A549和H1299细胞中TPX2的mRNA 表达显著降低(P
<0.05),而空白对照组与阴性对照组间差异无统计学意义(P
>0.05)。同时,蛋白质印迹法结果表明,siRNA-TPX2 显著降低A549和H1299细胞中TPX2蛋白的表达。见表1。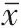
表1 各组非小细胞肺癌A549、H1299细胞中TPX2(非洲爪蟾驱动蛋白样蛋白2靶蛋白)mRNA和蛋白相对表达量比较/±s
2.2 敲低TPX2 抑制非小细胞肺癌细胞增殖
CCK-8 细胞增殖实验检测转染siRNA-TPX2 后,A549 和H1299 细胞的增殖能力变化情况。结果表明,与阴性对照组相比,TPX2 敲低可以显著抑制A549和H1299细胞的增殖能力(P
<0.05),见表2。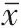
表2 各组非小细胞肺癌A549、H1299细胞不同时间点吸光度(增殖能力)的比较/±s
2.3 敲低TPX2 抑制非小细胞肺癌细胞的迁移和侵袭
为了评估TPX2敲低对A549细胞和H1299细胞的迁移和侵袭的影响,本研究通过Tanswell 小室实验的方法检测转染siRNA-TPX2 后,A549 细胞和H1299 细胞的迁移和侵袭能力。与阴性对照组相比,转染siRNA-TPX2 后的A549 细胞和H1299 细胞的迁移和侵袭能力受到显著抑制(P
<0.05),见表3。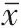
表3 各组非小细胞肺癌A549、H1299细胞迁移和侵袭细胞数比较/(个,±s)
2.4 敲低TPX2 对PI3K/Akt 信号通路活性及侵袭相关分子MMPs 的影响
为进一步研究TPX2 促进非小细胞肺癌细胞侵袭转移的可能分子机制,本研究通过蛋白质印迹法检测转染siRNA-TPX2 后,A549 和H1299 细胞中肿瘤侵袭相关分子MMP9 和MMP12 及PI3K/Akt 信号通路中的关键分子PI3K、Akt、p-Akt 的表达变化情况。蛋白质印迹法的结果显示,与阴性对照组相比,siRNA-TPX2 组A549 和H1299 细胞中MMP9 和MMP12 表达均显著减少(P
<0.05)。同时,siRNA-TPX2 组A549 和H1299 细胞中的PI3K 及p-Akt 的蛋白表达显著减少(P
<0.05),Akt蛋白无明显变化(P
>0.05)。见表4。这些结果表明,TPX2可能通过激活PI3K/Akt信号通路及其下游的肿瘤侵袭相关分子MMP9 和MMP12 促进非小细胞肺癌细胞侵袭能力。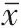
表4 各组非小细胞肺癌A549、H1299细胞中基质金属蛋白酶9(MMP9)、基质金属蛋白酶12(MMP12)、磷酸化蛋白激酶B(p-Akt)、蛋白激酶B(Akt)和磷脂酰肌醇3激酶(PI3K)蛋白相对表达量比较/±s
为进一步验证TPX2 主要是通过PI3K/Akt 信号通路调控MMP9 和MMP12 表达水平,在TPX2 被干扰的细胞中,本研究用PI3K/Akt 信号通路激动剂IGF-1 激活PI3K/Akt 信号通路。发现经IGF-1(150 mg/L)处理后,能完全削弱TPX2-siRNA抑制A549和H1299 细胞中PI3K/Akt 信号通路活性及其下游MMP9 和MMP12 的表达,见表5。这提示TPX2 调控PI3K/Akt 信号通路活性及其下游MMP9 和MMP12的表达机制是TPX2 促进非小细胞肺癌细胞侵袭转移的重要机制。
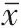
表5 各组非小细胞肺癌A549、H1299细胞中基质金属蛋白酶9(MMP9)、基质金属蛋白酶12(MMP12)、磷酸化蛋白激酶B(p-Akt)和磷脂酰肌醇3激酶(PI3K)蛋白相对表达量比较/±s
3 讨论
TPX2蛋白为一种微管相关蛋白,由位于人类染色体20q11.1 中的基因编码,主要参与纺锤体形成和微管成核。最初由Heidebrecht 于1977年鉴定发现,并被揭示为与增殖相关的核蛋白。目前,更多研究探讨了TPX2 与肿瘤发生发展之间的关系。TPX2的过表达与宫颈癌、食管鳞癌和胰腺癌等多种恶性肿瘤的发展密切相关。本课题组先前的研究也发现TPX2 在非小细胞肺癌组织中高表达,并且TPX2 高表达是非小细胞肺癌病人预后不良独立的风险因素。Schneider 等研究发现,TPX2 基因在非小细胞肺癌中存在过表达,同时TPX2 的表达可作为预测非小细胞肺癌预后的重要工具。这些研究结果表明,TPX2可以作为一个致癌基因参与非小细胞肺癌的发展。然而,TPX2在非小细胞肺癌发展中所发挥的生物学功能目前尚不明确。本研究通过采用RNAi 技术,实验验证结果表明A549 和H1299 细胞内源性TPX2 基因受抑制,成功构建了TPX2 siRNA 细胞模型,为进一步阐明TPX2 在非小细胞肺癌中的功能提供理想的研究平台。
近年来,不少研究发现TPX2 的过表达促进了人类不同恶性肿瘤的生长和转移,TPX2的表达水平与肿瘤恶性程度,远处转移和术后复发密切相关。过量表达TPX2 可导致DNA 非整倍性和多倍体,TPX2的异常表达可抑制正常有丝分裂并导致癌变。RNA 干扰介导的TPX2 下调可抑制胰腺癌Sw480 细胞和Hela 细胞的生长和侵袭能力。同时,下调TPX2 的表达能显著抑制接种肝癌细胞的免疫缺陷的小鼠肿瘤的增殖能力。这些研究结果充分表明敲低TPX2 的表达能抑制肿瘤的增殖。本研究显示,降低TPX2 的表达能显著抑制A549 和H1299 细胞的增殖能力。Tanswell 小室实验结果提示转染TPX2-siRNA 组穿膜细胞数显著减少,表明抑制TPX2 基因的表达能引起非小细胞肺癌细胞浸润转移能力下降。这些结果表明TPX2 可以作为非小细胞肺癌潜在的抗肿瘤靶点。
本研究发现通过siRNA 下调TPX2 的表达能引起A549 和H1299 细胞中MMP9 和MMP12 蛋白表达受到抑制。MMP9 和MMP12 可作为非小细胞肺癌侵袭转移过程中的重要因子。这些研究结果表明TPX2 可能通过调节MMP9 和MMP12 的表达进而促进非小细胞肺癌的侵袭转移。最近,一些研究表明PI3K/Akt 信号通路在上调MMP 表达中发挥重要作用。异常Akt 信号通路可抑制非小细胞肺癌细胞凋亡,促进细胞增殖。此外,有报道称Akt信号通路可通过促进MMP2 和MMP9 的表达,在非小细胞肺癌细胞侵袭和转移中发挥关键作用。TPX2 通过激活Akt 信号通路调节MMP2 促进胶质瘤细胞增殖和侵袭。在肝细胞肝癌中,TPX2 表达与MMP2 和MMP9 呈正相关,体外研究发现TPX2 敲低显著减低细胞侵袭和迁移能力,并降低MHCC-97H 细胞中磷酸化的Akt,MMP2 和MMP9 表达。至于非小细胞肺癌中,本研究发现TPX2 表达下调后,PI3K/Akt 信号通路中的PI3K、p-Akt 表达明显受到抑制,而使用激动剂IGF-1 激活PI3K/Akt 信号通路后,其下游的侵袭相关分子MMP9 和MMP12 的抑制效应明显消除。这些研究结果表明TPX2 也可能是通过PI3K/Akt信号通路调节MMPs的表达影响非小细胞肺癌细胞的侵袭和转移。
综上所述,TPX2表达下调可抑制非小细胞肺癌A549 和H1299 细胞增殖、迁移及侵袭能力。TPX2调控PI3K/Akt 信号通路活性及其下游MMP9 和MMP12的表达机制是TPX2促进非小细胞肺癌细胞侵袭转移的重要机制。
