微小RNA-374a靶向脾酪氨酸激酶对卵巢癌细胞放射敏感性及迁移、侵袭的影响
2021-12-15李娜荣金凤徐艳
李娜,荣金凤,徐艳
卵巢癌是威胁女性健康的恶性肿瘤之一,其早期发病较为隐匿且极易出现扩散及转移,调查显示卵巢癌病人5年生存率较低。目前临床采用手术结合放化疗等手段治疗卵巢癌,但肿瘤细胞对放射治疗极易产生耐受性而降低治疗效果。因而如何提高肿瘤细胞放射敏感性成为重点研究问题。miRNA 异常表达可通过诱导细胞凋亡而增强肿瘤细胞放射敏感性。因而积极寻找与卵巢癌发生及转移相关的分子靶点对提高细胞放射敏感性具有重要意义。研究表明微小RNA-374a(miR-374a)在卵巢癌中上调表达并可降低细胞对顺铂的敏感性。但miR-374a对卵巢癌放射敏感性的影响尚未可知。TargetScan预测显示脾酪氨酸激酶(spleen tyrosine kinase,Syk)可能是miR-374a 的靶基因,研究表明Syk 低表达与卵巢癌病人临床病理特征相关。本研究探讨miR-374a 对卵巢癌细胞迁移及侵袭的影响及其与放射敏感性的关系,初步分析miR-374a 对Syk 的靶向调控作用,试图阐明miR-374a 在卵巢癌发展及治疗中的作用机制,旨在为卵巢癌放射治疗提供新方向。
1 资料与方法
1.1 一般资料
以2017年2月至2018年1月在宜宾市第二人民医院接受治疗的63 例卵巢癌病人为研究对象,所有病人均接受手术切除治疗。以卵巢癌癌旁组织为对照,术中切除卵巢癌组织及癌旁组织,病人年龄(65.85±3.87)岁,范围为50~70 岁。本研究符合《世界医学协会赫尔辛基宣言》相关要求,入组病人知情且签署同意书。1.2 材料与试剂
卵巢癌A2780 细胞购自美国ATCC 公司。Trizol 试剂购自北京嘉美纽诺生物科技有限公司;蛋白提取试剂盒购自上海贝博生物科技有限公司;miR-374a特异性寡核苷酸抑制剂(antimiR-374a)及阴性对照(anti-miR-NC)、Syk 小干扰RNA(si-Syk)与阴性对照si-NC 均购自广州锐博生物科技有限公司;Lipofectamine2000 购自美国Thermo Fisher 公司;Transwell 小室与Matrigel 基质胶均购自美国BD公司;噻唑蓝(MTT)细胞增殖检测试剂盒购自上海基尔顿生物科技有限公司;兔抗人细胞周期蛋白1(cyclin D1)、细胞周期依赖性蛋白激酶抑制因子1A(cell cycle dependent protein kinase inhibitor 1A,P21)、基质金属蛋白酶-2(MMP-2)抗体购自美国Cell Signaling Technology 公司;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)购自上海碧云天生物技术有限公司;上皮钙黏素(E-cadherin)抗体购自美国R&D Systems 公司;逆转录试剂盒与实时荧光定量PCR试剂盒购自美国Sigma公司。1.3 方法
1.3.1
实验处理与分组 A2780细胞在含10%胎牛血清的DMEM 培养基中培养。培养箱环境条件为37 ℃、5% 二氧化碳体积分数、相对湿度95%。细胞80% 融合时进行传代培养。收集对数生长期细胞进行转染,以随机数字表法分成anti-miR-NC 组(细胞中转染anti-miR-NC)、anti-miR-374a 组(细胞中转染anti-miR-374a)、anti-miR-374a+si-NC 组(细胞中共转染anti-miR-374a 与si-NC)、anti-miR-374a+si-Syk 组(细胞中共转染anti-miR-374a 与si-Syk),转染步骤参照Lipofectamine2000 说明书。收集转染48 h细胞进行后续实验。1.3.2
实时荧光定量逆转录聚合酶链反应(qRTPCR)检测miR-374a 表达 取冻存卵巢癌及癌旁组织冰上溶解,分别加入Trizol 试剂提取总RNA(各组卵巢癌A2780 细胞复苏后加入Trizol 试剂),利用Nanodrop2000c 超微量分光光度计检测RNA 浓度,加入无核糖核酸酶水稀释RNA(50 mg/L),参照逆转录试剂盒合成互补DNA(cDNA),据SYBR® Premix Ex Taq™Ⅱ试剂盒配置反应体系进行qRT-PCR。2算法计算miR-374a相对表达量。1.3.3
MTT 法检测细胞增殖 取对数生长期A2780细胞接种于96孔板(3×10个/孔),分别于转染24 h、48 h、72 h 时向各孔添加20 μL MTT 溶液,孵育4 h后,弃上清,依次150 μL 二甲基亚砜,低速振荡至结晶溶解。酶标仪检测490 nm处各孔吸光度。1.3.4
Transwell 实验检测细胞迁移与侵袭 侵袭实验:将稀释的Matrigel平铺于上室,置于37 ℃恒温培养箱孵育5 h,取各组A2780 细胞接种于上室(5×10个/孔),取600 μL含血清培养液接种下室。孵育24 h后,多聚甲醛固侵袭细胞,结晶紫染液染色。显微镜下计数侵袭细胞数。以未经Matrigel 基质胶包裹的小室进行迁移实验,其余步骤参考侵袭实验。1.3.5
克隆形成实验检测细胞敏感性 anti-miRNC 组、anti-miR-374a 组、anti-miR-374a+si-NC 组、anti-miR-374a+si-Syk 组细胞经0、2、4、6、8 Gy 照射剂量射线照射(剂量率0.36 Gy/min),收集放射处理的细胞,0.25% 胰蛋白酶消化细胞,计数后接种于24孔培养皿中(3×10个/毫升),分别加入DMEM 培养基,置于37 ℃恒温培养箱内培养10~15 d,弃培养液,磷酸盐缓冲盐溶液(PBS)洗涤,甲醇固定后进行结晶紫染色。计算细胞存活分数,参照单击多靶模型计算细胞放射增敏比。1.3.6
双荧光素酶报告基因实验 将含有结合位点Syk 的3’非翻译区(UTR)序列及突变位点的Syk的3’UTR 序列别插入pGL3 载体分别构建成WTSyk、MUT-Syk 重组载体,分别将重组载体与miR-374a mimics、miR-NC 共转染至卵巢癌A2780 细胞,实验分组分成miR-NC 组(WT-Syk)、miR-374a 组(WT-Syk)、miR-NC 组(MUT-Syk)、miR-374a 组(MUT-Syk),收集培养48 h细胞检测荧光素酶活性。1.3.7
蛋白质印迹法(Western blotting)检测Syk、cyclin D1、MMP-2、P21、E-cadherin 蛋白表达 提取A2780 细胞总蛋白,按照蛋白变性→十二烷基硫酸钠-聚丙烯酰胺凝胶电泳→转聚偏二氟乙烯膜→封闭膜→一抗稀释液(1∶1000)孵育→二抗稀释液(1∶2000)孵育→化学发光显色步骤进行。ImageJ 软件分析各条带相对于内参甘油醛-3-磷酸脱氢酶(GAPDH)条带灰度值。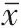
2 结果
2.1 miR-374a 在卵巢癌组织和癌旁组织中的表达
卵巢癌组织中miR-374a 的表达水平(0.92±0.09)高于癌旁组织(0.28±0.03)(t
=53.546,P
<0.001)。2.2 抑制miR-374a 表达对细胞A2780 生物学行为及放射敏感性的影响
anti-miR-374a 组卵巢癌A2780 细胞迁移与侵袭数、cyclin D1 和MMP-2 蛋白表达、增殖活力低于anti-miR-NC 组(P
<0.05),P21、E-cadherin 蛋白表达水平高于anti-miR-NC 组(P
<0.05),见图1、图2、表1、表2。anti-miR-374a 组卵巢癌A2780 细胞存活分数低于anti-miR-NC 组(P
<0.05),增敏比明显高于anti-miR-NC组,见表3,4。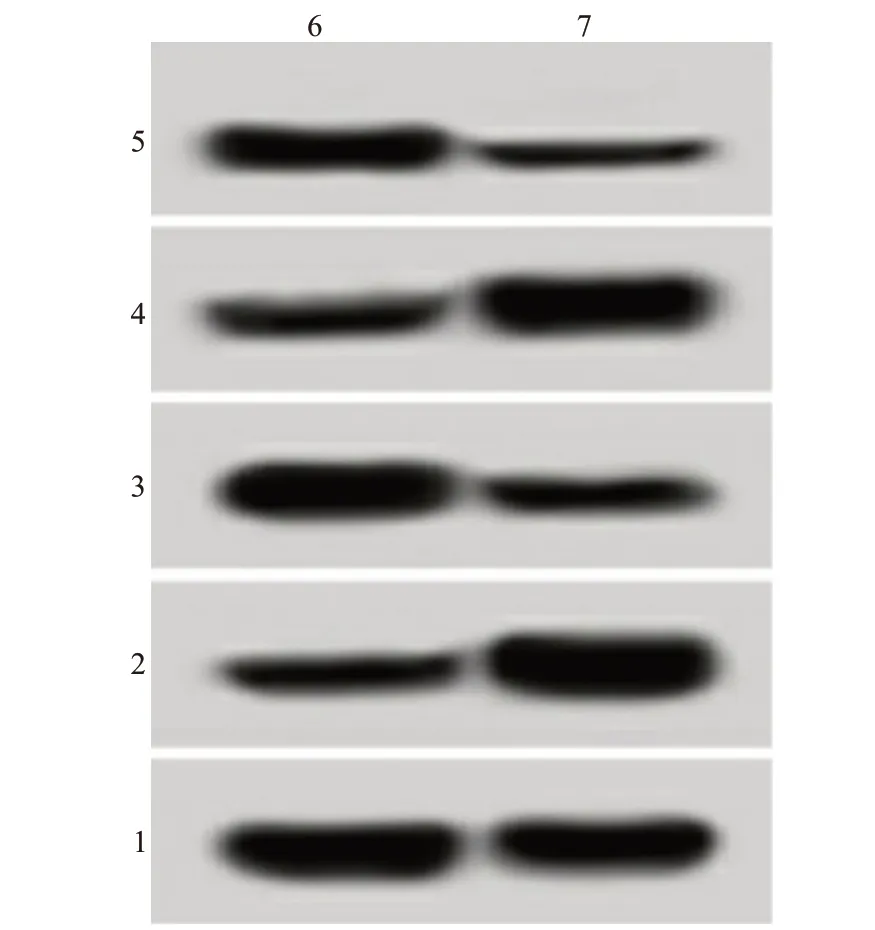
图2 抑制miR-374a表达对卵巢癌细胞A2780增殖、迁移、侵袭蛋白表达的影响
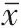
表1 抑制miR-374a表达对卵巢癌细胞A2780增殖的影响/±s
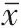
表2 抑制miR-374a表达对卵巢癌细胞A2780迁移、侵袭的影响/±s
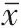
表3 抑制miR-374a表达对卵巢癌细胞A2780存活分数的影响/±s
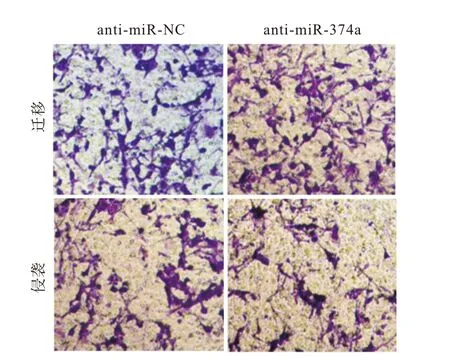
图1 抑制miR-374a表达对卵巢癌细胞A2780迁移、侵袭的影响(结晶紫染色×200)
2.3 miR-374a 靶向、调控Syk
TargetScan 预测显示Syk 的3’UTR 含有miR-374a 的结合位点,见图3。与miR-NC 组(WT-Syk)比较(0.99±0.10),miR-374a组(WT-Syk)荧光素酶活性降低(0.22±0.02)(t
=18.495,P
<0.001);而miR-NC 组(MUT-Syk)(1.03±0.10)荧光素酶活性与miR-374a 组(MUT-Syk)(0.96±0.10)比较差异无统计学意义(t
=1.212,P
=0.253)。
图3 TargetScan预测脾酪氨酸激酶(Syk)的3’UTR与miR-374a的结合位点

表4 细胞放射增敏比单击多靶模型参数
miR-NC 组、miR-374a 组、anti-miR-NC 组、antimiR-374a 组卵巢癌A2780 细胞中Syk 的表达水平比较差异有统计学意义(F
=294.889,P
<0.001),miR-374a 组(0.07±0.01)低于miR-NC 组(0.26±0.02)(P
<0.05),anti-miR-374a组(0.63±0.06)高于anti-miR-NC组(0.25±0.02)(P
<0.05),见图4。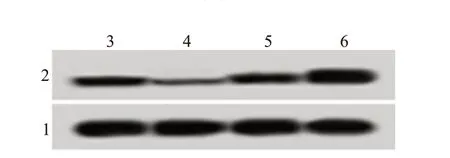
图4 过表达miR-374a或抑制miR-374a表达对Syk蛋白表达的影响
2.4 抑制Syk 表达能逆转抑制miR-374a 表达对细胞A2780 放射敏感性的影响
相较于anti-miR-374a+si-NC 组,anti-miR-374a+si-Syk 组卵巢癌A2780 细胞存活分数升高(P
<0.05),增敏比明显降低,见表5,6。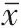
表5 抑制Syk表达能逆转抑制miR-374a表达对卵巢癌细胞A2780存活分数的影响/±s
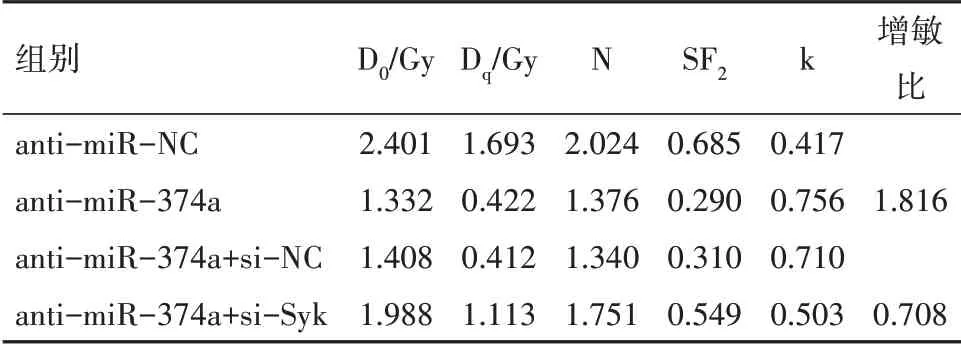
表6 细胞放射增敏比单击多靶模型参数
2.5 抑制Syk 表达能逆转抑制miR-374a 表达对细胞A2780 生物学行为的影响
anti-miR-374a+si-Syk组卵巢癌A2780 细胞活力、cyclin D1 和MMP-2 蛋白表达、迁移与侵袭数高于anti-miR-374a+si-NC 组(P
<0.05),P21 和E-cadherin 蛋白表达低于anti-miR-374a+si-NC组(P
<0.05),见图5、表7、表8。
表7 抑制Syk表达能逆转抑制miR-374a表达对卵巢癌细胞A2780增殖的影响/±s
表8 抑制Syk表达能逆转抑制miR-374a表达对卵巢癌细胞A2780迁移、侵袭的影响/±s

图5 抑制Syk表达能逆转抑制miR-374a表达对卵巢癌细胞A2780增殖、迁移、侵袭蛋白表达的影响
3 讨论
卵巢癌病人在治疗期间易出现耐药、转移等导致病人预后不良,但关于卵巢癌发病机制仍需深入研究。卵巢癌晚期病人主要采用放疗进行治疗,其主要通过抑制或杀伤肿瘤细胞而发挥作用,但治疗过程中病人常出现辐射敏感等现象,进一步研究显示miRNA 表达水平与肿瘤细胞生长及治疗密切相关。但miRNA 在卵巢癌细胞放射抵抗中的调控作用尚未完全阐明。
miR-374a 在非小细胞肺癌病人血清中的表达水平升高,并可能成为临床诊断非小细胞肺癌的辅助指标。研究表明miR-374a 高表达与宫颈癌病人淋巴结转移等临床病理特征有关。miR-374a-5p可通过靶向SPIN1而降低食管鳞状细胞癌对放疗的敏感性。本研究结果显示miR-374a 在卵巢癌组织中的表达水平高于癌旁组织,抑制miR-374a 表达可提高卵巢癌细胞对放射的敏感性。进一步研究显示抑制miR-374a 表达可降低卵巢癌细胞增殖、迁移及侵袭能力,通过蛋白质印迹法证实抑制miR-374a 表达可促进P21、E-cadherin 表达,抑制cyclin D1、MMP-2 表达,另有研究报道指出cyclin D1 可通过与CDK 结合形成复合物进而调控细胞增殖及分裂导致肿瘤发生,P21 可抑制cyclin D1 与CDK 结合形成复合物从而抑制肿瘤细胞恶性进展。研究表明MMP-2 在卵巢癌组织中高表达并可促进细胞迁移及侵袭,E-cadherin 表达减少可促进肿瘤细胞浸润扩散。本研究证实抑制miR-374a 表达可减弱卵巢癌细胞增殖、迁移及侵袭能力。
Syk基因可调控B淋巴细胞的多种生物学过程,研究表明Syk 基因在结肠癌、非小细胞肺癌等多种肿瘤中呈低表达,并可在肿瘤发生发展过程中发挥抑癌基因作用。Syk可改变胶质瘤微环境,影响胶质瘤细胞增殖及迁移。本研究试图分析miR-374a 与Syk 在卵巢癌细胞生长、转移及放射敏感性中的作用关系,结果表明miR-374a 可负向调控Syk的表达,且联合抑制miR-374a和Syk表达后,卵巢癌细胞活力增强,迁移与侵袭细胞数增多,提示miR-374a 通过靶向Syk 来抑制卵巢癌细胞生物学行为,增强细胞放射敏感性。
综上,miR-374a 表达水平降低可增强卵巢癌细胞放射敏感性,其作用机制可能是通过上调Syk 表达降低卵巢癌细胞增殖、迁移及侵袭能力而实现,可为卵巢癌放射治疗提供新方向。
(本文图1见插图12-3)
