盐酸纳美芬对心肌缺血再灌注大鼠缺氧诱导因子1α/B 细胞淋巴瘤-2/E1B-19kDa相互作用蛋白3通路及心肌自噬的影响
2021-12-15赵红霞孟丽华腾云鹏
赵红霞,孟丽华,腾云鹏
随着冠状动脉内溶栓、经皮冠状动脉介入及冠状动脉旁路移植术对缺血性心脏病治疗中的广泛应用,缺血再灌注(ischemia/reperfusion,I/R)损伤成为治疗中的热点问题,而自噬是参与心肌I/R 损伤的重要病理生理机制,除非有诱发因素(如外界营养成分、缺血缺氧、生长因子浓度等,内在损坏的线粒体、错误折叠的蛋白质、细胞内病原体等)的存在,否则在正常情况下,自噬很少发生。缺氧诱导因子1α(hypoxia-inducible factor-1α,Hif-1α)/B 细胞淋巴瘤-2(Bcl-2)/E1B-19kDa 相互作用蛋白3(Bcl-2 and adenovirus E1B19kDa-interacting protein 3,BNIP3)信号通路是低氧条件下发生自噬的重要信号通路,其中BNIP3是一种促凋亡蛋白,可诱导线粒体功能障碍,是I/R 损伤的重要因素。抑制低氧诱导的Hif-1α 和BNIP3 水平,可进一步抑制低氧诱导心肌细胞自噬和凋亡作用,发挥心肌保护功能。而盐酸纳美芬不但可剂量依赖性地减轻大鼠肺I/R损伤,而且对治疗新生儿缺氧缺血性脑病的效果显著,可明显改善患儿症状,同时安全性较高。但是盐酸纳美芬对心肌I/R 损伤大鼠Hif-1α/BNIP3 通路及心肌自噬的影响,目前尚未有研究。本研究于2020年3—4月通过采用结扎冠状动脉左前降支法复制心肌缺血再灌注损伤(myocardial Ischemia reperfusion injury,MIRI)大鼠模型,并使用盐酸纳美芬干预该模型,旨在从基础研究领域揭示盐酸纳美芬对MIRI大鼠Hif-1α/BNIP3通路及心肌自噬的影响,为缺血性心脏病病人的治疗提供参考依据。
1 材料与方法
1.1 材料
1.1.1
实验动物 SPF 级6~7 周龄SD 大鼠(90 只,雄性,体质量范围为200~220 g)购自重庆医科大学动物实验中心,许可证号:SCXK(渝)2018-0003,符合国家实验室动物伦理保护标准及相关法律规定。按照3R 原则给予实验动物人道的关怀照顾。饲养条件为:自由摄水、饮食,恒温22 ℃,相对湿度55%,12 h光暗循环,定期添加饲料、饮用水、更换垫料、清理消毒鼠笼,保持动物房通风、清洁、安静。1.1.2
实验药物 盐酸纳美芬(规格:1 mL×5 支,批次1812010,批号H20183012)购自成都苑东生物制药股份有限公司;氯喹(规格:50 mg,纯度:97%)为一种自噬抑制药物且能缓解心肌损伤,购自麦克林生化科技有限公司。1.1.3
主要试剂和仪器 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和甘油醛-3-磷酸脱氢酶(GAPDH)鼠抗均购自美国Sigma 公司;蛋白提取试剂盒、ECL 显色试剂盒和BCA 蛋白定量试剂盒购自北京中山金桥生物科技有限公司;4% 多聚甲醛购自武汉塞维尔生物科技有限公司;氯化三苯基四氮唑(2、3、5-Triphenyte-trazoliumchloride,TTC)染液、苏木素和伊红染液均购自上海生工生物科技有限公司;二氯荧光素双醋酸盐(DCFH-DA)活性氧检测试剂盒购自上海碧云天生物科技有限公司;Beclin1、LC3-Ⅰ、LC3-Ⅱ、Hif-1α、BNIP3 兔抗、辣根过氧化物酶标记羊抗兔免疫球蛋白G(IgG)二抗均购自美国Abcam 公司;动物心电图分析系统和小动物呼吸机均购自上海奥尔科特生物技术有限公司;尼康SMZ745 光学显微镜购自于上海普赫生物科技有限公司;全能型凝胶成像分析系统ChemiDoc-MP 购自山东三瑞科技有限公司;石蜡切片机购自湖北惠达仪器有限公司。1.2 方法
1.2.1
MIRI 模型的建立及分组 大鼠腹腔注射1%戊巴比妥钠(30 mg/kg)进行麻醉,仰卧位固定于手术台。进行术前心电图检查,取心电图正常且符合标准的大鼠进行造模,采用结扎冠状动脉左前降支法复制MIRI 大鼠模型。大鼠四肢接心电图监护电极监测心电图变化,经口腔气管插管后,连接小动物呼吸机(设定为室内空气气源,呼吸频率70 次/分,潮气量11~14 mL),然后剔除大鼠颈前区和胸前区毛发,皮肤进行消毒后,沿胸骨正中线左侧旁开约0.5 cm 处切开皮肤,在第3、4 肋骨间开胸,暴露心脏,轻轻挑开心膜,拨开左心耳,缓慢分离出左冠状动脉前降支,使用6/0 无损伤缝线结扎血管(假手术组仅暴露心脏,不做其他处理)。观测心电图变化,当ST波升高,心肌颜色由红变白时,表明缺血完成,维持30 min 后,松开结扎线,恢复左前降支血液灌注,心电图显示ST 波下降且出现病理性Q 波,表示MIRI 大鼠模型建造成功。依次进行肌肉、皮肤的缝合,并于切口处擦拭少量碘伏消毒,防止感染。将造模成功的75 只大鼠使用随机数字表法分成模型组、盐酸纳美芬低、中、高(大鼠尾静脉注射10 μg/kg、15 μg/kg、20 μg/kg盐酸纳美芬)剂量组、氯喹组(阳性对照,大鼠腹腔注射0.02 g/kg),每组15 只,另取15只假手术组大鼠作为对照,模型组和假手术组尾静脉及腹腔注射等剂量生理盐水,其余各组给予相对应剂量药物,每天1次,连续3 d。1.2.2
实验样本的获取和保存 给药结束24 h 后,大鼠腹腔注射10% 水合氯醛(400 mg/kg)深度麻醉实施安乐死。迅速解剖,分离心脏,各组分别取5只大鼠心脏置于-20 ℃冰箱中冷冻、5只大鼠心肌组织置于4% 多聚甲醛固定、5 只大鼠心肌组织置于-80 ℃超低温冰箱待用。1.2.3
TTC法检测各组大鼠心肌梗死面积 取上述“1.2.2”中置于-20 ℃冰箱中冷冻2 h 的心脏,使用超薄特制刀片横向切割左心室。厚度均匀的切成5~6片,并将切片置于1% TTC 溶液中,37 ℃水浴20 min(为使染色均匀,第10分钟时需进行翻面),然后使用预冷的生理盐水洗取多余染液。将标本依次进行拍照,采用Image pro 软件分析非梗死区(红色)和梗死区(白色)面积。计算公式为:心肌梗死面积=心肌梗死区面积/心肌总面积×100%。1.2.4
苏木精-伊红(HE)染色观察各组大鼠心肌组织病理学变化 取上述“1.2.2”中置于4% 多聚甲醛中固定24 h 的心肌组织,石蜡包埋,冷冻切片机将组织切成厚度约为4 μm的切片(为防止染色过程中组织切片脱落,需在65℃下拷片2 h),置于二甲苯中脱蜡2 次,每次10 min,依次使用100%、95%、85%、75% 的梯度乙醇脱水,每次5 min,然后使用苏木素染色15 min、流水冲洗2 min、1% 盐酸乙醇分化2 s、流水冲洗15 min、伊红染色10 min、再依次使用80%、85%、95%、100% 乙醇脱水,每次5 min、二甲苯透明2 次,每次10 min,最后在石蜡切片正中滴加适量中性树胶封固,于光学显微镜下观察并拍摄照片。1.2.5
DCFH-DA 法检测各组大鼠心肌组织中活性氧水平 取上述“1.2.2”中置于-80 ℃超低温冰箱中的各组大鼠心肌组织,分别称取1.5 g 加入3 mL 100 mmol/L 磷酸缓冲液制备组织匀浆,然后4 ℃,1000 r/min 离心10 min,取上清待用,依据DCFHDA试剂盒说明书于96孔板内加入190 μL匀浆上清和10 μL 1 mmol/L DCFH-DA 工作液,用移液枪吹打混匀,37 ℃孵育30 min 后,于荧光酶标仪下,设置激发波长500 nm、发射波长525 nm,检测其荧光强度,即为活性氧相对水平。1.2.6
蛋白质印迹法(Western blotting)检测各组大鼠心肌组织中通路蛋白Hif-1α、BNIP3 及自噬相关蛋白表达水平 取上述“1.2.2”中置于-80 ℃超低温冰箱中的各组大鼠剩余心肌组织,使用蛋白提取试剂盒提取总蛋白,BCA 蛋白定量试剂盒对蛋白进行定量,然后进行SDS-聚丙烯酰胺凝胶电泳(PAGE)、转聚偏二氟乙烯(PVDF)膜、5% 脱脂奶粉封闭、1∶2000 浓度稀释后的Hif-1α、BNIP3、Beclin-1 和GAPDH 鼠抗4 ℃过夜孵育、置于含辣根过氧化物酶缀合的二抗(1∶5000)中室温孵育2 h,用ECL 显色试剂盒显色,全能型凝胶成像分析系统分析蛋白表达水平,计算各蛋白相对内参蛋白GAPDH的表达量。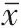
2 结果
2.1 盐酸纳美芬对MIRI 大鼠心肌梗死面积的影响
与假手术组大鼠心肌梗死面积(0.00±0.00)%相比,模型组大鼠心肌梗死面积(49.25±5.06)%显著升高(P
<0.05);与模型组相比,盐酸纳美芬低、中、高剂量组大鼠心肌梗死面积分别为(22.07±2.48)%、(13.31±1.69)% 、(4.26±0.52)% ,依次降低(P
<0.05);氯喹组大鼠心肌梗死面积为(3.67±0.39)%,与盐酸纳美芬高剂量组差异无统计学意义(P
>0.05)。F
=290.049,P
<0.001。见图1。
图1 各组大鼠心肌组织TTC染色情况:1A为假手术组;1B为模型组;1C为盐酸纳美芬低剂量组;1D为盐酸纳美芬中剂量组;1E为盐酸纳美芬高剂量组;1F为氯喹组 图2 各组大鼠心肌组织病理变化(HE染色×200):2A为假手术组;2B为模型组;2C为盐酸纳美芬低剂量组;2D为盐酸纳美芬中剂量组;2E为盐酸纳美芬高剂量组;2F为氯喹组
2.2 盐酸纳美芬对MIRI大鼠心肌组织病理变化的影响
假手术组大鼠心肌组织结构完整,无明显病理变化。模型组大鼠心肌组织结构异常、心肌细胞坏死、心肌损伤严重。与模型组相比,盐酸纳美芬低、中、高剂量组大鼠心肌组织病理损伤依次减轻,且盐酸纳美芬高剂量组和氯喹组差别不明显。见图2。2.3 盐酸纳美芬对MIRI大鼠心肌组织中活性氧水平的影响
与假手术组大鼠心肌组织活性氧水平0.15±0.02 相比,模型组大鼠心肌组织中活性氧水平0.87±0.09 显著升高(P
<0.05);与模型组相比,盐酸纳美芬低、中、高剂量组大鼠心肌组织活性氧水平分别为0.52±0.06、0.39±0.05、0.22±0.04,依次降低(P
<0.05);氯喹组大鼠心肌组织活性氧水平为0.20±0.03,与盐酸纳美芬高剂量组差异无统计学意义(P
>0.05)。F
=129.784,P
<0.001。2.4 盐酸纳美芬对MIRI大鼠心肌组织中自噬相关蛋白表达水平的影响
与假手术组相比,模型组大鼠心肌组织中Beclin1、LC3-Ⅱ蛋白表达水平及LC3-Ⅱ/Ⅰ比值显著增加(P
<0.05);与模型组相比,盐酸纳美芬低、中、高剂量组大鼠心肌组织中Beclin1、LC3-Ⅱ蛋白表达水平及LC3-Ⅱ/Ⅰ比值依次降低(P
<0.05);盐酸纳美芬高剂量组和氯喹组大鼠心肌组织中自噬相关蛋白表达水平差异无统计学意义(P >
0.05)。各组间LC3-Ⅰ蛋白表达水平均差异无统计学意义(P >
0.05)。见图3、表1。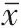
表1 各组细胞中自噬相关蛋白Beclin1、LC3-Ⅰ、LC3-Ⅱ蛋白表达水平及LC3-Ⅱ/Ⅰ比值比较/±s
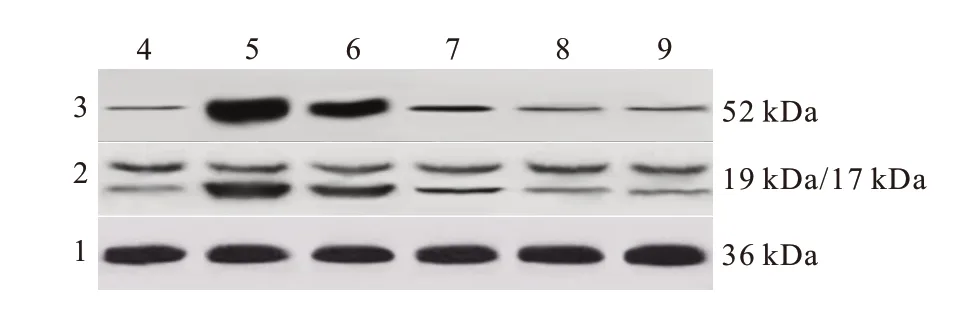
图3 蛋白质印迹法检测各组大鼠心肌组织中自噬相关蛋白表达
2.5 盐酸纳美芬对MIRI大鼠心肌组织中通路蛋白Hif-1
α、BNIP3表达水平的影响
与假手术组相比,模型组大鼠心肌组织中Hif-1α、BNIP3 蛋白表达水平显著增加(P
<0.05);与模型组相比,盐酸纳美芬低、中、高剂量组大鼠心肌组织中Hif-1α、BNIP3 蛋白表达水平依次降低(P
<0.05);盐酸纳美芬高剂量组和氯喹组大鼠心肌组织中Hif-1α、BNIP3 蛋白表达水平差异无统计学意义(P >
0.05)。 见图4、表2。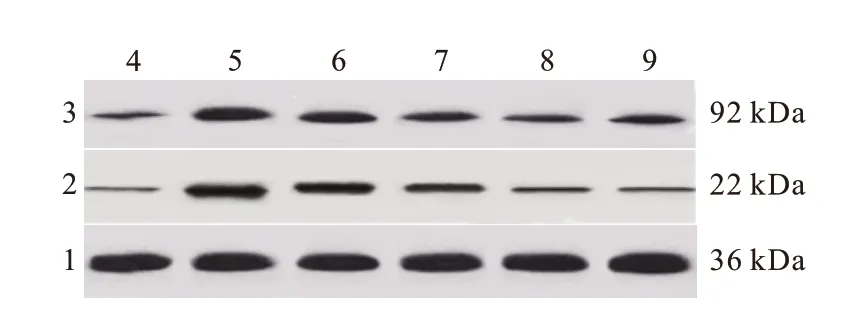
图4 蛋白质印迹法检测各组大鼠心肌组织中Hif-1α、BNIP3蛋白表达
表2 各组大鼠心肌组织中Hif-1α、BNIP3蛋白表达水平比较/±s
3 讨论
心肌梗死的发生发展过程迅速,可使心肌组织大面积损伤,若不及时治疗,很容易导致死亡,进行相应治疗后,可恢复心肌血液供应,但极易引起MIRI,进而导致心功能障碍,使病人预后不良,且随着社会经济的发生和人民生活习惯的改变,我国居民心肌梗死发病率逐年上升,所以寻找新的MIRI治疗药物及手段已成为当下研究的热点。本研究采用结扎冠状动脉左前降支法构建MIRI 大鼠模型后,发现模型组大鼠心肌组织结构异常、心肌细胞坏死、心肌损伤严重、Beclin1、LC3-Ⅱ蛋白表达水平和LC3-Ⅱ/Ⅰ比值显著升高,提示模型构建成功,且伴随心肌自噬。
盐酸纳美芬主要用于完全或部分逆转阿片类药物过量引起的中毒,还可用于治疗促醒、急性颅脑与脊髓损伤、脑缺血、昏迷、休克、术后麻醉催醒、酒精中毒等。随着对其作用的不断研究,研究发现给予脓毒性休克病人盐酸纳美芬干预治疗后,可明显减轻病人心肌损伤程度。本研究中,盐酸纳美芬各组大鼠心肌组织病理损伤较模型组减轻,心肌梗死面积较模型组降低,与临床研究相似。另外,研究发现抑制心肌过度自噬可缓解MIRI,发挥心肌保护作用柴松波等,而过量活性氧可以通过凋亡和自噬机制触发细胞程序性死亡。但是另有Cao 等研究发现生脉注射液可通过Beclin-1 的表达,促进心肌线粒体自噬,对感染性心肌病心肌线粒体具有保护作用,与上述Wu 等研究结果并不一致。这可能是由于自噬是一把“双刃剑”,同时自噬过程较快,而且细胞自噬的信号转导通路非常复杂,并且来自外界的多种刺激条件及环境因素各不相同,所以不同细胞和组织间的自噬活性存在一定的差异性。而本研究发现,与模型组相比,盐酸纳美芬低、中、高剂量组大鼠心肌组织活性氧水平以及Beclin1、LC3-Ⅱ蛋白表达水平和LC3-Ⅱ/Ⅰ比值依次降低,提示盐酸纳美芬可剂量依赖性地降低心肌自噬及氧化因子水平,与上述Wu 等研究结果一致,但其中的机制尚需进一步研究。
HIF-1α/BNIP3 信号通路是参与心肌自噬的重要通路,且与MIRI的发生和发展密切相关。低氧可通过Hif-1α 依赖的信号通路抑制心肌细胞存活,并通过诱导BNIP3 表达增强心肌细胞自噬和凋亡。自噬小体的形成或清除缺陷可引起心功能障碍,甚至导致心力衰竭,而MIRI 可增加Hif-1α 的表达水平,激活下游BNIP3表达,进而触发线粒体依赖的自噬,上调Hif-1α 和BNIP3表达可促进心肌I/R大鼠心肌细胞的自噬。另有王睿等研究发现地马煎剂可通过激活HIF-1α/BNIP3/Beclin-1通路相关蛋白的表达,提高溃疡性结肠炎模型大鼠结肠上皮的线粒体自噬水平。本研究发现,模型组大鼠心肌组织中Hif-1α 和BNIP3 蛋白表达水平显著升高,经低、中、高剂量盐酸纳美芬干预后,Hif-1α 和BNIP3 蛋白表达水平依次降低,提示盐酸纳美芬可剂量依赖性地抑制Hif-1α/BNIP3通路,降低MIRI大鼠心肌自噬。
综上所述,盐酸纳美芬可能通过抑制Hif-1α/BNIP3 通路,降低MIRI 大鼠心肌自噬,缓解心肌损伤,且呈剂量依赖性。但是盐酸纳美芬对MIRI的治疗机制较为复杂,尚需深入研究。
(本文图1,2见插图12-1)
