PET 瓶无菌线培养基模拟灌装的取样数与污染率问题研究
2021-12-14陆健锋张琪谢骏琦周卫林
陆健锋 张琪 谢骏琦 周卫林
无菌灌装是指在无菌环境下,将灭菌后的液态物料及包装材料完成灌装和封口的过程。与高温热灌装相比,无菌灌装采用严格的过程控制,在可能会引起微生物污染的位置加强无菌状态的保持,无需添加防腐剂,无需二次杀菌就可以达到商业无菌[1,2],同时降低PET 的克重,并在瓶型设计方面具有更大的灵活性。培养基模拟灌装是无菌验证的核心内容,是指在无菌验证中,以培养基替代生产介质,模拟实际产品生产过程,并通过培养基的最终染菌率来评估无菌保证能力。
无菌的概念
无菌是指不含任何微生物,从定义上来说,是一个绝对的概念。一旦将无菌定义为绝对无微生物污染,那么就无法用科学的方法来验证,从而无法建立起可以应用的技术标准,因此我们需要的无菌概念是科学的、安全的,最重要是可验证的。无菌产品的安全性要求设定相对的无菌标准。
物理或化学灭菌方法的杀灭曲线是遵循对数规则的,即意味着一批灭菌物品中可能有一定概率的活微生物未被杀灭或除去[3],所以无菌性在概率意义上定义为污染低到可接受的程度,一般用无菌保证值SAL(Sterility Assurance Level)表示。USP24 版〈1211〉的灭菌及灭菌保证提到:最终灭菌产品的SAL 要求小于百万分之一。无菌灌装产品的 SAL 要求小于千分之一。饮料行业所说的无菌属于“商业无菌”概念,商业无菌是指经过适度的杀菌后,产品不含有致病性微生物,也不含有在通常温度下能繁殖的非致病性微生物[4]。
灌装取样数
培养基灌装是无菌检查的一种特殊形式。灌装数量可看作取样数量,将直接影响无菌检查的可信度。
在培养基灌装检查发现污染的概率公式:
Q=1-(1-p)n
Q—未通过无菌检查的概率
n 取样数
P 产品污染率(与生产工艺提供无菌保证的能力有关)通过两项式展开法来评价产品污染率(%)和取样数对无菌检查污染率(%)的影响,见表1:
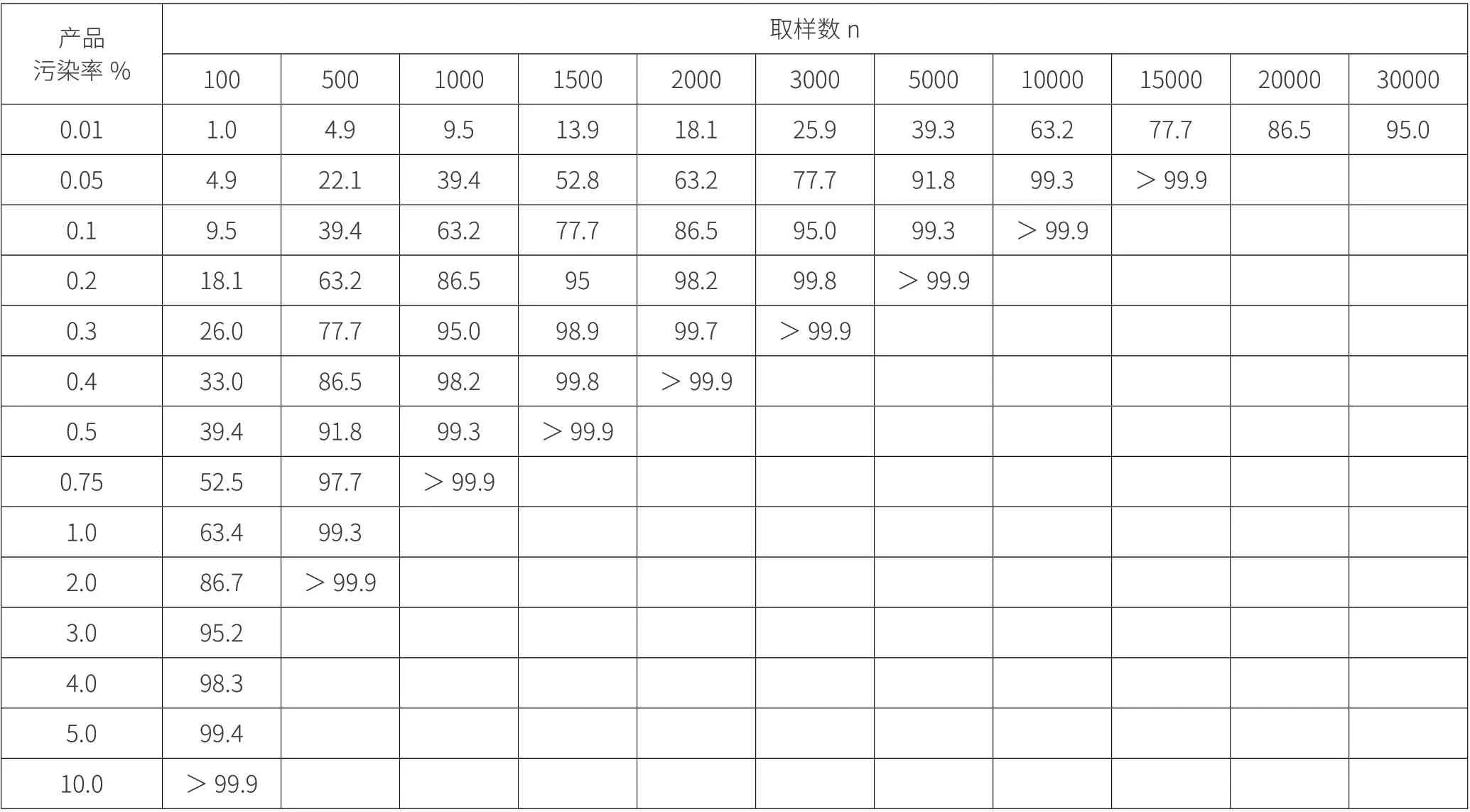
表1.
从计算可以看出,产品的污染率越低,通过无菌检查判断批产品无菌的可信度越差。如表1 所示,0.2%污染率的产品,当取样数为 100 时,误将产品判为合格的概率为 81.9%。如图1 所示,同样的取样数,污染率越低,误将产品判为合格的概率越高。如图2 所示,在对产品污染控制比较高的情况下,加大取样数,提高的可信度也是微不足道的。增加取样数时,无菌操作污染的风险也会增加,因此,过多地增加取样数并不是保证产品无菌验证准确性的合理路径。
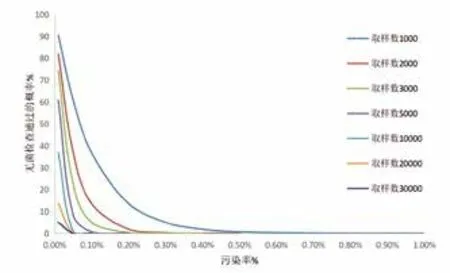
图1
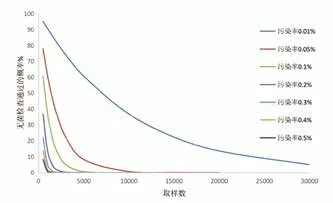
图2
通常情况下,确定培养基的灌装数量考虑以下两个主要因素:一是应符合统计学要求,即在95%的置信区间,且至少能检出千分之一的污染率[5];二是被验证工艺过程覆盖日常实际生产批量。因为实际生产批量与无菌工艺操作所持续的时间和灌装速度密切相关,而培养基灌装的持续时间应足以涵盖实际生产条件下的全部操作,并且培养基的灌装数量应能反映出在等于或小于实际生产的灌装速度下产品及容器所暴露时间的“最差状况”[6,7]。饮料行业不同于制药企业,灌装设备无菌保持时间通常为72小时,以实际运行产能24000 瓶/时的灌装设备单批量计算达到1728000瓶。如果以该数量定为培养基模拟灌装量,那么将大幅增加企业生产成本。因此,饮料行业在无菌验证时,培养基模拟灌装取样数通常为30000 瓶,并且分三轮,在生产初始、中间、末尾进行灌装取样,目的是为了尽可能地覆盖一个无菌周期。
污染概率
FDA 规定了无菌灌装方法的无菌安全程度为10-3,因此,培养基灌装污染率的极限值是0.1%。FDA 工业指南《用无菌工艺生产的无菌药品—现行良好生产方法》有关无菌制剂工艺模拟验证合格标准如下:
1. 灌装少于 5000 支时, 不应检出污染品
2. 灌装在 5000 至 10000 时:
(1) 1 支污染需进行调查, 并考虑重复培养基灌装试验
(2) 2 支污染需进行调查, 并可即视作再验证的理由
3. 灌装超过 10000 支时:
(1) 1 支污染需进行调查
(2) 2 支污染需进行调查, 并可即视作再验证的理由
根据欧洲饮料机械工业协会(Association of the Beverage Machinery Industry)公布的无菌验证协议:低酸性产品的无菌验证分3 轮进行,每轮10000 瓶,每轮≤1 瓶的染菌被视为无菌验证的可接受标准。培养基灌装污染率是无菌检查的一项重要参数,当某一条无菌生产线通过培养基模拟灌装测试,代表该生产线达到商业无菌[8]。
无论在医药还是食品行业,无菌技术应用于生产领域已有几十年的历史,随着科技的飞速发展以及相关应用技术不断提高,无菌技术越来越成熟、可靠。同时,食品安全性和营养功能性受到广泛重视,低碳高效的无菌技术在未来具有广阔的发展空间。
