磁共振成像表观扩散系数变化对新生儿化脓性脑膜炎脑损伤纵向评估
2021-12-14吴菲潇乔中伟
陈 斌 吴菲潇 曹 云 乔中伟
新生儿化脓性脑膜炎是导致新生儿严重脑损伤的重要致病因素。本研究团队前期研究发现,新生儿化脓性脑膜炎严重并发症包括脑梗死、脑脓肿、脑积水、散在或弥漫性脑白质病灶、硬膜下积脓等,其中近1/3患儿MR形态学未发现明显异常[1],易被临床轻视。MR 弥散加权成像(DWI)是一种可以定量分析脑组织微观病变的检查方法,通过表观弥散系数(ADC)值量化脑组织的弥散程度。新生儿脑组织ADC值较高,随着脑发育,特别是髓鞘化形成,ADC值逐步下降。新生儿脑病可以出现脑细胞水肿,MR DWI显示新生儿缺氧缺血性脑病(HIE)、脑炎、脑梗死等疾病早期急性脑损伤病灶,表现为ADC值下降;随着疾病变化,病变区ADC与周围正常脑组织相比呈等信号(DWI假正常化);进一步随访可出现病变区脑组织ADC值较正常区域增高,代表局部脑组织破坏,或新生儿髓鞘化进程延迟[2-7]。既往文献报道[8]化脓性脑膜炎在脑室周围白质ADC值减小,且在病程1个月左右ADC值恢复至正常水平。
本研究通过回顾性总结新生儿化脓性脑膜炎在发病后不同病程阶段的头颅MR,分析不同颅脑并发症下无显著病变的脑组织ADC值随病程的变化规律,并探讨髓鞘化过程在疾病中的作用。
1 方法
1.1 研究设计 病例对照研究。以新生儿化脓性脑膜炎患儿并行MR检查为病例组,以正常健康儿童并行MR检查为对照组,分析对照组和病例组不同颅脑并发症下脑组织ADC值4个月的纵向变化趋势。
1.2 病例组纳入和排除标准 ①2014至2018年复旦大学附属儿科医院(我院)HIS系统病历首页诊断为新生儿化脓性脑膜炎[9](排除早产儿)并行头颅MR检查的病历,排除同时伴有先天性TORCH感染、病毒性脑膜炎、神经梅毒、结核性脑膜炎、真菌性脑膜炎、新生儿窒息、HIE和代谢性脑病的病历;②同时期我院放射医学影像管理与传输系统中MR报告诊断为新生儿化脓性脑膜炎的报告,排除伴有先天性脑积水、先天性颅脑畸形、颅内肿瘤的报告;③对①和②通过住院病历号去重。
1.3 对照组纳入标准 ①与病例组同时期在我院因生理性黄疸、红细胞增多症、意外吸入异物致肺部感染行常规MR检查的儿童;②临床检查未发现任何其他神经系统疾病史及相关体征;③常规头颅MR未观察到异常病变。
1.4 MR检查
1.4.1 MR检查方法 ①MR设备为德国西门子Avanto 1.5T。②常规序列包括轴位TSE T2加权成像、轴位SE/FLASH T1加权成像、矢状位SE T1加权成像、轴位TIRM Dark-Fluid T2加权成像;轴位DWI采用单次激发EPI技术,b值为0和1 000 s·m-2。③MRI检查前30 min予10%水合氯醛0.5 mL·kg-1口服镇静。④进行MR检查前均获得家长知情同意。
1.4.2 MR图像分析 ①在GE AW工作站使用软件包FuncTool得到ADC图;②手动放置ROI:额叶皮质、顶叶皮质、颞叶皮质、额叶白质、顶叶白质、颞叶白质、背侧丘脑、豆状核、内囊后肢、胼胝体压部;③尽量对同一结构的双侧对称部位进行测量,ROI范围为10~15 mm2,避开常规MR图像中观察到的病变区;④ADC值测量工作由2位放射科医师独立进行。
1.4.3 头颅MR并发症评估 影像科1位医生对患儿颅脑并发症进行评估,另1位医生复核;有分歧时讨论后给出一致结果。评估内容包括脑实质非囊性信号灶、脑实质软化灶、脑梗死、脑脓肿、脑积水、脑室积脓/出血、颅内脑外间隙异常(积血/积脓/出血)。MR颅脑并发症评估时,例如1次MR检查有2个脑实质非囊性信号灶计为脑实质非囊性信号灶1个。
脑积水诊断标准[10, 11],符合以下任意1项:①Evan's指数(双侧侧脑室轴位最大额角横径/双顶径)>0.3,②双侧侧脑室轴位最大额角横径>45 mm,③第三脑室宽度>6 mm,④第四脑室宽度>12 mm。
1.5 亚组考虑
1.5.1 依据大脑髓鞘化程度 根据新生儿大脑髓鞘化进程及生长发育特征,将检查日龄分为0~14 d、~28 d、~60 d、~120 d。
1.5.2 根据是否存在脑实质损伤灶和脑积水 病例1组:无脑实质损伤灶和脑积水;病例2组:有脑实质损伤灶,无脑积水;病例3组:有脑积水、无脑实质损伤灶;病例4组:有脑实质损伤灶和脑积水。
1.5.3 根据MR检查时的脑膜炎病程 本文脑膜炎病程指发病至头颅MR检查的间隔时间,发病时间以病史记录为准,如不能从病史中获得明确的发病时间,以距腰椎穿刺阳性结果最近的相关症状出现时间为发病时间。分为病程A组(0~7 d)、病程B组(~30 d)、病程C组(~60 d)、病程D组(~120 d)。在病程A组根据MR检查日龄0~14 d和~28 d分为病程A1组和病程A2组,在病程B组根据MR检查日龄~28 d和~60 d分为病程B1组和病程B2组。
1.5.4 对照组 病程A2组、病程B1组的日龄均为~28 d,病程B2组和病程C组的日龄均为~60 d,相同日龄匹配一个对照组,故病程A1组、病程A2组或病程B1组、病程B2组或病程C组、病程D组中,每组匹配20例(对照组与病例组性别相同,日龄相近),共80例。
1.6 资料收集 病例组患儿和对照组儿童的性别、胎龄、出生体重;病例组病原学培养结果,脑脊液检查结果等;病例组MR检查次数,每次MR检查脑实质损伤灶和脑积水判断结局,每次MR检查的ADC值;对照组MR检查的 ADC值。
1.7 统计学分析 对2名放射科医生获取的ADC值行组间相关系数(ICC)计算,对相同部位附近感兴趣区ADC值取平均值。对各病程下(相同日龄)对照组、病例1~4组的ADC值进行比较,对相同病程、不同日龄的病例组ADC值进行比较。对计量资料行Shapiro-Wilk正态性检验,符合正态分布的2组连续变量行t检验,>2组连续变量行方差检验,以xˉ±s描述;不符合正态分布的连续变量组间行非参数检验,以中位数(四分位数间距)描述。两组间计数资料比较采用卡方检验,以n(%)描述。
2 结果
2.1 一般情况 符合本文病例组纳入和排除标准的新生儿化脓性脑膜炎173例,男96例(55.2%),女77例,胎龄39.3(37.0~41.7)周,出生体重3.4(2.5~4.2)kg。符合本文对照组纳入标准80例,男48例(60%),女32例;胎龄39(37.0~41.9)周,出生体重3.4(2.6 ~4.2)kg。
173例新生儿化脓性脑膜炎,病原学培养阳性69例(40.2%),其中脑脊液培养阳性39例,血培养阳性48例,两者均阳性18例;大肠埃希菌27例(38.6%)、无乳链球菌23例(32.9%)。104例为临床确诊的新生儿化脓性脑膜炎。
2.2 MR检查例次 病例组MR检查302例次,1次87例、2次55例、3次20例、4次10例、5次1例。脑积水72例次,脑实质损伤灶70例次(其中脑实质非囊性信号灶64例次、脑实质软化灶43例次、脑梗死4例次、脑脓肿3例次),脑室积脓/出血57例次,颅内脑外间隙异常(积液/积脓/出血)121例次;其中,11例患儿(含34例次MR)多次随访的MR经颅脑并发症评估后被归入不同的病例组,本文旨在分析相同MR评估结果下髓鞘化进程在不同病例组的ADC值,故在分析不同病例组ADC值时,上述1,1例患儿数据不纳入计算,162例(268例次MR)进入后续分析。图1为病例组162例患儿的268例次MR检查病程日龄散点图,新生儿化脓性脑膜炎病程0~109 d,日龄2~120 d,4个红色矩形区域从左往右分别为病程A1组、病程B1组、病程C组、病程D组,病程A1组和病程B1组正上方的绿色矩形区域分别为病程A2组、病程B2组,详细MR检查次数见表1;需要说明的是,病程A2组正上方(9例,MR检查9次)、病程B1组正下方(9例,MR检查9次)、病程C组正上方(8例,MR检查9次) 不纳入本文分析。
表1显示,基于241例次MR检查在不同病例组和不同病程的分布状况,鉴于病例4组MR检查11次,故不再行不同病程和检查日龄的分层分析。
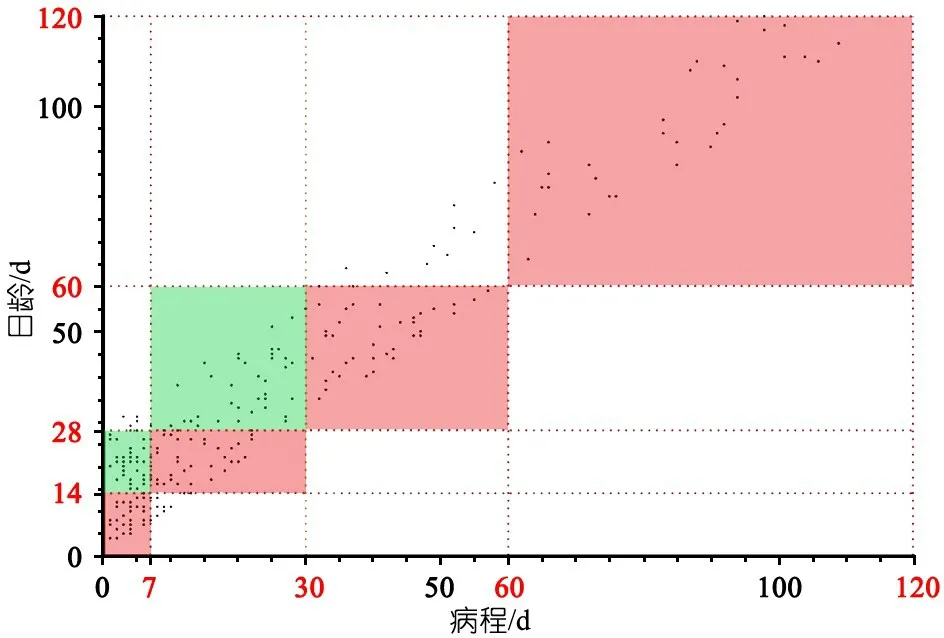
图1 病例组病程120 d内MR检查的病程-日龄散点图
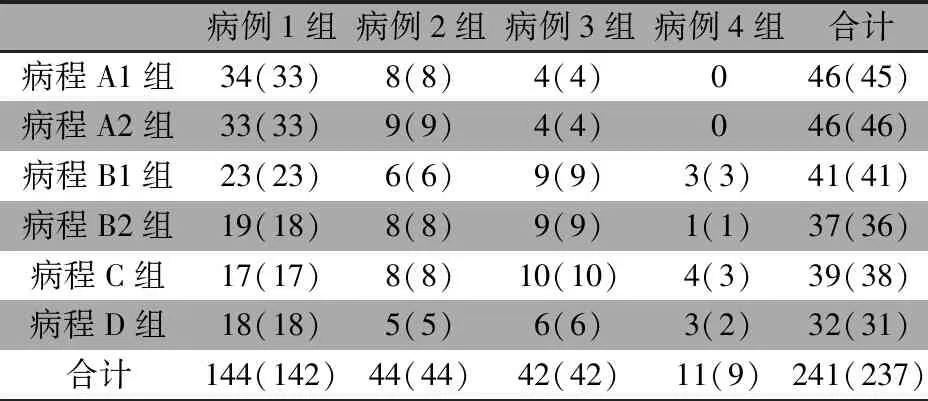
表1 病例1~4组MR检查例数和例次[例次(例)]
2.3 ADC值测量一致性检验 我院2名放射科医生分别行MR的ADC测量,一致性检验ICC均>0.8,选取测量结果的平均值。
2.4 各病程中(相同日龄下)病例组和对照组ADC值比较 表2显示,随着日龄的增加,ADC值呈下降趋势。除外胼胝体压部,在病程~60 d的病例3组ADC值明显低于对照组,差异有统计学意义。大脑皮质、内囊后肢和胼胝体压部在不同病程中,病例1~3组和对照组ADC值差异均无统计学意义。额叶白质、顶叶白质、颞叶白质在病程~60 d,病例2、3组ADC值明显低于对照组,病例3组及部分病程中的病例2组ADC值明显低于病例1组。额叶白质、顶叶白质、颞叶白质在病程~120 d,病例2、3组和对照组ADC值差异无统计学意义,病例1组ADC值明显高于对照组。背侧丘脑、豆状核在病程~30 d,病例1~3组ADC值明显低于对照组;除外豆状核,病程A1组病例1组和对照组ADC值差异无统计学意义。背侧丘脑、豆状核在病程~120 d,病例1~3组和对照组ADC值差异均无统计学意义。
图2显示,皮层下白质(额叶白质、顶叶白质、颞叶白质)在病程0~7 d、~30 d和~60 d,病例2、3组与病例1组和对照组ADC值比较差异均有统计学意义。深部灰质(背侧丘脑和豆状核)在病程0~7 d和~30 d,病例1~3组与对照组ADC值比较差异均有统计学意义。
2.5 相同病程、不同日龄下病例组ADC值比较 表3显示,对照组皮质、白质、深部灰质、内囊后肢和胼胝体压部ADC值,病例1组皮质、白质、豆状核、内囊后肢和胼胝体压部ADC值,病例2组额叶皮质、颞叶白质ADC值,病例3组背侧丘脑、内囊后肢ADC值,均病程A1组>病程A2组,差异均有统计学意义;表4显示,对照组顶叶皮质、颞叶皮质、白质、深部灰质、内囊后肢ADC值,病例1组顶叶皮质、颞叶皮质、白质、豆状核、内囊后肢ADC值,病例2组颞叶皮质、颞叶白质、胼胝体压部ADC值,均病程B1组>病程B2组,差异均有统计学意义。
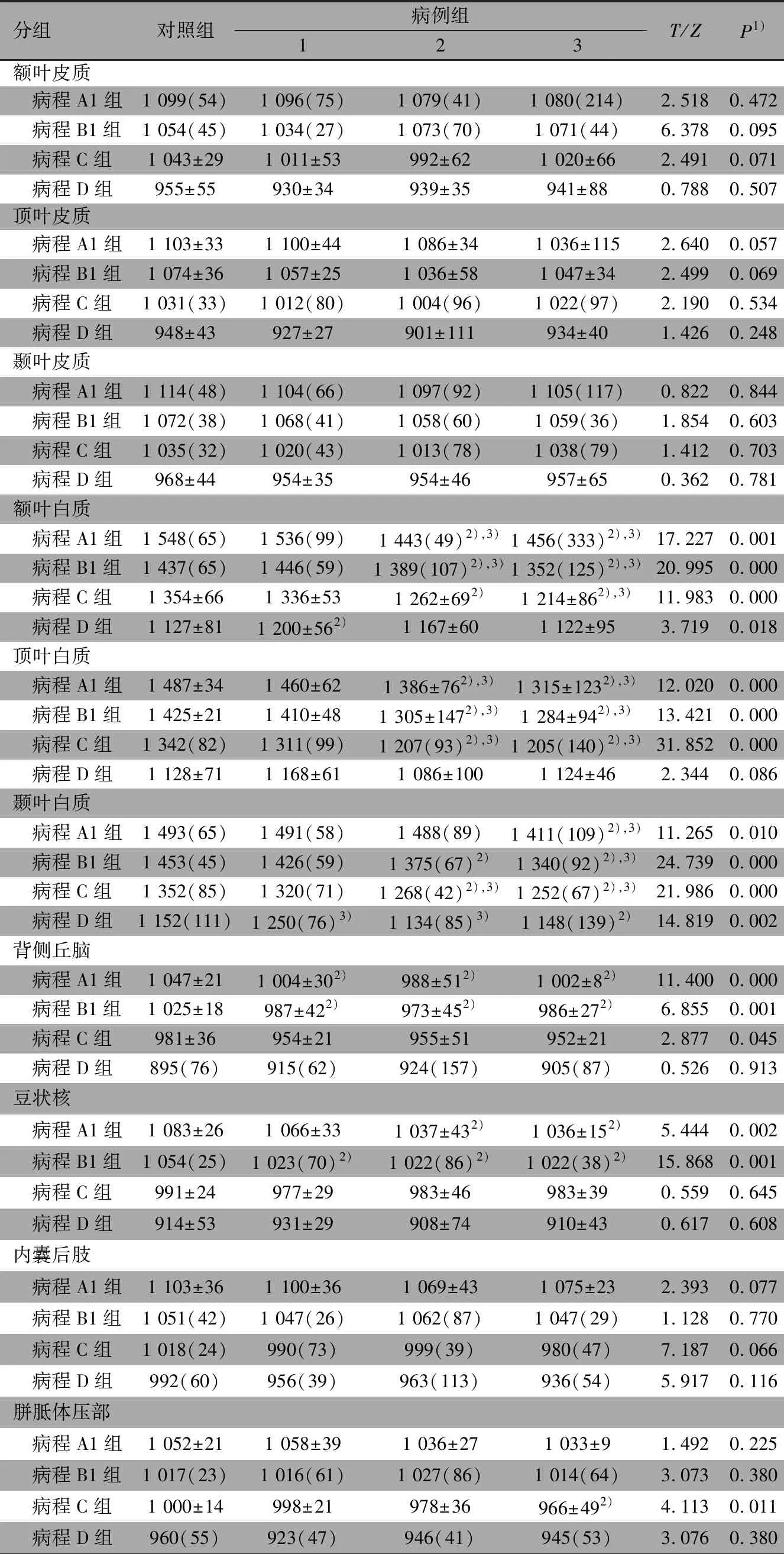
表2 病例组不同病程和/或日龄与相应对照组在脑组织不同分区ADC值比较(×10-6 mm2·s-1)
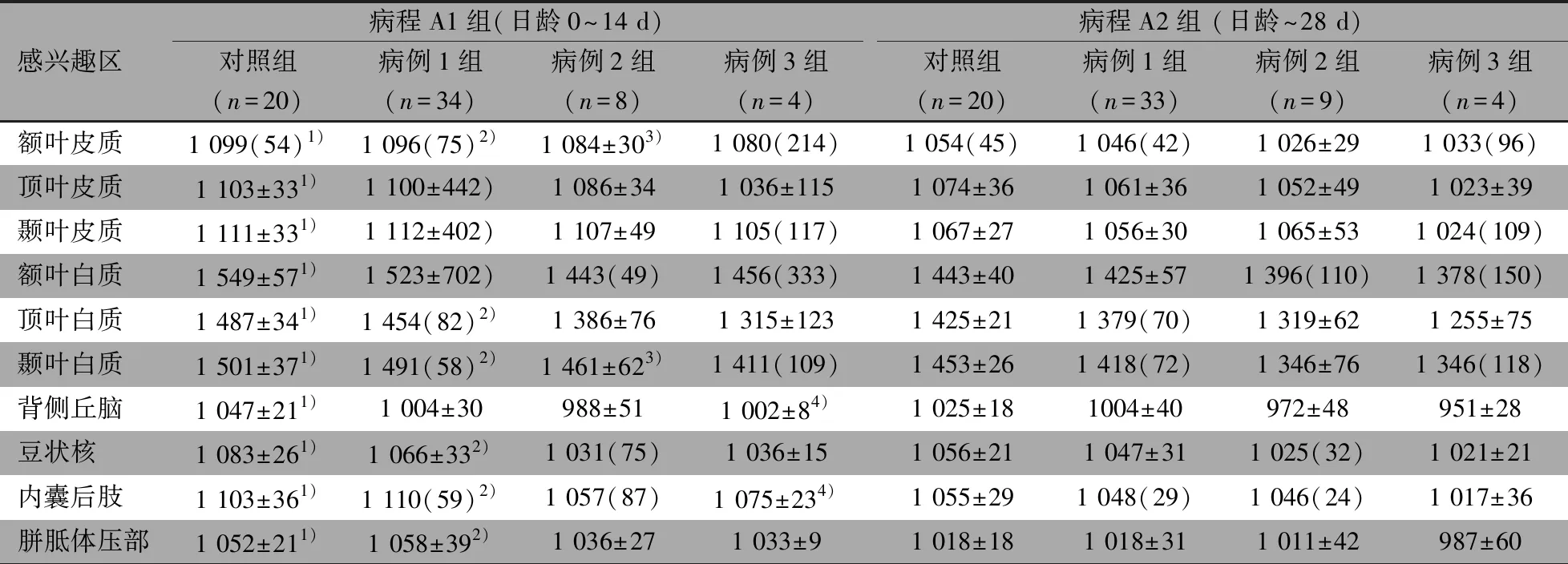
表3 对照组与病例组病程A组的不同日龄(0~14 d vs ~28 d)ADC值比较(×10-6 mm2·s-1)
3 讨论
本研究按照颅脑病变对脑内ADC值的影响程度不同[12-14],对新生儿化脓性脑膜炎进行分组,分析了不同病程脑组织ADC值变化。新生儿化脓性脑膜炎常规MR图像上的正常脑结构区域中,病例2和3组在病程2个月内大脑白质ADC值低于正常对照,差异有统计学意义,病例1组与正常对照组差异无统计学意义;在病程第3~4个月与正常对照组差异无统计学意义,病例1组与正常对照组差异有统计学意义。病例1~3组在病程1个月内大脑深部灰质核团(基底节和丘脑)ADC值低于正常对照,差异有统计学意义,在病程第2~4个月时ADC值与正常对照组,差异无统计学意义。
在新生儿化脓性脑膜炎脑组织正常区域,大脑白质和深部灰质核团ADC值出现不同的变化模式,首先和脑发育有关。正常新生儿脑发育过程中,伴随着髓鞘化进程,脑组织的ADC值呈持续性下降。由于髓鞘化主要发生在大脑白质神经纤维,因此ADC随发育年龄逐渐下降的趋势在大脑白质更为显著。本研究结果显示,不论是对照组或病例1~3组,在4个月观察期内,大脑白质ADC值均呈现明显的下降趋势,符合新生儿大脑白质髓鞘化在出生后快速进展的发育特征[15, 16]。但是同时也发现,病例1组在病程第61~120 d,大脑白质ADC值出现了高于对照组的结果,考虑与新生儿化脓性脑膜炎引起大脑白质髓鞘化进程受阻有关,导致了ADC增高现象。然而,该现象并没有在深部白质中出现,考虑与脑髓鞘化顺序有关,深部白质(内囊后肢、胼胝体压部)在出生前已经进行部分的髓鞘化[17],而顶叶白质髓鞘化发生时间也早于额叶白质、颞叶白质[18, 19],所以对脑膜炎损伤的易感性相对较低。病例2~3组在病程2个月内大脑白质ADC值低于正常对照组,考虑是脑损伤导致ADC值降低[20, 21];在病程3~4个月时,ADC值与正常对照之间无显著差异,可能是一种假正常化表现。在脑组织损伤后的修复过程中,组织水肿减轻,少突胶质细胞增生,组织结构重塑[4, 22, 23],表现为ADC值正常、稍高(髓鞘化延迟和胶质细胞增生)或明显升高(代表脑软化)。
大脑深部核团(基底节和丘脑)的ADC变化规律与大脑白质不同,取决于脑发育和损伤的机制不同。大脑深部核团以脑灰质结构为主,包含了皮质脊髓束等脑白质纤维束。由于该结构脑灰质的容量远远高于白质纤维,因此出生后ADC值本就低于大脑白质。本文结果显示对照组在出生2周内ADC值 [(1 065 ±30)×10-6mm2·s-1],远小于同期对照组大脑白质ADC 值[1 503(69)×10-6mm2·s-1],与文献报道大致相仿[15, 16, 24]。如前所述,出生后大脑白质神经纤维束髓鞘化进展,大脑白质ADC快速下降,本文对照组数据显示大脑白质ADC平均值从出生后的1 503下降到第3~4个月龄时的1 139,下降约24.2%。而对照组深部灰质核团ADC随着年龄增大也出现了下降趋势,但是这种趋势远小于大脑白质,从出生后的1 065下降到第3~4个月龄时的907,下降约14.8%。相比对照组,病例组的深部灰质核团在病程0~30 d ADC值出现了明显降低,可能的机制是疾病导致了供应深部灰质核团的微小动脉发生了供血障碍,深部灰质核团出现了脑细胞肿胀,导致ADC值下降。这一点和HIE导致的深部灰质核团[TBG(丘脑基底节)类型]损伤机制相仿[25, 26]。比较有意思的是,病例1~3组之间深部灰质核团ADC值的差异无统计学意义,说明不管是脑实质损伤灶、脑积水或者是其他对脑内水分子扩散影响不明显的并发症,患儿常规MR大体结构正常的深部灰质核团发生的损伤改变是类似的。随着病程的进展,发现大脑深部灰质核团ADC值与正常对照差异有统计学意义。根据HIE损伤后ADC值出现假正常化机制,这种情况可能是少突胶质细胞增生和脑组织修复的过程。可以推测,随着时间推移,ADC值可能表现为等信号或高信号,其病理基础是神经胶质增生、神经元丢失和皮质脊髓束脱髓鞘,临床上常表现为TBG损伤后运动功能障碍[27]。
本研究聚焦在对常规MR上无显著异常的脑组织行ADC值变化的定量分析,是本研究团队前期研究[1]的进一步推进。之前研究发现,新生儿脑膜炎脑损伤主要出现大脑灰质损伤、大脑白质损伤和非脑实质损伤等并发症,小脑和脑干损伤比较少见。对脑损伤灶进行了半定量分析,统计分析早产儿和足月儿之间的脑损伤差异,以及对新生儿出院结局的影响,发现早产儿脑白质损伤评分高,预示早产儿出院结局不良;而足月儿脑白质损伤评分低,与出院结局不良预后无显著相关性,认为早产儿脑白质对脑膜炎损伤易感性高,可能是因为早产儿脑成熟度不够,白质纤维束髓鞘化不完善。在本文中,通过对比具有相同病程、不同日龄患儿ADC值可以发现,正常对照新生儿因日龄不同(髓鞘化程度不同)而存在的ADC值差异,如文中ADC值(日龄0~14 d)>ADC值(日龄~28 d)>ADC值(日龄~60 d),在脑膜炎患儿中,ADC值差异在缩小,在发病日龄越小的患儿中ADC值降低越明显(尤其是病例2和3组),进一步在足月患儿中证明了髓鞘化程度与脑组织易损性的关系。另外,定量的ADC研究进一步证实了新生儿化脓性脑膜炎不但是早期就影响到白质纤维束(ADC值下降),在随访3~4个月后,也发现了ADC值异常(病例1组发现了ADC值增高),极大可能是影响了白质髓鞘化的进程。
本研究不足之处:①随访时间120 d,未追踪到脑损伤和/或脑积水的最终临床结局。②未对大体损伤进行半定量评分下行ADC值变化规律研究,而是基于常规MR大体上没有发现病变的脑组织,MR DWI定量ADC值可能会提供有参考价值的信息,对于常规MR没有发现显著病灶的新生儿脑膜炎患儿,在出院后随访中,需要重视ADC值量化MR检查对评价脑损伤的潜在价值。
