番石榴4个品种叶和幼果的生物活性和酚类成分研究
2021-12-14吴妙鸿邱珊莲林宝妹张帅洪佳敏郑开斌
吴妙鸿, 邱珊莲*, 林宝妹, 张帅, 洪佳敏, 郑开斌
番石榴4个品种叶和幼果的生物活性和酚类成分研究
吴妙鸿1, 邱珊莲1*, 林宝妹1, 张帅1, 洪佳敏1, 郑开斌2
(1. 福建省农业科学院亚热带农业研究所,福建 漳州 363005;2. 福建省农业科学院科技服务处,福州 350003)
为提高番石榴()副产物的综合利用率,测定了‘珍珠’、‘水蜜’、‘红宝石’和‘西瓜’4个品种叶和幼果提取物中的酚类与黄酮含量,并分析了其与清除DPPH∙、ABTS+、HO·自由基能力和-葡萄糖苷酶抑制活性的相关性,并用超高效液相色谱-串联质谱法(UPLC-MS/MS)分析了提取物的酚类成分。结果表明,4个番石榴品种叶的酚类和黄酮含量、清除自由基能力、-葡萄糖苷酶抑制活性均显著高于幼果,‘珍珠’叶的酚类含量最高,生物活性最强。酚类、黄酮含量与清除自由基能力呈极显著正相关(<0.01),与-葡萄糖苷酶抑制活性呈显著正相关(<0.05)。UPLC-MS/MS鉴定结果表明,4个品种叶酚类含量较高的均为槲皮素-3--葡萄糖苷、金丝桃苷、鞣花酸和杨梅苷,除鞣花酸外大部分存在于叶的酚类成分也存在于幼果中,且含量显著高于幼果。因此,4个品种中,‘珍珠’叶是开发天然抗氧化剂和-葡萄糖苷酶抑制剂的优良资源。
番石榴;叶;幼果;清除自由基;-葡萄糖苷酶抑制;酚类
番石榴(),又名芭乐、拔子、喇叭果、鸡屎果等,为桃金娘科(Myrtaces)番石榴属热带果树,原产于热带美洲[1],在我国广泛种植于海南、云南、广西、广东、福建、台湾等地区。番石榴果实清甜脆爽,香气独特,含有较丰富的蛋白质、维生素A、维生素C等营养物质和磷、钙、镁等微量元素[2],以及果胶、生物碱、类黄酮、三萜类、皂苷等生物活性物质[3–4]。番石榴叶则含有三萜、黄酮、鞣质、倍半萜、挥发油等多种结构类型的化学成分[5–10]。其果、叶具有抗氧化、抗菌、抗腹泻、保肝、降血糖、降血脂、降血压、抗心血管疾病和抗肿瘤等功效[11–14]。
目前,对番石榴功效的研究主要集中于番石榴叶的活性成分和生物活性。Deguchi等[15]的临床试验表明,番石榴叶茶能显著降低糖尿病患者餐后血糖水平、血清中胆固醇和甘油三酯的含量。Pongsak等[16]的研究表明番石榴叶提取物中的黄酮类物质, 如桑色素-3--来苏糖苷、桑色素-3--阿拉伯糖苷、槲皮素-3--阿拉伯糖苷等,对体内肠道细菌的抗菌效果良好。Rizzo等[17]报道,番石榴叶中杂萜类成分guajadial、psidial A、psiguadial A和psiguadial B对抑制小鼠乳腺癌细胞的生长非常有效,且比临床化疗药物对机体的毒性更低。Ojewole[18]的研究表明盐敏感的高血压大鼠在静脉注射番石榴叶提取物后,其血压和心率均显著降低。
番石榴种植过程中因修剪、疏果等措施会产生叶和幼果等副产物,大量的叶和幼果多被种植户丢弃。已有研究表明这2种副产物均具有很高的药用价值,可作为药材。相对于番石榴叶,对幼果的研究还较少,对不同品种及其叶和幼果的活性成分的比较研究更少。本文以4个番石榴品种叶和幼果为研究对象,测定其提取物的酚类和黄酮含量、清除自由基能力和-葡萄糖苷酶抑制活性,并对提取物的酚类成分进行分析,旨在筛选活性较强的番石榴品种及其副产物(叶和幼果),为番石榴充分开发利用提供参考依据。
1 材料和方法
1.1 材料和仪器
材料 番石榴()叶和幼果于2018年10月采自福建省农业科学院亚热带农业研究所闽台种质资源圃。供试品种有‘珍珠’、‘水蜜’、‘红宝石’和‘西瓜’。每个品种随机选取9株健康植株采集健壮叶和谢花后30 d的幼果,每3株叶或幼果混合成1个样品,即每个品种的叶与果实均设3个重复。表儿茶素、槲皮素、根皮苷、杨梅苷、咖啡酸、异阿魏酸、阿魏酸、鞣花酸、金丝桃苷、槲皮素-3--葡萄糖苷标准品购于北京索莱宝科技有限公司,纯度均≥98%。
仪器 Waters Acqutiy UPLC H-Class超高效液相色谱、Xevo TQ-S三重四级杆质谱(美国Waters公司);CR22N高速冷冻离心机(日本HITACHI公司);UPW-20N超纯水机(北京历元电子仪器有限公司); BS110S分析天平(德国Sartorius集团);PC650超声波细胞破碎仪(上海皓庄仪器有限公司); RE-52AA旋转蒸发仪(上海亚荣生化仪器厂); GZX-9246 MBE电热鼓风干燥箱(上海博迅实业有限公司); L5S紫外分光光度计(上海仪电分析仪器有限公司)。
1.2 方法
叶和幼果提取物的制备 将采集的叶和果实(切块)置于60℃烘干,用粉碎机粉碎,过80目筛,将粉末与体积分数60%乙醇按1∶20 (/v)混合, 用超声波破碎仪超声提取30 min,功率为200 W,连续超声时间3 s,超声间隔时间4 s。提取液用高速冷冻离心机5 170×离心15 min,取上清液待测。
酚类、黄酮含量测定 参照Xu等[19]的方法测定。酚类含量测定以没食子酸为标准品,建立线性回归方程=0.0018-0.0032 (0~300g/mL,²=0.999 5),式中,为吸光值,为没食子酸质量浓度(g/mL)。酚类含量以1 g干叶或幼果中所含的相当于没食子酸的质量表示,单位为mg/g。黄酮含量测定以芦丁为标准品,建立线性回归方程=0.0026–0.0047 (0~ 300g/mL,²=0.998 8), 式中,为吸光度值,为芦丁质量浓度(g/mL)。黄酮含量以1 g干叶或幼果中所含的相当于芦丁的质量表示,单位为mg/g。
清除自由基能力测定 参照前人[19–21]的方法测定提取物对DPPH∙、ABTS+、HO∙的清除能力。
-葡萄糖苷酶抑制活性测定 参照邱珊莲等[22]的方法测定。
1.3 UPLC-MS/MS分析酚类成分
色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8m);柱温: 40℃;流速:0.2 mL/min;进样体积:4L;流动相A:5 mmol/L乙酸铵+0.1%甲酸水溶液,流动相B:乙腈,梯度洗脱(洗脱程序:0~5 min, 90%~10% A;5~6 min, 10% A;6~8 min, 10%~50% A;8~9 min, 50%~90%;9~10 min, 90% A)。
质谱条件 离子源:电喷雾离子化源(ESI)正负模式;离子源温度:120℃;扫描方式:多级反应监测(MRM);毛细管电压:3.0 kV (正模式)、1.5 kV (负模式);脱溶剂气温度:500℃(正模式)、450℃(负模式)。质谱参数见表1。
对照品溶液制备和测定 精确称取表儿茶素、槲皮素、根皮苷、杨梅苷、咖啡酸、异阿魏酸、阿魏酸、鞣花酸、金丝桃苷、槲皮素-3--葡萄糖苷标准品,用色谱纯甲醇配制成1.0 mg/mL的对照品储备液。精确量取对照品储备液,用甲醇配制成系列质量浓度梯度为0.5、1.0、2.0、5.0和10.0g/mL的混合对照品溶液。以峰面积()对其质量浓度(,g/mL)进行线性回归,得到回归方程。

表1 对照品的质谱参数和线性关系
供试样品制备 称取8 g叶或幼果粉末,超声提取液在50℃下减压旋蒸除去乙醇,将浓缩液真空冷冻干燥,称量并记录冻干粉质量。准确称取50 mg冻干粉,用甲醇定容到50 mL,配制成1 mg/mL的溶液,过0.22m有机相滤膜,取滤液待测。
1.4 数据处理
试验数据采用Excel 2007进行线性回归分析;采用SPSS 22.0统计软件进行相关性和单因素方差分析,<0.05表示差异显著,<0.01表示差异极显著;采用OriginPro 8.6软件作图。
2 结果和分析
2.1 提取物中酚类与黄酮含量
4个番石榴品种叶的酚类、黄酮含量均高于幼果(表2),叶的酚类含量为148.08~165.98 mg/g,幼果为15.98~34.85 mg/g;叶黄酮含量为90.33~99.30 mg/g,幼果为9.27~25.03 mg/g。叶酚类含量依次为‘珍珠’>‘红宝石’>‘水蜜’>‘西瓜’,‘珍珠’和‘红宝石’间无显著差异,但显著高于‘水蜜’和‘西瓜’;幼果酚类含量依次为‘红宝石’>‘珍珠’>‘水蜜’>‘西瓜’,‘红宝石’显著高于其余3个品种。叶黄酮含量依次为‘红宝石’>‘水蜜’> ‘珍珠’>‘西瓜’,‘红宝石’和‘水蜜’间无显著差异,但显著高于‘珍珠’和‘西瓜’;幼果黄酮含量依次为‘红宝石’>‘珍珠’>‘水蜜’>‘西瓜’,‘红宝石’显著高于其余3个品种。‘珍珠’和‘红宝石’叶的酚类和黄酮含量优势明显,‘红宝石’幼果的酚类和黄酮含量优势明显。

表2 番石榴叶和幼果的酚类和黄酮含量
同列数据后不同字母表示差异显著(<0.05)。下表同。
Data followed different letters within column indicated significant difference at 0.05 level.The same is following Tables.
2.2 对DPPH∙的清除能力
在0.05~0.40 mg/mL范围内,4个番石榴品种叶和幼果提取物对DPPH∙的清除率与提取物质量浓度成线性量效关系(表3)。叶提取物对DPPH∙的清除能力均显著高于幼果,清除能力表现为‘珍珠’>‘红宝石’>‘西瓜’>‘水蜜’,‘珍珠’与‘红宝石’间无显著差异,‘珍珠’显著高于‘水蜜’和‘西瓜’;幼果提取物对DPPH∙的清除能力表现为‘红宝石’>‘珍珠’>‘水蜜’>‘西瓜’,与幼果的酚类和黄酮含量的变化规律一致,幼果对DPPH∙的清除能力在品种间均存在显著差异,‘红宝石’幼果有显著优势。‘珍珠’叶提取物对DPPH∙的清除能力最强。
2.3 对ABTS+的清除能力
在0.10~0.50 mg/mL范围内,4个番石榴品种叶和幼果提取物对ABTS+的清除率与提取物质量浓度成线性量效关系(表3)。叶提取物对ABTS+的清除能力均显著高于幼果,清除能力表现为‘珍珠’>‘红宝石’>‘西瓜’>‘水蜜’,‘珍珠’与‘红宝石’间无显著差异;幼果提取物对ABTS+的清除能力表现为‘红宝石’>‘珍珠’>‘水蜜’>‘西瓜’,品种间均存在显著差异。‘珍珠’叶提取物对ABTS+的清除能力最强。
2.4 对HO∙的清除能力
在0.10~0.50 mg/mL范围内,4个品种番石榴叶和幼果对HO∙的清除率与提取物质量浓度成线性量效关系(表3)。叶提取物对HO∙的清除能力均显著高于幼果,清除能力为‘珍珠’>‘红宝石’>‘水蜜’> ‘西瓜’;幼果提取物对HO∙的清除能力为‘红宝石’> ‘珍珠’>‘水蜜’>‘西瓜’。8个样品中,‘珍珠’叶提取物对HO∙的清除能力最强。
2.5 对α-葡萄糖苷酶的抑制作用
4个番石榴品种叶和幼果提取物质量浓度与抑制率均呈对数函数关系,呈抛物线形曲线(表4)。根据IC50可知,4个品种叶和幼果提取物对-葡萄糖苷酶的抑制活性均高于阳性对照组阿卡波糖(IC50为3 133.47g/mL),叶提取物显著高于幼果,叶提取物的抑制活性表现为‘珍珠’>‘水蜜’>‘西瓜’>‘红宝石’,白肉番石榴高于红肉;幼果提取物表现为‘红宝石’>‘西瓜’>‘珍珠’>‘水蜜’,红肉番石榴显著高于白肉。‘珍珠’叶提取物的抑制活性最强。
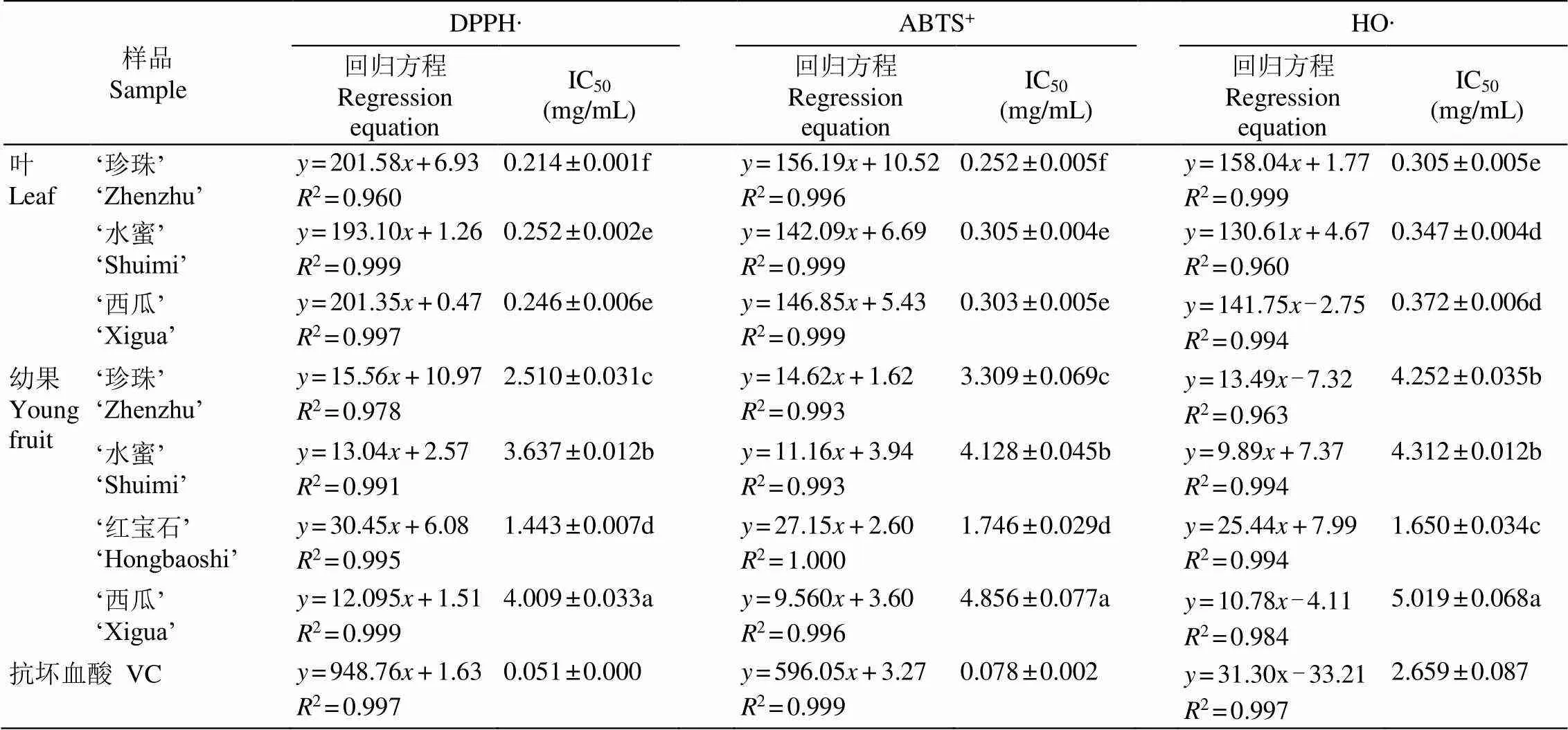
表3 番石榴叶和幼果提取物的清除自由基能力
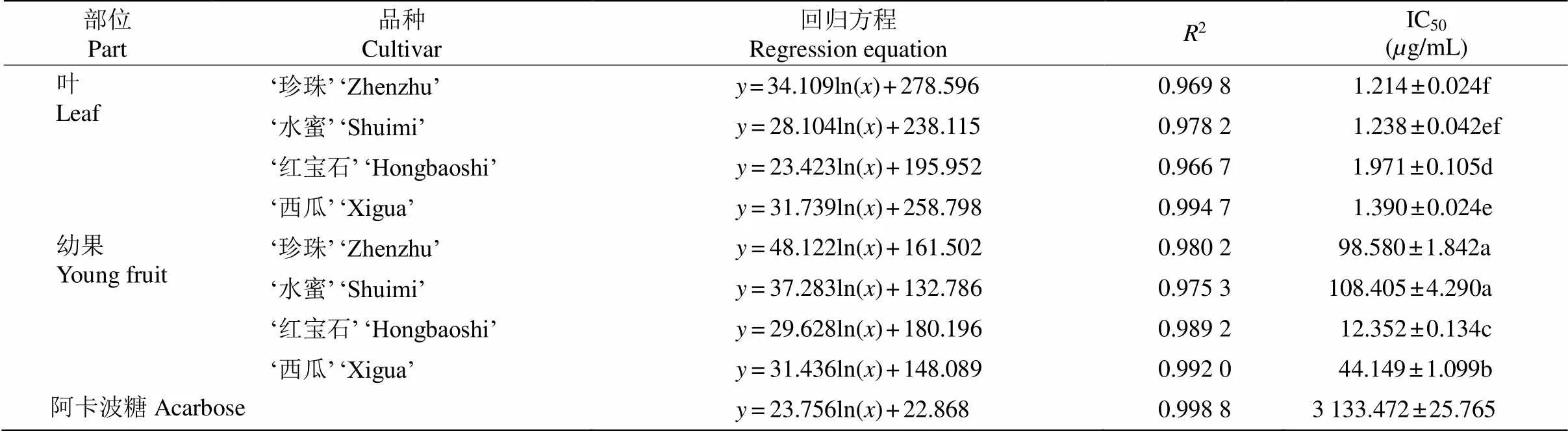
表4 番石榴叶和幼果提取物对α-葡萄糖苷酶的抑制活性
2.6 相关性分析
从表5可见,番石榴叶和幼果的酚类、黄酮含量与清除DPPH∙、ABTS+、HO∙能力均呈极显著的正相关性(<0.01, 0.909 5≤≤0.920 0;<0.01, 0.9219≤≤0.931 8),与-葡萄糖苷酶抑制活性具有显著的正相关性(<0.05,=0.787 0;<0.05,=0.804 1)。
2.7 酚类成分分析
10种对照品的UPLC-MS/MS总离子流图见图1。对4个番石榴品种叶和幼果提取物的酚类成分进行测定,所含的酚类成分相似,但含量存在差异(表6)。‘珍珠’和‘水蜜’叶中主要酚类成分含量为槲皮素- 3-O-葡萄糖苷>金丝桃苷>鞣花酸>杨梅苷; ‘红宝石’叶为槲皮素-3-O-葡萄糖苷>杨梅苷>金丝桃苷>鞣花酸;‘西瓜’叶为槲皮素-3--葡萄糖苷>金丝桃苷>杨梅苷>鞣花酸。‘珍珠’幼果中主要酚类成分含量为杨梅苷>根皮苷>槲皮素-3-O-葡萄糖苷>金丝桃苷;‘水蜜’幼果为根皮苷>表儿茶素>槲皮素-3-O-葡萄糖苷>金丝桃苷;‘红宝石’幼果为根皮苷>表儿茶素>杨梅苷>金丝桃苷;‘西瓜’幼果为槲皮素-3-O-葡萄糖苷>金丝桃苷>杨梅苷>表儿茶素。可见,除根皮苷外,叶的各酚类成分含量均显著高于幼果。

表5 番石榴叶和幼果中酚类、黄酮含量与生物活性的相关性
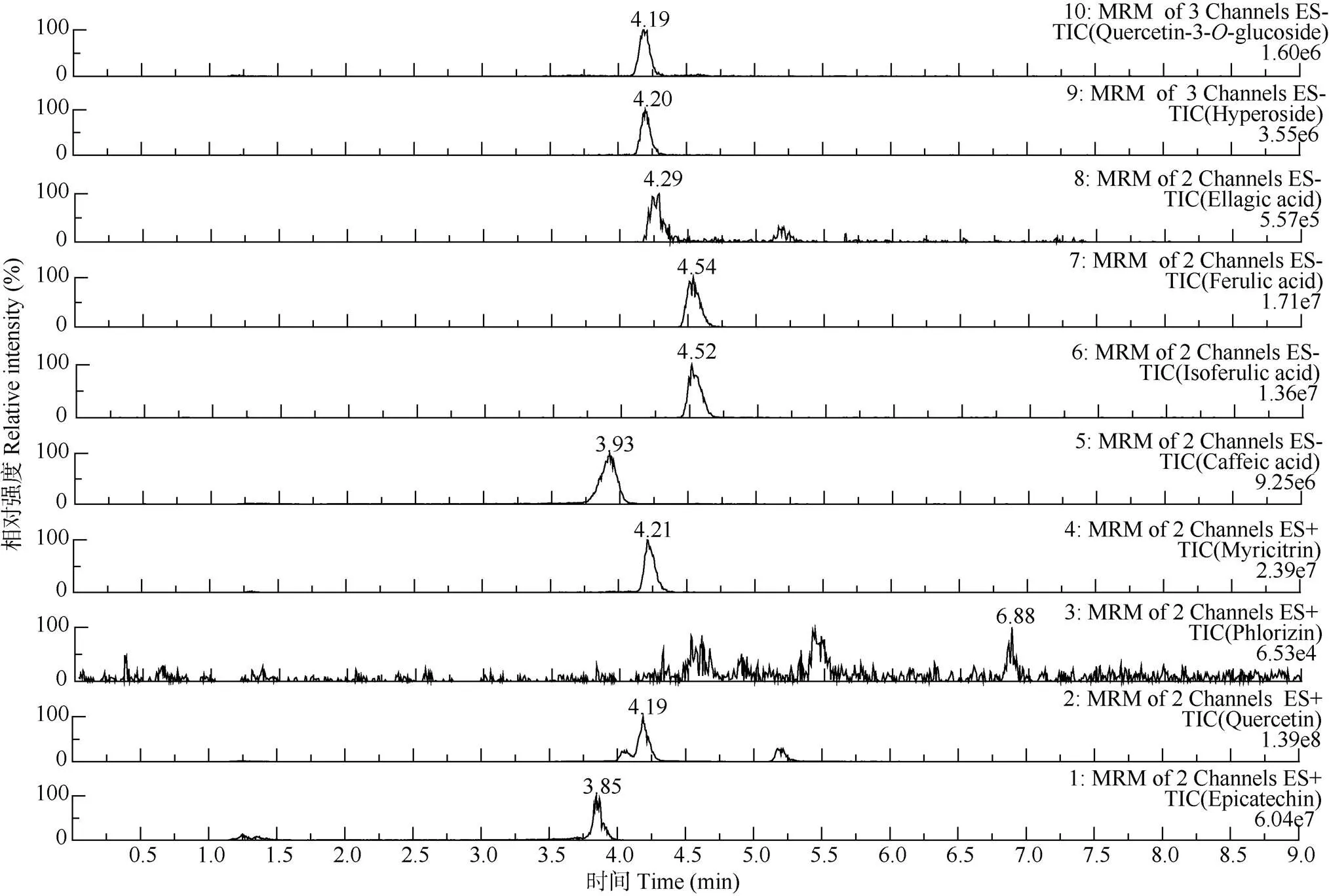
图1 10种对照品(2 μg/mL)的UPLC-MS/MS总离子流图

表6 番石榴叶和幼果提取物中的酚类组分含量(mg/kg)
-: 未检出。
-: Not detected.
3 结论和讨论
3.1 叶和幼果间酚类、黄酮含量差异
酚类和黄酮是抗氧化和降血糖的重要活性物质。从广泛性来说,黄酮类物质属于酚类中的一员,但其具有C6-C3-C6的特殊分子结构[23]。已有研究表明番石榴叶和果中均含有酚类和黄酮类物质,但不同品种及不同部位间的含量差异较大。郑必胜等[24]报道广东主栽的‘红心番石榴’的酚类、黄酮含量和抗氧化活性显著高于‘珍珠’、‘白玉珍珠’和‘胭脂红’品种,且果皮中的含量远高于果肉。侯峰[25]报道广州地区番石榴叶中黄酮含量为73.5~133.4 mg/g, 平均100.5 mg/g;幼果8.6~12.3 mg/g,平均9.9 mg/g,叶中黄酮含量约是幼果的10倍。本文测定了4个番石榴品种叶和幼果的酚类和黄酮含量,结果表明不同品种间、叶与幼果间的酚类和黄酮含量均具有显著差异。UPLC-MS/MS分析结果表明4个番石榴品种的叶提取物中主要酚类成分均为槲皮素-3--葡萄糖苷、金丝桃苷、杨梅苷、鞣花酸。‘珍珠’、‘水蜜’、‘红宝石’幼果提取物中主要酚类成分为根皮苷、表儿茶素、槲皮素-3--葡萄糖苷、金丝桃苷、杨梅苷,而‘西瓜’幼果提取物不含根皮苷。槲皮素- 3--葡萄糖苷、金丝桃苷、杨梅苷是叶和幼果共有的主要酚类成分,而鞣花酸则为叶片特有的酚类成分,在幼果中未检出。根皮苷是‘珍珠’、‘水蜜’和‘红宝石’幼果的主要酚类成分,也是10种酚类成分中唯一1种在幼果中的含量高于叶片的成分。番石榴叶中大部分酚类成分的含量均显著高于幼果。
3.2 酚类、黄酮含量与清除自由基能力、α-葡萄糖苷酶抑制活性的关系

4个番石榴品种叶提取物的酚类和黄酮含量、清除自由基能力、-葡萄糖苷酶抑制活性均显著高于幼果。叶提取物酚类成分均包含表儿茶素、槲皮素、根皮苷、杨梅苷、咖啡酸、异阿魏酸、阿魏酸、鞣花酸、金丝桃苷、槲皮素-3--葡萄糖苷。除鞣花酸外,大部分存在于叶中的酚类在幼果中也有检出,叶酚类成分的含量均明显高于幼果(根皮苷除外)。4个品种中,‘珍珠’叶酚类含量最高,提取物对DPPH·、HO·、ABTS+等3种自由基的清除能力和对-葡萄糖苷酶抑制活性最强,因此,‘珍珠’番石榴叶用于开发抗氧化剂及-葡萄糖苷酶抑制剂最具优势。
[1] HONG J M, LIN B M, ZHANG C K, et al. Antioxidant capacity and- glucosidase inhibitory activity of ethanol extracts from guava fruits [J]. J NW Agric For Univ (Nat Sci), 2019, 47(1): 139–146. doi: 10.13207/ j.cnki.jnwafu.2019.01.017.
洪佳敏, 林宝妹, 张朝坤, 等. 番石榴醇提物抗氧化能力及-葡萄糖苷酶抑制活性研究 [J]. 西北农林科技大学学报(自然科学版), 2019, 47(1): 139–146. doi: 10.13207/j.cnki.jnwafu.2019.01.017.
[2] DAKAPPA S S, ADHIKARI R, TIMILSINA S S, et al. A review on the medicinal plantLinn. (Myrtaceae) [J]. J Drug Deliv Ther, 2013, 3(2): 162–168.
[3] CHAUHAN A K, SINGH S, SINGH R P, et al. Guava-enriched dairy products: A review [J]. Ind J Dairy Sci, 2015, 68(1): 1–5.
[4] JOSEPH B, PRIYA M. Review on nutritional, medicinal and phar- macological properties of guava (Linn.) [J]. Int J Pharma Bio Sci, 2011, 2(1): 53–69.
[5] SESHADRI T R, VASISHTA K. Polyphenols of the leaves of: Quercetin, guaijaverin, leucocyanidin and amritoside [J]. Phyto- chemistry, 1965, 4(6): 989–992. doi: 10.1016/S0031-9422(00)86281-0.
[6] ARIMA H, DANNO G I. Isolation of antimicrobial compounds from guava (L.) and their structural elucidation[J]. Biosci Biotechnol Biochem, 2002, 66(8): 1727–1730. doi: 10.1271/bbb.66. 1727.
[7] BEGUM S, HASSAN S I, SIDDIQUI B S, et al. Triterpenoids from the leaves of[J]. Phytochemistry, 2002, 61(4): 399–403. doi: 10.1016/S0031-9422(02)00190-5.
[8] BEGUM S, HASSAN S I, SIDDIQUI B S. Two new triterpenoids from the fresh leaves of[J]. Planta Med, 2002, 68(12): 1149–1152. doi: 10.1055/s-2002-36353.
[9] BEGUM S, HASSAN S I, ALI S N, et al. Chemical constituents from the leaves of[J]. Nat Prod Res, 2004, 18(2): 135–140. doi: 10.1080/14786410310001608019.
[10] PARK B J, MATSUTA T, KANAZAWA T, et al. Phenolic compounds from the leaves of: I. hydrolysable tannins and benzophenone glycosides [J]. Chem Nat Compd, 2011, 47(4): 632–635. doi: 10.1007/s10600-011-0015-1.
[11] FU L, LU W Q, ZHOU X M. Phenolic compounds andanti- bacterial and antioxidant activities of three tropic fruits: Persimmon, guava, and sweetsop [J/OL]. BioMed Res Int, 2016, 2016: 4287461. doi: 10.1155/2016/4287461.
[12] DIVYA N, ILAVENIL S. Hypoglycemic and hypolipidemic potentials ofin alloxan induced diabetic rats [J]. Res J Pharm Technol, 2012, 5(1): 125–128.
[13] QIN X J, YU Q, YAN H, et al. Meroterpenoids with antitumor acti- vities from guava () [J]. J Agric Food Chem, 2017, 65 (24): 4993–4999. doi: 10.1021/ACS.JAFC.7B01762.
[14] GUTIÉRREZ R M P, MITCHELL S, SOLIS R V.: A review of its traditional uses, phytochemistry and pharmacology [J]. J Ethnopharmacol, 2008, 117(1): 1–27. doi: 10.1016/j.jep.2008.01.025.
[15] DEGUCHI Y, OSADA K, CHONAN O, et al. Effectiveness of conse- cutive ingestion and excess intake of guava leaves tea in human volunteers [J]. J Jpn Counc Adv Food Ingred Res, 2000, 3(1): 19–28.
[16] RATTANACHAIKUNSOPON P, PHUMKHACHORN P. Contents and antibacterial activity of flavonoids extracted from leaves of[J]. J Med Plants Res, 2010, 4(5): 393–396. doi: 10.5897/ JMPR09.485.
[17] RIZZO L Y, LONGATO G B, RUIZ AL TG, et al.andanalysis of the anticancer and estrogen-like activity of guava leaf extracts [J]. Curr Med Chem, 2014, 21(20): 2322–2330. doi: 10. 2174/0929867321666140120120031.
[18] OJEWOLE J A O. Hypoglycemic and hypotensive effects ofLinn. (Myrtaceae) leaf aqueous extract [J]. Methods Find Exp Clin Pharmacol, 2005, 27(10): 689–696. doi: 10.1358/mf.2005.27.10. 948917.
[19] XU J G, TIAN C R, HU Q P, et al. Dynamic changes in phenolic compounds and antioxidant activity in oats (L.) during steeping and germination [J]. J Agric Food Chem, 2009, 57(21): 10392– 10398. doi: 10.1021/jf902778j.
[20] HU Q P, XU J G. Profiles of carotenoids, anthocyanins, phenolics, and antioxidant activity of selected color waxy corn grains during maturation [J]. J Agric Food Chem, 2011, 59(5): 2026–2033. doi: 10. 1021/jf104149q.
[21] CAO Y, PANG S B, XU L, et al. Antioxidant activities ofextracts[J]. Chin J Exp Tradit Med Formulae, 2011, 17(12): 144–147. doi: 10.3969/j.issn.1005-9903.2011.12.041.
曹燕, 庞市宾, 徐磊, 等. 金鸡菊提取物体外抗氧化活性[J]. 中国实验方剂学杂志, 2011, 17(12): 144–147. doi: 10.3969/j.issn.1005- 9903.2011.12.041.
[22] QIU S L, LIN B M, ZHENG K B, et al. Antioxidative activity and-glucosidase inhibitory activity of ethanol extracts of leaves of different cultivars of jaboticaba [J]. J Fruit Sci, 2017, 34(11): 1450– 1457. doi:10.13925/j.cnki.gsxb.20170141.
邱珊莲, 林宝妹, 郑开斌, 等. 不同品种树葡萄叶片醇提物抗氧化及抑制-葡萄糖苷酶活性研究 [J]. 果树学报, 2017, 34(11): 1450– 1457. doi:10.13925/j.cnki.gsxb.20170141.
[23] VALLS J, MILLÁN S, MARTÍ M P, et al. Advanced separation methods of food anthocyanins, isoflavones and flavanols [J]. J Chro- matogr A, 2009, 1216(43): 7143–7172. doi: 10.1016/j.chroma.2009. 07.030.
[24] ZHENG B S, CAO S, ZHONG W. Analysis of phenolic compounds and antioxidation in different cultivar guavas [J]. Food Sci Technol, 2014, 39(12): 225–230. doi: 10.13684/j.cnki.spkj.2014.12.048.
郑必胜, 曹双, 钟伟. 不同品种番石榴的酚类物质及抗氧化活性[J]. 食品科技, 2014, 39(12): 225–230. doi: 10.13684/j.cnki.spkj.2014. 12.048.
[25] HOU F. Development research on hypoglycemic components in leaves and unripe fruits of[D]. Guangzhou: South China University of Technology, 2011: 22.
侯峰. 番石榴叶和幼果降糖成分开发研究[D]. 广州: 华南理工大学, 2011: 22.
[26] CHEN H Y, YEN G C. Antioxidant activity and free radical-scavenging capacity of extracts from guava (L.) leaves [J]. Food Chem, 2007, 101(2): 686–694. doi: 10.1016/J.FOODCHEM.2006.02.047.
[27] CAO S. Antioxidant and antitumor activities of phenolics from guava (L.) [D]. Guangzhou: South China University of Technology, 2015: 46–47.
曹双. 番石榴酚类物质抗氧化和抗肿瘤活性研究[D]. 广州: 华南理工大学, 2015: 46–47.
[28] LIN B M, ZHENG K B, ZHANG S, et al. Studies on antioxidant and-glucosidase inhibitory activities of ethanol extracts from peels and seeds of jaboticaba at different maturities [J]. J Trop Subtrop Bot, 2018, 26(3): 233–240. doi: 10.11926/jtsb.3831.
林宝妹, 郑开斌, 张帅, 等. 不同成熟度树葡萄果实醇提取物抗氧化和抑制-葡萄糖苷酶活性研究[J]. 热带亚热带植物学报, 2018, 26(3): 233–240. doi: 10.11926/jtsb.3831.
[29] LUO G H, WANG A G. The scavenging effect of plant polyphenolics on superoxide radicals [J]. J Trop Subtrop Bot, 1994, 2(4): 95–99.
罗广华, 王爱国. 植物中的多酚物质对超氧物自由基的清除作用[J]. 热带亚热带植物学报, 1994, 2(4): 95–99.
[30] MA X W, WU H X, LIU L Q, et al. Polyphenolic compounds and antioxidant properties in mango fruits [J]. Sci Hort, 2011, 129(1): 102– 107. doi: 10.1016/j.scienta.2011.03.015.
[31] MEYER A S, YI O S, PEARSON D A, et al. Inhibition of human low- density lipoprotein oxidation in relation to composition of phenolic antioxidants in grapes () [J]. J Agric Food Chem, 1997, 45(5): 1638–1643. doi: 10.1021/jf960721a.
[32] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products [J]. J Agric Food Chem, 1998, 46(10): 4113–4117. doi: 10.1021/jf9801973.
[33] ZHANG H J, JIA D Y, SUN H, et al. Inhibitory effect of polyphenol extract from pomegranate peel and its purified fractions on-gluco- sidase activity [J]. Nat Prod Res Dev, 2012, 24(9): 1253–1256. doi: 10.3969/j.issn.1001-6880.2012.09.023.
张海均, 贾冬英, 孙慧, 等. 石榴皮多酚提取物及纯化物对-葡萄糖苷酶的抑制作用研究[J]. 天然产物研究与开发, 2012, 24(9): 1253– 1256. doi: 10.3969/j.issn.1001-6880.2012.09.023.
[34] LIU Y L, YANG W K, LIU H S, et al. Inhibitory effects of the poly- phenol extracts from Chinese bayberry on-glucosidase[J]. J Fruit Sci, 2016, 33(1): 59–65. doi: 10.13925/j.cnki.gsxb.20150211.
柳余莉, 杨文康, 刘合生, 等. 杨梅多酚粗提物对-葡萄糖苷酶体外抑制作用的研究[J]. 果树学报, 2016, 33(1): 59–65. doi: 10.13925/ j.cnki.gsxb.20150211.
[35] LIU J C, JIAO Z G, WANG S X. Inhibitory effects of apple polyphenol extracts on-amylase and-glucosidase [J]. J Fruit Sci, 2011, 28(4): 553–557. doi: 10.13925/j.cnki.gsxb.2011.04.003.
刘杰超, 焦中高, 王思新. 苹果多酚提取物对-淀粉酶和-葡萄糖苷酶的抑制作用[J]. 果树学报, 2011, 28(4): 553–557. doi: 10.13925/ j.cnki.gsxb.2011.04.003.
Biological Activities and Phenolic Constituents in Extracts from Leaves and Young Fruits of Four Guava Cultivars
WU Miaohong1, QIU Shanlian1*, LIN Baomei1, ZHANG Shuai1, HONG Jiamin1, ZHENG Kaibin2
(1. Institute of Subtropical Agriculture, Fujian Academy of Agricultural Sciences,Zhangzhou 363005, Fujian, China; 2. Institute of Technology Services, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China)
In order to improve the comprehensive utilization rate of the by-products of guava (), the biological activities and phenolic constituents of extracts from 4 cultivars (‘Zhenzhu’, ‘Shuimi’, ‘Hongbaoshi’, ‘Xigua’) of guava were studied. The contents of total phenols and flavonoids were determined, then the correlations between the contents of phenols and flavonoids with biological activities were analyzed, including the scavenging abilities on DPPH∙, ABTS+, HO∙ free radicals, and the-glucosidase inhibitory activity. Furthermore, thephenolic constituents of extracts were identified by ultra-high performance liquid chromatography and the triple-quadrupole tandem mass spectrometry (UPLC-MS/MS). The results showed that the contents of total phenols and flavonoids, the free radicals scavenging abilities and-glucosidase inhibitory activity in leaves of 4 cultivars were significantly higher than those in young fruits, ‘Zhenzhu’ leaf had the highest content of total phenols as well as the most potent free radicals scavenging abilities and-glucosidase inhibitory activity. Correlation analysis revealed that the contents of phenols and flavonoids were significantly positively correlated with the scavenging abilities towards DPPH∙, ABTS+, HO∙ free radicals (<0.01), as well as the-glucosidase inhibitory activity (<0.05). UPLC-MS/MS analysis showed that the contents of quercetin-3--glucoside, hyperoside, ellagic acid and myricitrin in leaves of 4 cultivars were high, and most of the constituents found in leaves except ellagic acid also existed in the young fruits, and the contents in leaves were higher than those in young fruits. Therefore, ‘Zhenzhu’ guava leaf could be a good resource for developing natural antioxidant and-glucosidase inhibitor among 4 cultivars.
Guava; Leaf; Young fruit; Free radical scavenging ability;-Glucosidase inhibition; Phenol
10.11926/jtsb.4416
2021-03-22
2021-06-08
福建省自然科学基金项目(2020J011369);福建省科技计划公益类专项(2019R1030-4)资助
This work was supported by the Project for Natural Science in Fujian (Grant No. 2020J011369), and the Special Project for Public Welfare for Research Institute in Fujian (Grant No. 2019R1030-4).
吴妙鸿(1991~ ),女,研究实习员,研究方向为天然产物提取与利用。E-mail: miaohongwu@qq.com
通信作者 Corresponding author. E-mail: slqiu79@163.com
