益智不同组织多糖含量及其生物合成途径分析
2021-12-14俞振明赵聪慧张明泽何春梅司灿曾丹琦段俊
俞振明, 赵聪慧, 张明泽, 何春梅, 司灿, 曾丹琦, 段俊
益智不同组织多糖含量及其生物合成途径分析
俞振明, 赵聪慧, 张明泽, 何春梅, 司灿, 曾丹琦, 段俊*
(中国科学院华南植物园, 广东省应用植物学重点实验室, 中国科学院华南农业植物分子分析与遗传改良重点实验室, 广州 510650)
为了解益智()多糖生物合成途径关键酶功能,对其茎、叶、果实中的多糖含量及其单糖组成进行了研究,并采用Real-Time qPCR分析了益智多糖生物合成关键酶基因的表达模式。结果表明,益智多糖含量依次为果实>叶>茎,主要由葡萄糖、木糖、甘露糖、半乳糖和阿拉伯糖组成;利用益智转录组数据共获得47 690条unigenes,其中31 892条在NR、Swiss-Prot、KEGG、COG、KOG、GO和Pfam数据库获得注释,其中208个unigenes参与益智多糖的生物合成,涉及15个酶。表达分析表明,所筛选的18个基因在茎、叶、果实中均有表达,14个基因在果实中的表达量最高,以糖基转移酶基因和UDP-葡萄糖焦磷酸化酶基因的表达量最高,且其表达模式与不同组织中葡萄糖含量的变化一致。
益智;多糖;转录组;糖基转移酶
益智()为姜科(Zingiberaceae)多年生草本植物,是一味药食同源的植物,其干燥成熟果实可入药,主产于广东、广西、海南等地,与槟榔()、砂仁()、巴戟天()并称为我国“四大南药”。中医认为益智味辛、性温,在《神农本草经》、《本草纲目》等经典专著中均有记载,具有暖肾固精缩尿,温脾止泻摄唾的功效[1]。长期以来,益智野生资源日趋减少,作为保健品和中成药的主要原料不断被采挖,还广泛用于休闲食品(如蜜饯、凉果等)制作,优质益智种质培育是益智产业健康发展的关键内容。但在实际生产过程中,益智品种培育滞后,优良种质不断退化,严重阻碍了益智品质的提升[2]。因此,为提升益智品质,亟需开展益智有效成分合成途径及调控机制的研究,进而指导益智优良品种选育和科学生产。
益智营养丰富,主要含有倍半萜类和二苯基庚烷类挥发油、黄酮和多糖等活性物质[3–5],然而有关其多糖的研究尚不多见。多糖是益智仁中的一类重要活性成分,具有抗氧化、调节人体免疫、抑制肿瘤生长等多种功效[6–8]。按照多糖中单糖的组成,可分为均一性多糖和不均一性多糖[9–10]。在多糖的结构特征、理化性质及构效关系的研究中,单糖组成分析是基础性和关键性的环节。尽管不同来源的多糖结构复杂,但都是由常见的单糖重复单元组成,它们的生物合成途径相对一致,一般包括核苷酸糖合成与转运,以及由糖基转移酶参与的多糖链的起始、延伸、聚合与终止[11–13]。作为影响益智品质的关键成分,目前研究主要集中在益智果实的营养成分、化学成分、药理活性等方面[3–5,14],而对于活性物质的生物合成途径及其代谢关键酶基因的报道鲜少。因此,厘清益智多糖生物合成途径将对益智品质生产提供理论依据,也为深入挖掘多糖生物合成途径的关键基因奠定基础。
鉴于此,本研究以益智为研究材料,基于转录组测序数据,从分子水平上推断益智多糖的生物合成途径,重点挖掘参与益智多糖生物合成途径中的关键酶基因,及其在益智茎、叶和果实中的差异表达情况,为益智品质遗传工程改良和良种选育提供理论参考依据。
1 材料和方法
1.1 材料
益智()采集自广东农垦热带农业研究院种植基地,于2020年6月采收,分开茎、叶和果实,用液氮速冻后,置于–80℃冰箱保存备用,用于多糖生物合成途径关键酶基因的组织表达分析。以上材料由广东农垦热带农业研究院梁秋玲提供。
1.2 多糖含量测定
将益智的茎、叶和果实分别洗净、晾干,105℃杀青2 h,80℃烘干。取适量样品粉碎后过50目筛,装入自封袋并标记信息,贮存于干燥器中。参照Yu等[15]的方法测定多糖含量,精确称量样品0.25 g,经石油醚80℃回流2 h脱脂后,回收石油醚,残渣挥干溶剂加入50 mL蒸馏水,置沸水浴中提取4 h,冷却至室温后过滤,滤液转移至50 mL容量瓶中,定容,即为多糖待测液。精确量取100g/mL的葡萄糖标准溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL,分别加入10 mL具塞试管中,用蒸馏水补足至2 mL, 混匀后加入新鲜配制的5%重蒸苯酚溶液1 mL,涡旋振荡混匀,缓慢加入98.04%浓硫酸5 mL,盖上玻璃塞,涡旋振荡混匀后,置于沸水浴中反应20 min。反应结束冷却至室温,测定488 nm处的吸光值, 以吸光值为横坐标,葡萄糖含量为纵坐标,绘制葡萄糖标准曲线(=198.55+1.23,2=0.999 3)。精确量取0.2 mL多糖待测液,置于10 mL具塞试管中, 用蒸馏水补足至2 mL,按照绘制葡萄糖标准曲线的方法,测定488 nm处的吸光值,从标准曲线上得出待测液中葡萄糖含量,计算益智多糖含量。
1.3 单糖组成分析
益智多糖中的单糖组成采用酸水解法[16]确定。精确量取4 mL多糖待测液,加入2 mol/mL三氟乙酸6 mL,110℃连续水解8 h,60℃浓缩至干,加入2 mL甲醇,再次蒸干除去多余的三氟乙酸,加入2 mL蒸馏水溶解,过0.22m亲水性滤膜,得多糖水解液。精确量取0.4 mL多糖水解液,加入0.3 mol/mL的NaOH溶液和0.5 mol/mL的PMP (1-苯基-3-甲基-5-吡唑啉酮,M70800,购自Sigma-Aldrich)甲醇溶液各0.4 mL,混匀,于70℃水浴反应100 min。反应结束冷却至室温,加入0.3 mol/mL的HCl溶液0.5 mL,混匀,加入2 mL三氯甲烷洗涤,5 000×室温离心,保留上层,弃下层三氯甲烷,重复3次,过0.22m有机滤膜,备用。
精确量取10L多糖水解液,注入高效液相色谱仪,测定。色谱柱为Ultimate®XB-C18(4.6 mm× 250 mm, 5m)。流动相为乙腈(34998,购自Sigma- Aldrich)和KH2PO4缓冲液(0.1 mol/mL, pH 6.8)= 16∶84,柱温:30℃,波长:210 nm,流速:1 mL/min。以对照品保留时间确定单糖,用峰面积归一化法计算各单糖的含量。
1.4 转录组测序数据分析
下载益智转录组测序数据(NCBI登陆号: PRJNA 559252),剔除转录组数据中含有接头和低质量的reads,获得clean reads。采用Trinity软件进行益智转录本组装和拼接,采用Swiss-Prot、COG、GO、KEGG、KOG、Pfam和NR数据库进行unigenes功能注释,并对已注释的unigenes进行GO分类和富集分析、KEGG代谢通路富集分析。根据注释信息,分析益智多糖生物合成途径,挖掘多糖生物合成的关键酶基因。
1.5 总RNA提取和cDNA第一链合成
采用多糖多酚植物RNA提取试剂盒(0416-50,购自北京华越洋生物科技有限公司)分别提取益智茎、叶和果实的总RNA[17],用超微量紫外可见光分光光度计(Nano DropTM2000c,Thermo Scientific公司)测定总RNA的质量和浓度。按照反转录酶M- MLV试剂盒(M1701,购自Promega公司)进行反转录合成cDNA,所得的cDNA用于多糖生物合成途径关键酶基因的组织表达分析。
1.6 关键酶基因的表达分析
根据多糖生物合成途径关键酶基因序列信息,利用Primer Premier 5.0设计荧光定量PCR引物(表1)。选择益智延伸因子1-(elongation factor 1-alpha,)为内参基因,将茎、叶、果实cDNA的质量浓度定量为200 ng/L。荧光定量PCR仪为Roche Light Cycler 480,操作按照SYBR Green PCR Master Mix试剂盒(北京诺禾致源生物科技有限公司)说明书进行。反应体系总体积为10L:包括SYBR Green PCR Master Mix 5L,上、下游引物各0.4L,cDNA模板1L, ddH2O 3.2L。反应程序为95℃预变性1 min;然后95℃变性15 s,60℃退火30 s,共40个循环。每反应均3次生物学重复。利用2–∆∆CT法[18]计算基因的相对表达量,显著性分析采用SPSS软件的新复极差法(Duncan’s新负极差法),绘图采用Excel软件。
2 结果和分析
2.1 多糖含量和单糖组成
采用苯酚-硫酸法比较了益智茎、叶和果实中的多糖含量,结果表明果实>叶>茎,果实多糖含量是茎的3.21倍、叶的2.22倍,且均达显著差异(< 0.05)(表2)。

表1 PCR引物序列
利用柱前衍生化-HPLC法检测益智多糖中的单糖含量,结果表明,益智不同组织中多糖的组成类似,主要由葡萄糖、木糖、半乳糖、阿拉伯糖和甘露糖组成,以葡萄糖为主。果实中葡萄糖含量为70.04 mg/g,占79.72%,是茎的7.72倍、叶的4.46倍,表明益智多糖是以葡萄糖为主构成的杂多糖。
2.2 转录组数据功能注释
益智转录组数据经Trinity软件组装和拼接后,共获得23.88 Gb Clean Data,包含47 690条unigenes。用BLAST软件将unigenes序列在NR、Swiss-Prot、GO、COG、KOG、Pfam、KEGG数据库中进行比对,有31 892条unigenes获得功能注释,占总序列的66.87%,说明益智转录组测序数据相对可靠。
基于COG数据库注释结果,10 069条unigenes被注释,涉及26个COG分类,其中注释最多的5个分类为“翻译、核糖体结构与生物起源”、“一般功能基因”、“转录后修饰、蛋白翻转及伴随蛋白”、“碳水化合物运输及代谢”和“信号转导机制”(表3)。
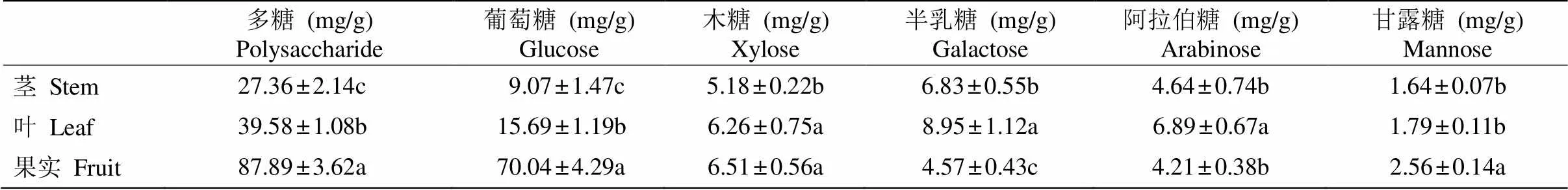
表2 益智多糖和单糖含量
同列数据后不同字母表示差异显著(<0.05)。
Data followed different letters within column indicate significant difference at 0.05 level.

表3 所有序列COG分类和统计
基于GO数据库,将17 699个unigene注释为生物过程、细胞组分、分子功能3类,分别有9 680、8 304和8 562个unigene。基于KEGG数据库(表4), 12 524条序列获得注释,共映射到129条途径,5个主要途径分别为核糖体、碳素代谢、氨基酸生物合成、内质网蛋白质的加工、植物激素的信号转导,分别有833、468、406、382和366个unigene。
2.3 多糖合成途径相关基因鉴定
益智多糖主要由葡萄糖、木糖、半乳糖、阿拉伯糖、甘露糖等单糖组成,并以葡萄糖为主(表2)。本研究挖掘得到果糖和甘露糖代谢(ko00051)、淀粉和蔗糖代谢(ko00500)、半乳糖代谢(ko00052)、磷酸戊糖途径(ko00030)、戊糖、氨基糖和核苷酸糖代谢(ko00520)等5条多糖相关代谢途径,共有897个unigenes参与,其中208个unigenes编码18个关键酶(包括核苷酸糖合成酶、糖基转移酶和多糖合成调节酶),据此推断益智多糖的生物合成途径。由光合作用生成的蔗糖在蔗糖合成酶(SS)作用下催化生成果糖和第一类核苷酸糖UDP-葡萄糖。UDP-葡萄糖也可通过-呋喃果糖苷酶(sacA)、果糖激酶(scrK)、磷酸葡萄糖变位酶(PGM)及UDP-葡萄糖焦磷酸化酶(UGP)连续催化而得。蔗糖在SS、己糖激酶(HK)、甘露糖-6-磷酸异构酶(MPI)、磷酸甘露糖变位酶(PMM)和甘露糖焦磷酸化酶(GMP)果糖激酶(scrK)的共同作用下产生第二类核苷酸糖GDP-甘露糖。UDP-葡萄糖能在UDP-葡萄糖-差向异构酶(UGE)的作用下生成第三类核苷酸糖UDP-半乳糖。UDP-葡萄糖还能在UDP-葡萄糖脱氢酶(UGDH)、UDP-芹菜糖/木糖合酶(AXS)的催化下形成第四类核苷酸糖UDP-木糖,并在UDP-阿拉伯糖差向异构酶(UAE)的催化下形成第五类核苷酸糖UDP-阿拉伯糖。这些核苷酸糖在后续糖基转移酶的作用下,进而合成益智多糖(图1)。

表4 KEGG分类(前20个)
2.4 关键酶基因的表达
为明确多糖生物合成途径中关键酶基因的表达特性,以延伸因子作为内参基因,对18个关键酶基因在茎、叶、果实中的表达情况进行Real- time qPCR检测,结果表明,18个基因在茎、叶、果实中均有表达, 且绝大多数基因(14/18)在果实中的表达量最高。参与葡萄糖代谢的c64270.graph_c0 (编码蔗糖合成酶SS)、c77958.graph_c0 (编码磷酸葡萄糖变位酶PGM)、c75380. graph_c0 (编码UDP-葡萄糖焦磷酸化酶UGP)和4个编码糖基转移酶的基因(c85406.graph_c0、c58247.graph_c0、c96947.graph_c0、c83168.graph_c0)均在果实中高丰度表达,并以c75380. graph_c0和c85406.graph_c0的表达量最高,这可能与益智多糖主要为葡萄糖密切相关。此外,参与甘露糖代谢的c73719.graph_c0 (编码甘露糖-6-磷酸异构酶MPI)、c71757.graph_c0 (编码磷酸甘露糖变位酶PMM)、c94431.graph_c0 (编码甘露糖焦磷酸化酶GMP)也均在果实中表达量较高(表5)。这表明多糖生物合成途径中关键酶基因在益智不同组织中普遍存在,为其功能研究提供依据。
3 结论和讨论
益智作为药食同源的补益品来源,有1 700多年的药用历史,具有减缓胃痛、腹泻、溃疡、多尿、延缓衰老、预防痴呆等作用[1,19–20],已逐渐形成海南和广东的特色道地药用资源[21]。多糖是益智中的一类重要活性成分,益智多糖具有抗氧化、抗肿瘤、增强机体免疫等作用[6–8]。本研究结果表明,益智茎、叶和果实中均含有多糖,以果实中多糖含量最高,达87.89 mg/g,表明果实是多糖的主要积累部位。牛晴等[22]的研究表明,益智果仁中总糖含量高于叶,叶高于茎,与本研究结果相似。海南五指山、澄迈、屯昌、广东雷州半岛、广西南宁和安徽毫州的益智果实中的多糖含量为80.3~86.2 mg/g[23], 表明不同来源的益智果实中多糖含量差异不大。此外,对益智叶和茎多糖进行研究不仅有利于其新资源的开发利用[24],对促进益智产业的良性发展也具有重要意义。
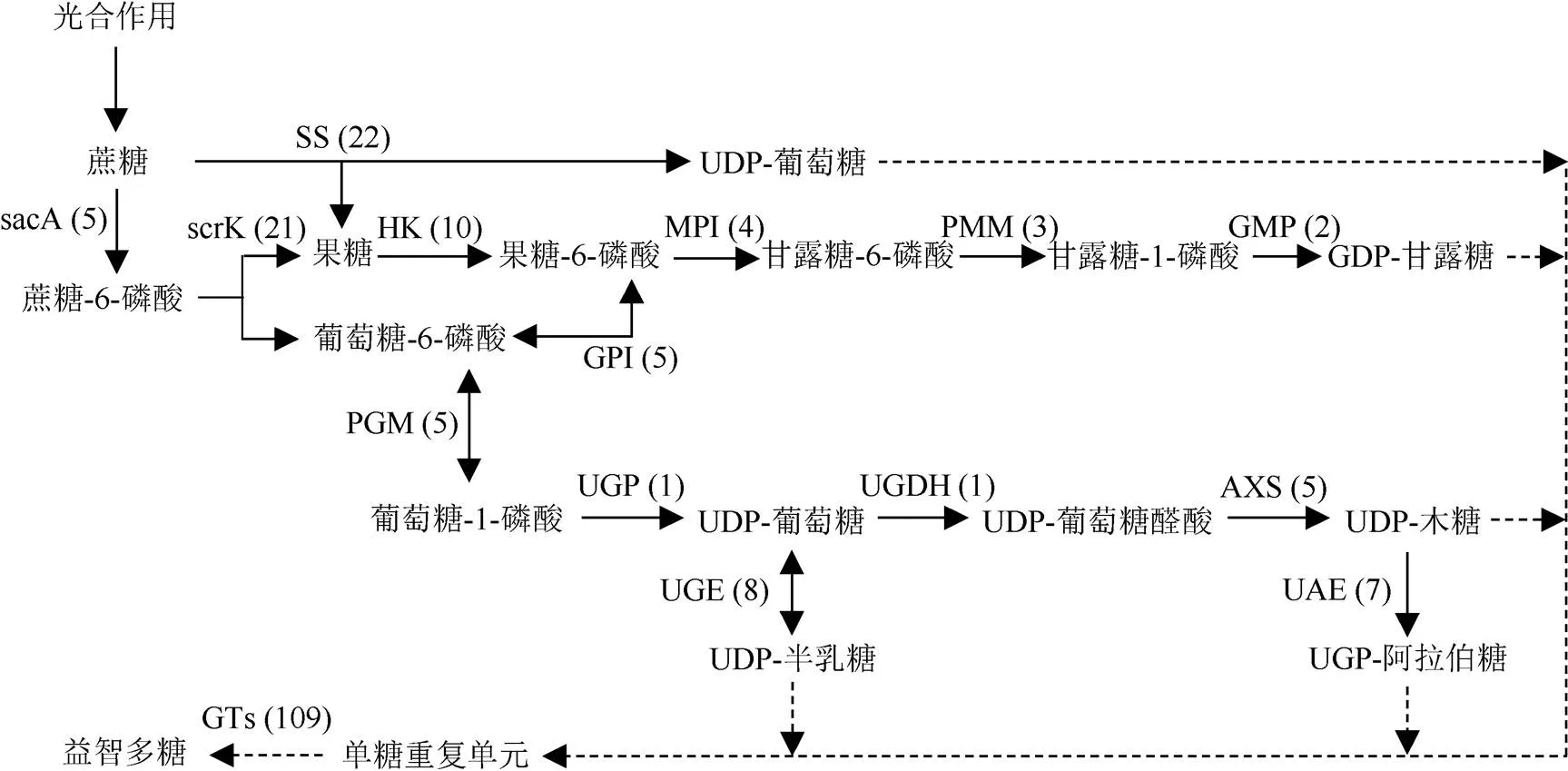
图1 推断的益智多糖生物合成途径。括号内的数字表示基因数量。
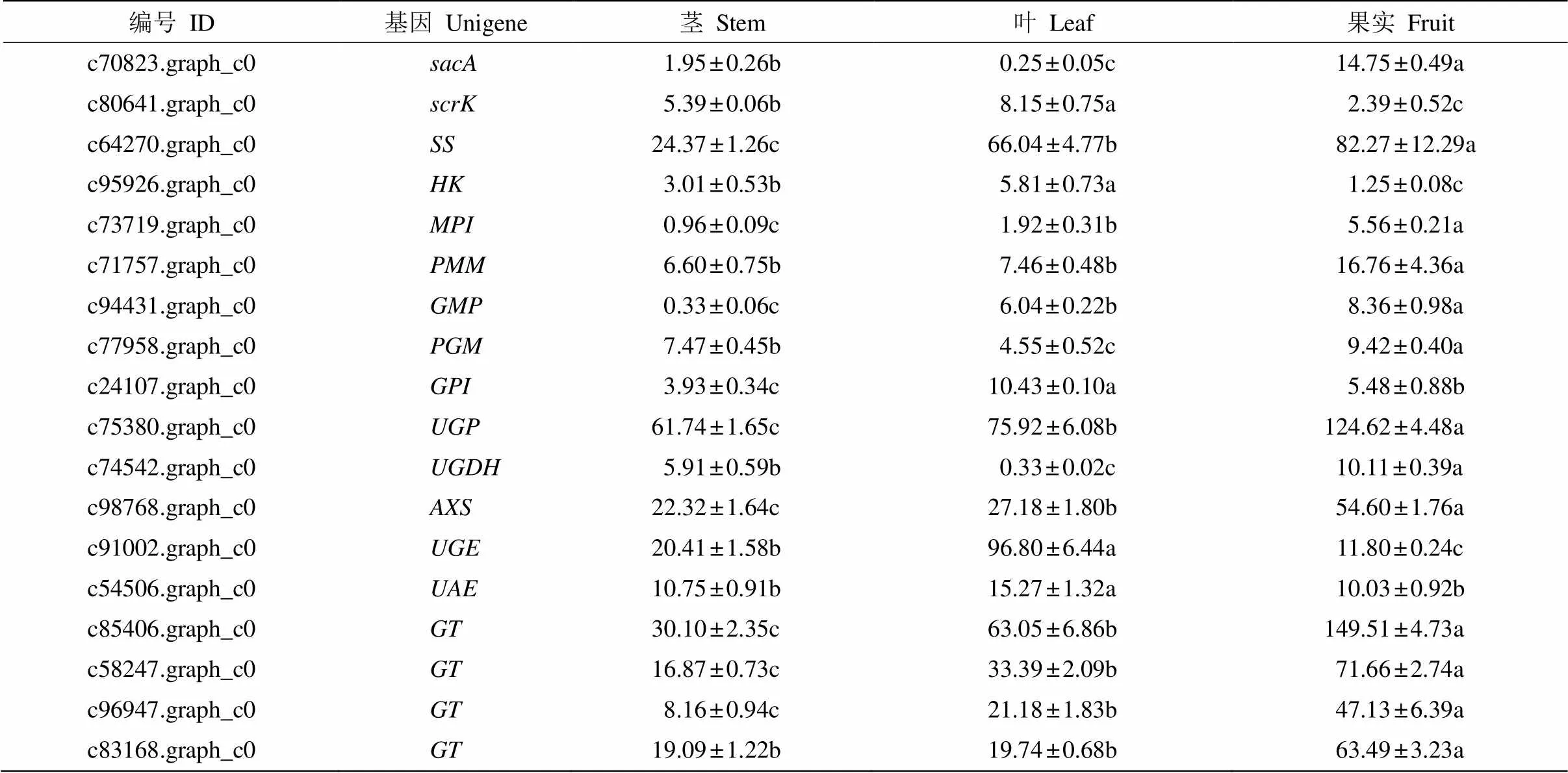
表5 qPCR分析益智多糖生物合成途径中关键酶基因的表达
同行数据后不同字母表示差异显著(<0.05)。
Data followed different letters in the same line indicate significant difference at 0.05 level.
虽然植物多糖已被广泛发现,但仍有大部分植物多糖被证实本身不具有生物活性或只有很弱的生物活性。这是由于植物多糖结构与其生物活性紧密相关,可以通过化学修饰改变原有结构,进而增强部分多糖的生物活性[25]。多糖是一种聚合糖高分子碳水化合物,而单糖是多糖的基础组成部分,由不同单糖通过糖苷键连接、缩合、失水形成多糖[12–13]。对于益智多糖结构的研究,单糖组成是最基本的研究对象。通过PMP柱前衍生-HPLC法分析表明, 益智果实中多糖由葡萄糖、木糖、半乳糖、阿拉伯糖和甘露糖组成,以葡萄糖含量最高(表1)。赵祥升等[26]报道益智果实的多糖主要由葡萄糖、半乳糖、阿拉伯糖、鼠李糖和甘露糖组成。Shi等[10]报道益智果实多糖由葡萄糖、木糖、阿拉伯糖、半乳糖、鼠李糖、葡萄糖醛酸和甘露糖组成。Han等[27]报道益智果实多糖以葡萄糖为主要单糖,与本研究的结果相似。目前益智多糖的分子结构已有报道,而益智多糖的生物合成途径却少有研究,因此,开展益智多糖合成途径的分析具有重要意义。
通过对益智转录组数据进行功能注释,获得了47 690条unigenes,其中31 892条在NR、Swiss-Prot、KEGG、COG、KOG、GO和Pfam数据库获得注释。通过基因GO分类,主要有生物过程、细胞组分和分子功能等3大功能,其中代谢过程、催化活性过程和细胞过程等3个子分类注释的基因数量较多。基于KEGG数据库,挖掘得到果糖和甘露糖代谢(ko00051)、淀粉和蔗糖代谢(ko00500)、半乳糖代谢(ko00052)、磷酸戊糖途径(ko00030)、戊糖、氨基糖和核苷酸糖代谢(ko00520)等5条多糖相关代谢途径,共有897个unigenes参与,其中208个unigenes编码18个关键酶,编码糖基转移酶(GT)的unigene最多,其次是蔗糖合成酶(SS)。根据挖掘得到的多糖合成途径关键酶,结合其他植物中多糖生物合成途径的相关报道[11–13,28–29],推断出益智多糖的生物合成途径,这为深入开展益智品质形成机理提供了丰富的数据资源。
多糖生物合成途径中的18个关键酶基因在益智茎、叶、果实中的表达存在差异,具有组织特异性,总体而言在果实中的表达量比茎、叶中高,推测多糖代谢物在果实中的合成量比其他组织中高。本研究结果表明,参与益智多糖中葡萄糖代谢的基因,如蔗糖合成酶基因、磷酸葡萄糖变位酶基因、UDP-葡萄糖焦磷酸化酶基因和糖基转移酶基因均在果实中的表达量最高,尤其是糖基转移酶基因(c85406.graph_c0)与UDP-葡萄糖焦磷酸化酶基因(c75380.graph_c0),这与益智不同组织中葡萄糖含量变化较为一致,推测为调控益智多糖生物合成的关键基因。UDP-葡萄糖焦磷酸化酶是植物多糖合成过程中的关键限速酶,负责调控多糖合成的起始步骤[30]。糖基转移酶广泛存在于生物界,在糖基化反应中发挥重要作用,催化活性糖基从糖基供体转移到糖基受体,进而催化糖苷键的形成,最终合成糖链[28–29,31]。这些为今后探究UDP-葡萄糖焦磷酸化酶和糖基转移酶在益智多糖代谢途径中的功能奠定了基础。通过比较益智不同组织中的多糖含量, 并基于转录组测序数据分析益智多糖的生物合成途径,从分子水平上揭示益智多糖生物合成途径及其关键酶的分子机制,将有助于开发和利用益智资源。
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of People’s Republic of China, Volume II [M]. Beijing: China Medical Science Press, 2015: 291.
国家药典委员会. 中华人民共和国药典, 第二部 [M]. 北京: 中国医药科技出版社, 2015: 291.
[2] YAN X X, WANG M Y, WANG J R, et al. Breeding of newvariety ‘Qiongzhong No. 1’ [J]. J Chin Mat Med, 2019, 42(6): 1211–1214. doi: 10.13863/j.issn1001-4454.2019.06.001.
晏小霞, 王茂媛, 王建荣, 等. 益智新品种‘琼中1号’的选育研究 [J]. 中药材, 2019, 42(6): 1211–1214. doi: 10.13863/j.issn1001-4454. 2019.06.001.
[3] SUI J N, LI F C, GUO Y X, et al. Research progress on chemical constituents, pharmacological effects and quality markers of[J]. Drug Eval Res, 2020, 43(10): 2120–2126. doi: 10.7501/j. issn.1674-6376.2020.10.035.
随家宁, 李芳婵, 郭勇秀, 等. 益智仁化学成分、药理作用及质量标志物研究进展 [J]. 药物评价研究, 2020, 43(10): 2120–2126. doi: 10. 7501/j.issn.1674-6376.2020.10.035.
[4] CHEN P, WANG P P, JIAO Z Z, et al. Research advance in chemical constituents in fruits ofand their pharmacological activities [J]. Drugs Clinic, 2013, 28(4): 617–623. doi: 10.7501/j.issn. 1674-5515.2013.04.039.
陈萍, 王培培, 焦泽沼, 等. 益智仁的化学成分及药理活性研究进展 [J]. 现代药物与临床, 2013, 28(4): 617–623. doi: 10.7501/j.issn. 1674-5515.2013.04.039.
[5] ZHANG J Q, WANG Y, CHEN F, et al. Progress on chemical consti- tuents and pharmacological activities offructus [J]. Nat Prod Res Dev, 2013, 25(2): 280–287. doi: 10.16333/j.1001-6880. 2013.02.009.
张俊清, 王勇, 陈峰, 等. 益智的化学成分与药理作用研究进展 [J]. 天然产物研究与开发, 2013, 25(2): 280–287. doi: 10.16333/j.1001- 6880.2013.02.009.
[6] ZHENG Y, LI Y, WANG W D, et al. Optimizationpolysaccharides extraction by Box-Behnken design and its antioxidant activities [J]. Food Ferment Ind, 2013, 39(8): 245–249. doi: 10.13995/j. cnki.11-1802/ts.2013.08.007.
郑义, 李勇, 王卫东, 等. Box-Behnken设计优化益智仁多糖的提取及其抗氧化活性 [J]. 食品发酵与工业, 2013, 39(8): 245–249. doi: 10.13995/j.cnki.11-1802/ts.2013.08.007.
[7] SHI W T, ZHONG J, ZHANG Q, et al. Structural characterization and antineuroinflammatory activity of a novel heteropolysaccharide obtained from the fruits of[J]. Carbohydr Polym, 2020, 229: 115405. doi: 10.1016/j.carbpol.2019.115405.
[8] YANG X, YANG Y H, CHEN H R C, et al. Extraction, isolation, immunoregulatory activity, and characterization offructus polysaccharides [J]. Int J Biol Macromol, 2020, 155: 927–937. doi: 10.1016/j.ijbiomac.2019.11.051.
[9] LI C, WANG L X. Chemoenzymatic methods for the synthesis of glycoproteins [J]. Chem Rev, 2018, 118(17): 8359–8413. doi: 10.1021/ acs.chemrev.8b00238.
[10] SHI L. Bioactivities, isolation and purification methods of polysac- charides from natural products: A review [J]. Int J Biol Macromol, 2016, 92: 37–48. doi: 10.1016/j.ijbiomac.2016.06.100.
[11] DOBLIN M S, PETTOLINO F, BACIC A. Plant cell walls: The skeleton of the plant world [J]. Funct Plant Biol, 2010, 37(5): 357–381. doi: 10.1071/FP09279.
[12] MEENTS M J, WATANABE Y, SAMUELS A L. The cell biology of secondary cell wall biosynthesis [J]. Ann Bot, 2018, 121(6): 1107–1125. doi: 10.1093/aob/mcy005.
[13] SCHEIBLE W R, PAULY M. Glycosyltransferases and cell wall biosynthesis: Novel players and insights [J]. Curr Opin Plant Biol, 2004, 7(3): 285–295. doi: 10.1016/j.pbi.2004.03.006.
[14] LI X T, PANG Y X, YANG Q, et al. Analysis on the resources and current situation of exploitation and utilization of four southern herbal medicines [J]. Mod Chin Med, 2015, 17(2): 99–104. doi: 10.13313/j. issn.1673-4890.2015.2.003.
李小婷, 庞玉新, 杨全, 等. 四大南药资源开发利用现状分析[J]. 中国现代中药, 2015, 17(2): 99–104. doi: 10.13313/j.issn.1673-4890. 2015.2.003.
[15] YU Z M, HE C M, TEIXEIRA DA SILVA J A, et al. The GDP- mannose transporter gene () fromis critical for mannan biosynthesis in plant growth and development [J]. Plant Sci, 2018, 277: 43–54. doi: 10.1016/j.plantsci.2018.07.021.
[16] YU Z M, YANG Z Y, TEIXEIRA DA SILVA J A, et al. Influence of low temperature on physiology and bioactivity of postharveststems [J]. Postharvt Biol Technol, 2019, 148: 97–106. doi: 10.1016/j.postharvbio.2018.10.014.
[17] ZHAO C H, YU Z M, HE C M, et al. Comparison of several total RNA extraction methods from flowers of[J]. J Trop Subtrop Bot, 2020, 28(5): 479–486. doi: 10.11926/jtsb.4202.
赵聪慧, 俞振明, 何春梅, 等. 铁皮石斛花总RNA提取方法的比较研究 [J]. 热带亚热带植物学报, 2020, 28(5): 479–486. doi: 10. 11926/jtsb.4202.
[18] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod [J]. Methods, 2001, 25(4): 402–408. doi: 10.1006/meth.2001.1262.
[19] WANG H X, HU Y M, JIA Q, et al. Evaluation of antioxidant and antiproliferation activities of 10 kinds of Guangdong medicinal and edible plant [J]. Sci Technol Food Ind, 2021, 42(8): 307–312. doi: 10. 13386/ j.issn1002-0306.2020050135.
万红霞, 胡玉玫, 贾强, 等. 10种广东药食两用植物的抗氧化和抗增殖活性评价 [J]. 食品工业科技, 2021, 42(8): 307–312. doi: 10. 13386/j. issn1002-0306.2020050135.
[20] ZHANG Q, ZHENG Y L, HU X J, et al. Ethnopharmacological uses, phytochemistry, biological activities, and therapeutic applications ofMiquel: A review [J]. J Ethnopharmacol, 2018, 224: 149–168. doi: 10.1016/j.jep.2018.05.002.
[21] YAN X X, REN B L, WANG M Y, et al. Present situation and develop- ment strategy of[J]. China J Chin Mat Med, 2019, 44(9): 1960–1964. doi: 10.19540/j.cnki.cjcmm.20190301.006.
晏小霞, 任保兰, 王茂媛, 等. 益智产业现状及发展对策 [J]. 中国中药杂志, 2019, 44(9): 1960–1964. doi: 10.19540/j.cnki.cjcmm.2019 0301.006.
[22] NIU Q, LIU P H, CAO M, et al. Analysis and evaluation of nutritional components in different parts ofMiq. [J]. Food Res Dev, 2018, 39(17): 160–167. doi: 10.3969/j.issn.1005-6521.2018.17.029.
牛晴, 刘平怀, 曹猛, 等. 益智不同部位营养成分与质量评价 [J]. 食品研究与开发, 2018, 39(17): 160–167. doi: 10.3969/j.issn.1005- 6521.2018.17.029.
[23] WU D L, JIN C S, MA K, et al. Quantitative determination of the poly- saccharide content in fructus[J]. Anhui Med Pharm J,2007, 11(3): 218–219. doi: 10.3969/j.issn.1009-6469.2007.03.015.
吴德玲, 金传山, 马凯, 等. 益智仁中多糖的含量测定 [J]. 安徽医药, 2007, 11(3): 218–219. doi: 10.3969/j.issn.1009-6469.2007.03.015.
[24] GAO B M, WEI N, WANG Y, et al. Present situation and analysis of comprehensive utilization of waste of[J]. Lishizhen Med Mat Med Res, 2015, 26(6): 1473–1475. doi: 10.3969/j.issn.1008- 0805.2015.06.079.
高炳淼, 魏娜, 王勇, 等. 南药益智废弃物综合利用现状与分析 [J]. 时珍国医国药, 2015, 26(6): 1473–1475. doi: 10.3969/j.issn.1008-0805. 2015.06.079.
[25] BIAN L, CHEN H G, ZHOU X. Recent advances in understanding the antitumor activity of polysaccharides from plants [J]. Food Sci, 2020, 41(7): 275–282. doi: 10.7506/spkx1002-6630-20190330-392.
边亮, 陈华国, 周欣. 植物多糖的抗肿瘤活性研究进展 [J]. 食品科学, 2020, 41(7): 275–282. doi: 10.7506/spkx1002-6630-20190330-392.
[26] ZHAO X S, DONG N, FENG J D, et al. Determination of polysac- charides content in[J]. Chin J Mod Appl Pharm, 2013, 30(10): 1070–1074. doi: 10.3969/j.issn.1008-0805.2015.06.079.
赵祥升, 董娜, 冯锦东, 等. 益智多糖含量测定 [J]. 中国现代应用药学, 2013, 30(10): 1070–1074. doi: 10.3969/j.issn.1008-0805.2015. 06.079.
[27] HAN Y, WU J, LIU Y S, et al. Therapeutic effect and mechanism of polysaccharide fromfructus on urinary incon- tinence [J]. Int J Biol Macromol, 2019, 128: 804–413. doi: 10.1016/j. ijbiomac.2019.01.193.
[28] ZHONG R Q, CUI D T, YE Z H. Secondary cell wall biosynthesis [J]. New Phytol, 2019, 221(4): 1703–1723. doi: 10.1111/nph.15537.
[29] TYAGI A, NIGAM D, AMITHA MITHRA S V, et al. Genome-wide discovery of tissue-specific miRNAs in clusterbean () indicates their association with galactomannan biosynthesis [J]. Plant Biotechnol J, 2018, 16(6): 1241–1257. doi: 10.1111/pbi.12866.
[30] DECKER D, ÖBERG C, KLECZKOWSKI L A. Identification and characterization of inhibitors of UDP-glucose and UDP-sugar pyropho- sphorylases forstudies [J]. Plant J, 2017, 90(6):1093–1107. doi: 10.1111/tpj.13531.
[31] FAIK A, HELD M. Review: Plant cell wall biochemical omics: The high-throughput biochemistry for polysaccharide biosynthesis [J]. Plant Sci, 2019, 286: 49–56. doi: 10.1016/j.plantsci.2019.04.025.
Analysis of Polysaccharide Content and Biosynthesis Pathway in Different Tissues of
YU Zhenming, ZHAO Conghui, ZHANG Mingze, HE Chunmei, SI Can, ZENG Danqi, DUAN Jun*
(Guangdong Provincial Key Laboratory of Applied Botany, Key Laboratory of South China Agricultural Plant Molecular Analysis and Gene Improvement, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China)
To understand the key enzyme functions of polysaccharide biosynthesis pathway in, the polysaccharides contents in stems, leaves and fruits and monosaccharide composition were studied, and the expression pattern of key enzyme genes involved in the biosynthetic pathway of polysaccharide was analyzed by real-time quantitative polymerase chain reaction (RT-qPCR). The results showed that the polysaccharides contents in different tissues was in the order of fruit>leaf>stem. The polysaccharide was consist of glucose, xylose, mannose, galactose and arabinose. A total of 47 690 unigenes were obtained fromtranscriptome database, of which 31 892 were annotated in NR, Swiss-Prot, KEGG, COG, KOG, GO and Pfam databases. Among them, 208 of unigenes encoding 18 enzymes were involved in the biosynthesis ofpolysaccharide. Furthermore, all of 18 selected unigenes were expressed in stems, leaves and fruits, of which 14 unigenes showed the highest expression in fruit.Interestingly, two genes, encoding glycosyltransferase and UDP glucose pyrophosphorylase, exhibited the highest expression, and their expressions were consistent with the glucose content in different tissues of.
; Polysaccharide; Transcriptome; Glycosyltransferase
10.11926/jtsb.4374
2021-01-04
2021-03-04
广东省重点领域研发计划(2020B020221001); 国家自然科学基金项目(32000257)资助
This work was supported by the Project for Key Research and Development in Guangdong (Grant No. 2020B020221001), and the National Natural Science Foundation of China (Grant No. 32000257).
俞振明(1988~ ),男,博士,主要从事药用植物次生代谢调控研究。E-mail: zhenming311@scbg.ac.cn
通信作者 Corresponding author. E-mail:duanj@scib.ac.cn
