盐度、温度和光照强度对针叶蕨藻的生长及光合活性的影响
2021-12-14钟逸云杨蕴琪郜晓峰邢浩刘炜段元亮何文辉何培民
钟逸云, 杨蕴琪, 郜晓峰, 邢浩, 刘炜, 段元亮,2, 何文辉,3, 何培民,3
盐度、温度和光照强度对针叶蕨藻的生长及光合活性的影响
钟逸云1a,1b, 杨蕴琪1a, 郜晓峰1a,1b, 邢浩1a,1b, 刘炜1a,1b, 段元亮1a,1b,2, 何文辉1a,3, 何培民1a,1b,3
(1. 上海海洋大学, a. 海洋生态与环境学院; b. 海洋科学研究院, 上海201306; 2. 四川省水产研究所, 成都 611731; 3. 水产科学国家级实验教学示范中心(上海海洋大学), 上海 201306)
为探究环境因子对针叶蕨藻()生长的影响,对不同盐度、温度和光照强度下针叶蕨藻的生长和叶绿素荧光参数进行了研究。结果表明:藻体日特定生长率(SGR)、最大光量子产量(Fv/Fm)、实际光合效率(Yield)、电子传递速率(ETR)和光化学淬灭(qP)随盐度升高呈先上升后下降的变化趋势,非光化学淬灭(qN)则呈相反的变化趋势,藻体光合活性和固碳效率在盐度27.5‰时达到最高,且与25‰和30‰盐度的差异显著(<0.05,=3)。藻体SGR、Fv/Fm、Yield、ETR和qP随温度升高而下降,qN则相反,藻体光合活性和固碳效率在26℃下达到最高,且与28℃和30℃的差异显著(<0.05,=3)。藻体的SGR、Fv/Fm、Yield、ETR和qP随光照强度升高呈先上升后下降的变化趋势,qN则相反,且在18.75mol/(m2·s)弱光照下出现轻微光抑制,藻体生长、光合活性及固碳效率在光照强度25.00mol/(m2·s)时达到最高,但与18.75和31.25mol/(m2·s)的差异不显著(>0.05,=3)。因此,针叶蕨藻在27.5‰盐度、26℃和25.00mol/(m2·s)光照强度下生长最快且光合作用能力最高。
针叶蕨藻;叶绿素荧光参数;特定生长率;盐度;温度;光照强度
大型海藻是海洋生态系统中的初级生产者,通过吸收氮磷等营养物质降低富营养化程度,并抑制赤潮发生,常被应用于海域生态修复及水产养殖等,因而在生物地球化学循环过程中发挥了重要作用[1–2]。当前我国水族产业蓬勃发展[3],一些具有观赏价值的大型海藻对大、中、小型海洋生态水族箱具有创建生境、净化水质的效果。目前海洋生态水族箱常配置的观赏大型海藻主要有针叶蕨藻()、杉叶蕨藻()、长茎葡萄蕨藻()、石莼()等,其中,针叶蕨藻最为常见,这些海藻具有较强的吸收营养盐、释放氧气等生态功能,同时又具有很好的观赏价值。
针叶蕨藻隶属于绿藻门(Chlorophyta)羽藻纲(Bryopsidophyceae)蕨藻科(Caulerpaceae)蕨藻属,藻体羽毛状,十分美丽,俗称羽毛藻,在我国大陆主要分布于广东和海南沿海近岸,极具观赏价值,且可食用,也成为南海近海养殖的一种名贵经济大型海藻。其生长速度快,环境适应能力较强,且具有一定的净化水质功能[4]。针叶蕨藻在盐度20‰~ 40‰下均能生长[5],Mosquera-Murillo等[6]报道在盐度15‰的水体中藻体逐渐发白;袁荣荣等[7]的研究表明,针叶蕨藻在25℃~30℃时生长良好,适宜的光照强度为25.00mol/(m2·s)。在相同环境条件下,针叶蕨藻的净化水质效果优于长茎葡萄蕨藻和细齿麒麟菜()[8]。
针对针叶蕨藻的生长和营养盐代谢能力等方面开展了一些研究[8],但未见针对其在不同环境条件下光合活性的研究报道。基于针叶蕨藻的观赏性被广泛应用于海水观赏水族箱中,本研究结合常见观赏鱼类如眼斑双锯鱼()等的适宜生存条件[9],探索针叶蕨藻在不同环境条件下的生长和光合活性的生理响应,为今后针叶蕨藻进一步开发利用奠定基础。
1 材料和方法
1.1 藻体来源和暂养条件
针叶蕨藻()采集于南海文昌近岸海区。采集后采用航空低温运输运回实验室,然后用消毒海水进行清洗,去除藻体上的杂藻和附着物。藻体培养在25‰盐度、25℃和光照强度25.00mol/(m2·s)下备用。经过7 d复苏培养的针叶蕨藻生长旺盛(图1)。

图1 水族箱复苏培养的针叶蕨藻
1.2 培养条件和培养装置
针叶蕨藻复苏培养后,选取生长旺盛的藻体剪取鲜绿分枝末梢,长度为(10±0.50) cm、鲜质量为(1±0.50) g,放入盛有1 L人工海水的定制圆形玻璃容器中进行充气悬浮培养,并加入适量霍格兰(Hoa- gland)培养液。培养容器放置在光照培养箱(HGZ- 400N, 上海慧泰)中,光照周期为光照∶黑暗=12∶12,设置不同的海水盐度、温度、光照强度进行试验。试验周期为15 d,每5 d更换1次培养液。人工海水采用海水晶(蓝鸿星,海鼎科技)配制及使用光学盐度计检测并确定盐度,过滤消毒后备用。
试验设置盐度、温度、光照强度3个环境因子,每个因子设3个水平,每个试验设3组平行。盐度分别设置25‰、27.5‰和30‰;温度分别设置26℃、28℃和30℃;光照强度分别设置18.75、25.00和31.25mol/(m2·s)。某因子试验时其余环境条件分别设定为盐度27.5‰、温度26℃和光照强度25.00mol/(m2·s)。
1.3 藻体生长和特定生长率测定
每隔5 d采集1次藻体,用吸水纸吸去表面多余水分后称量鲜质量,并计算藻体日特定生长率(SGR)。SGR (%)=(ln1-ln0)/×100%, 式中,1为本次收集的藻体生物量;0为上次收集的藻体生物量;为间隔时间。
1.4 藻体叶绿素荧光参数测定
针叶蕨藻培养15 d后,采用叶绿素荧光仪(Dual- PAM-100,Walz Germany)测定相关参数。藻体样品经15 min暗处理后测量,得到最小荧光值(Fo)、最大荧光值(Fm)、稳态荧光值(Ft)、最大荧光值(Fʹm)和最小荧光值(Fʹo)。计算藻体PS II最大光化学效率(Fv/Fm)实际量子产量(Yield)、电子传递速率(ETR)、光化学淬灭(qP)和非光化学淬灭(qN)。Fv/Fm=(Fm- Fo)/Fm, Yield=F/Fʹm=(Fʹm-Ft)/Fʹm, ETR=PAR×Yield×0.84×0.5, qP=1-(F-Fʹo)/(Fʹm-Fʹo), qN=1-(Fʹm-Fʹo)/(Fm-Fo)。
1.5 数据的统计和分析
所有数据使用GraphPad Prism 7.04处理并绘图,使用SPSS 23.0进行单因素方差分析。实验数据以平均数±标准偏差表示,以<0.05表示差异显著。
2 结果和分析
2.1 对环境因子的响应
盐度 从图2可见,在盐度27.5‰下培养15 d,藻体平均鲜质量提高了1.69 g,且SGR均保持在较高水平,达(6.35±0.67)%,显著高于其余盐度处理(<0.05,=3)。在盐度25‰和30‰下培养15 d, 藻体平均鲜质量仅提高了0.91 g,且0~5 d藻体的SGR只有1.88%,显著低于27.5‰盐度(<0.05,=3), 0~ 10 d的SGR提高到5.10%~5.24%,0~15 d的SGR仅为4.06%~4.43%, 说明针叶蕨藻在盐度27.5‰下生长最好。
温度 从图3可见,在温度26℃下培养15 d,藻体平均鲜质量提高了2.10 g, SGR高达(7.11±0.13)%,显著高于其余温度处理(<0.05,=3)。在温度28℃和30℃下培养15 d,藻体平均鲜质量仅提高2.22~ 2.68g,0~5 d的SGR为5.80%,0~10 d的SGR下降,为4.73%~5.54%,0~15 d的SGR仅为4.10%~ 4.72%, 说明针叶蕨藻在温度26℃下生长最快。

图2 不同盐度下针叶蕨藻的生长和日特定生长率(SGR)。相同培养天数柱上不同字母表示差异显著(P<0.05, n=3)。下图同。

图3 不同温度下针叶蕨藻的生长和日特定生长率(SGR)
光照强度 从图4可见,在不同光照强度下培养15 d,藻体的SGR差异不显著(>0.05,=3)。
但在光照强度25.00mol/(m2·s)下的藻体生长最快,平均鲜质量从(0.87±0.04) g提高到(3.24±0.70) g, SGR最高,达(8.67±1.25)%;其次为31.25mol/(m2·s) 光照强度,培养15 d藻体的平均鲜质量提高了1.85g, SGR为(7.70±1.12)%;18.75mol/(m2·s)光照强度的最低,培养15 d藻体的平均鲜质量仅提高1.54g, SGR仅为(6.95±0.46)%, 说明针叶蕨藻在光照强度25.00mol/(m2·s)下的生长较好。
2.2 光合活性对环境因子的响应
对盐度的响应 从表1可见,在25‰~30‰盐度下藻体的荧光参数表现出一定差异,但不显著(>0.05,=3)。不同盐度下藻体的Fv/Fm为0.75~ 0.79,Yield为0.52~0.61,ETR为40.75~48.55。与盐度25‰相比,27.5‰盐度的平均Fv/Fm、Yield和ETR分别升高了4.32%、18.74%和19.14%;而当盐度为30‰时,平均Fv/Fm、Yield和ETR则分别降低了2.28%、8.00%和8.25%。这表明针叶蕨藻的光合效率在盐度27.5‰下最高,25‰盐度的最低。盐度27.5‰时藻体的平均qP最高,盐度25‰的最低; 而藻体的平均qN则相反,以盐度25‰最高。这说明在盐度27.5‰下藻体光合活性最大且热耗散最小。

图4 不同光照强度下针叶蕨藻的生长和日特定生长率(SGR)

表1 不同盐度下针叶蕨藻的Fv/Fm、Yield、ETR、qP和qN
同行数据后不同字母表示差异显著(<0.05,=3)。下表同。
Data followed different letters within line indicate significant differences at 0.05 level (=3). The same is followed Tables.
对温度的响应 从表2可见,藻体的荧光参数在26℃~30℃间表现出一定差异,但不显著(> 0.05,=3)。不同温度下藻体的平均Fv/Fm为0.77~ 0.79,Yield为0.55~0.61,ETR为43.15~47.50,与26℃相比,28℃下藻体的平均Fv/Fm、Yield和ETR分别降低了2.79%、6.69%和6.11%;而当温度升至30℃时,藻体的平均Fv/Fm基本不变,Yield和ETR又下降了3.01%和3.36%。这表明针叶蕨藻的光合效率在26℃下最高,并随温度上升而下降。藻体的平均qP在26℃下最高,并随温度上升而降低;而藻体的平均qN则相反,以26℃的最低,并随温度上升而增高。这表明在26℃下,藻体光合活性最大且热耗散最小。
对光照强度的响应 从表3可见,藻体荧光参数在光照强度18.75~25.00mol/(m2·s)下表现出一定差异,仅最大光量子产量有显著差异(<0.05,=3),其余参数的差异均不显著。不同光照强度下藻体的平均Fv/Fm为0.74~0.79,光照强度为25.00和31.25mol/(m2·s)时均为0.79±0.02, 但光照强度18.75mol/(m2·s)时显著较低(<0.05,=3), 仅为0.74±0.001。不同光照强度下藻体的平均Yield为0.54~0.62, ETR为42.45~48.80, 与18.75mol/(m2·s)相比,光照强度为25.00mol/(m2·s)时,藻体的平均Yield和ETR分别升高了14.98%和14.96%;而光照强度为31.25mol/(m2·s)时,藻体的平均Yield和ETR则分别降低了4.30%和4.61%,表明针叶蕨藻的光合效率在光照强度25.00mol/(m2·s)下最高,与31.25mol/(m2·s)的相近,而在18.75mol/(m2·s)光照强度下藻体光合作用受到轻微抑制。在光照强度31.25mol/(m2·s)下藻体的平均qP最高, 18.75mol/(m2·s)的最低;而平均qN则相反,以18.75mol/(m2·s)的最高,这表明25.00mol/(m2·s) 光照强度下,藻体的光合活性最大且热耗散最小, 而在18.75mol/(m2·s)下藻体光保护能力最高。
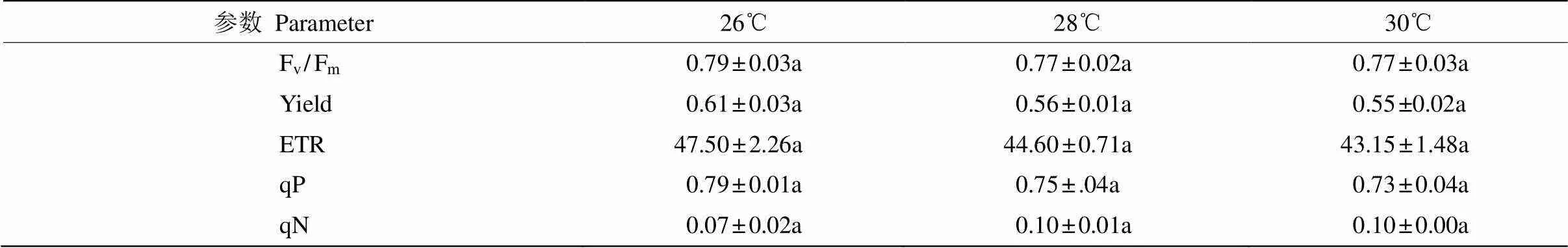
表2 不同温度下针叶蕨藻的Fv/Fm、Yield、ETR、qP和qN

表3 不同光照强度下针叶蕨藻的Fv/Fm、Yield、ETR、qP和qN
3 结论和讨论
3.1 生长量和生长率
大型海藻在生长过程中通过吸收海水中的营养物质,同化成自身需要的营养成分,且能够储存大量的营养盐,成为海洋生态系统中重要的氮库和磷库,进而保护海洋生态环境[10–14]。
盐度是影响海藻生长的重要环境因子。姚瑶[5]的研究表明针叶蕨藻在盐度35‰下生长最好,SGR可达(3.08±0.44)%;Mosquera-Murillo等[6]则认为其在盐度25‰下生长最快,SGR达4.82%。本研究结果表明,在盐度27.5‰下针叶蕨藻的生长量和生长率最大,SGR高达(6.35±0.67)%。温度是影响大型海藻吸收营养的重要因子[15],袁荣荣等[7]的研究表明,针叶蕨藻在25℃~30℃的生长较好,本研究也证明26℃时针叶蕨藻生长最好,能最快适应所处环境。光照强度是藻类生长发育的又一重要影响因子,对其代谢物质的合成与积累具有重要影响[16],本研究结果表明,光照强度为18.75~25.00mol/(m2·s), 针叶蕨藻的SGR随光照强度升高而增加,25.00~31.25mol/(m2·s)时SGR随光照强度升高而下降, 这与袁荣荣等[7]的研究结果相似,但光强过弱亦会影响其生长。
3.2 叶绿素荧光参数
叶绿素荧光参数能够反映植物叶绿体PS I和PS II (主要是PS II)的光能吸收利用、传递及耗散过程[17],叶绿素荧光技术广泛应用于不同环境因子对植物光合作用的影响研究[18]。
Fv/Fm是PS II的最大光能转换效率,即最大光化学量子产量,可受作用于PS II的胁迫条件的影响,是反映植物所受生理压力的探针,用来监测海藻的生活环境是否良好[19]。而在无胁迫条件下大型海藻的Fv/Fm变化极小,已有研究表明,盐度对羊栖菜()幼体、强壮硬毛藻()的Fv/Fm影响不显著(>0.05)[20–21]。本试验中,针叶蕨藻的Fv/Fm为0.74~0.79。对大型海藻的研究表明[22–24],健康绿藻约为0.75,基本不低于0.70。故可认为本试验中针叶蕨藻在光照强度18.75mol/(m2·s)下受到了轻微光抑制,而在其余环境条件下藻体生理状况良好,并未受到胁迫。在不同水平的3种环境因子下,藻体的Fv/Fm表现出一定差异,分别在27.5‰盐度、26℃和25.00~ 31.25mol/(m2·s)光照强度下达到最大;且光照强度对针叶蕨藻的Fv/Fm影响最大,这与王阳阳等[25]认为扁浒苔的荧光活性对光照强度变化最为敏感的研究结果相似。
Yield是指PS II实际光化学效率,反映光照下PS II反应中心部分关闭时的实际光化学效率;ETR是经过PS II的相对线性电子流速率[26]。有研究表明,ETR与光合释氧或CO2的固定速率呈线性关系[27]。本试验中,在盐度25‰~30‰、光照18.75~ 25.00mol/(m2·s)时,藻体的Yield和ETR随盐度或光照强度的上升呈先上升后下降的趋势;温度为26℃~30℃时,藻体的Yield和ETR则随温度上升而下降。可见,在盐度27.5‰、26℃和光照强度25.00mol/(m2·s)下能够提高针叶蕨藻PS II电子传递活性,从而获得最高固碳效率。
qP为光化学淬灭系数,是PS II吸收的能量用于进行光化学反应的比例,反映光合活性的高低; qN为非光化学淬灭系数,是PS II吸收的能量耗散为热量的比例,也就是植物耗散过剩光能为热量的能力,即光保护能力[28]。本试验中,藻体的qP随盐度变化的趋势为盐度25‰<30‰<27.5‰,随温度变化的趋势为30℃<28℃<26℃,随光照强度[mol/(m2·s)]变化的趋势为18.75<25.00<31.25。与qP的变化趋势相反,藻体qN随盐度上升呈先升后降,随温度上升而上升,随光照强度降低呈先降后升,表明在盐度27.5‰、26℃和25.00mol/(m2·s)光照强度下,针叶蕨藻的光合活性最大,通过热耗散丢失的能量最少。
综上所述,针叶蕨藻在盐度27.5‰、26℃和光照强度25.00mol/(m2·s)下的光合活性及固碳效率最大,热耗散丢失的能量最少,因而生长最好且光合活性最高。本研究基于大型海藻光合荧光特性, 探究不同环境条件下针叶蕨藻的光合能力,进一步确定了针叶蕨藻培育的最适环境条件,为其开发利用奠定了基础。
[1] ZHANG S Y, SUN H C. Research progress on seaweed bed ecosystem and its engineering [J]. Chin J Appl Ecol, 2007, 18(7): 1647–1653.
章守宇, 孙宏超. 海藻场生态系统及其工程学研究进展[J]. 应用生态学报, 2007, 18(7): 1647–1653.
[2] ROBERTSON A I, DUKE N C. Mangroves as nursery sites: Compa- risons of the abundance and species composition of fish and crusta- ceans in mangroves and other nearshore habitats in tropical Australia [J]. Mar Biol, 1987, 96(2): 193–205. doi: 10.1007/BF00427019.
[3] LIU Y, LI L, SUN D C. Development prospect and the current situation of ornamental fish market in Shanghai [J]. J Anhui Agric Sci, 2015, 43(12): 347–351. doi: 10.13989/j.cnki.0517-6611.2015.12.119.
刘颖, 李丽, 孙大川. 上海观赏水族市场调查及发展前景分析[J]. 安徽农业科学, 2015, 43(12): 347–351. doi: 10.13989/j.cnki.0517- 6611.2015.12.119.
[4] ZHENG X, CUI Y L, LIU A D, et al. Purification of nitrogen and phosphorus from mariculture effluent by[J]. J Trop Biol, 2016, 7(1): 43–47. doi: 10.15886/j.cnki.rdswxb.2016.01.007.
郑兴, 崔云亮, 刘傲东, 等. 针叶蕨藻对养殖废水中氮盐的净化[J]. 热带生物学报, 2016, 7(1): 43–47. doi: 10.15886/j.cnki.rdswxb.2016. 01.007.
[5] YAO Y. The influence of environmental factors on uptake kinetics mechanism of ammonia and growth of[D]. Haikou: Hainan University, 2016.
姚瑶. 环境因子对针叶蕨藻()生长及氨氮吸收动力学的影响[D]. 海口: 海南大学, 2016.
[6] MOSQUERA-MURILLO Z, PEÑA-SALAMANCA E J. Effect of salinity on growth of the green alga(Bryopsi- dales, Chlorophyta) under laboratory conditions [J]. Hidrobiológica, 2016, 26(2): 277–282.
[7] YUAN R R, HE W H, SONG H Y, et al. Preliminary study on effect of environmental factors on growth of feather algae [C]// Proceedings of the 2015 Annual Meeting of the Chinese Society for Environmental Sciences. Shenzhen: Chinese Society for Environmental Sciences, 2015: 1677–1682.
袁荣荣, 何文辉, 宋海燕, 等. 环境因子对羽毛藻生长的初步研究[C]// 2015年中国环境科学学会学术年会论文集.深圳: 中国环境科学学会, 2015: 1677–1682.
[8] CHENG F, LI L, YIN X L, et al. Comparison on purification effect of three macroalgae species on ammonia salt in inorganic and organic water [J]. Genom Appl Biol, 2017, 36(3): 1084–1089. doi: 10.13417/j. gab.036.001084.
程芬, 李乐, 殷小龙, 等. 3种海藻对无机盐和有机物水体中氨态盐净化效果比较[J]. 基因组学与应用生物学, 2017, 36(3): 1084–1089. doi: 10.13417/j.gab.036.001084.
[9] WANG S S. Effects of environmental factors on egg laying and embryo development of[D]. Zhoushan: Zhejiang Ocean University, 2015.
王珊珊. 环境因子对棘颊雀鲷的产卵及胚胎发育的影响[D]. 舟山: 浙江海洋学院, 2015.
[10] LÜNING K K. Lüning Seaweeds: Their environment, biogeography, and ecophysiology [J]. J Mar Biol Assoc U K, 1991, 71(1): 246. doi: 10.1017/S0025315400037632.
[11] ZHANG S Y, LIU S R, ZHOU X J, et al. Ecological function of seaweed-formed habitat and discussion of its application to sea ranching [J]. J Fish China, 2019, 43(9): 2004–2014. doi: 10.11964/jfc. 20190711873.
章守宇, 刘书荣, 周曦杰, 等. 大型海藻生境的生态功能及其在海洋牧场应用中的探讨[J]. 水产学报, 2019, 43(9): 2004–2014. doi: 10.11964/jfc.20190711873.
[12] MAO Y Z, LI J Q, XUE S Y, et al. Ecological functions of the kelpin integrated multi-trophic aquaculture, Sanggou Bay, China [J]. Acta Ecol Sin, 2018, 38(9): 3230–3237. doi: 10.5846/ stxb201703160444.
毛玉泽, 李加琦, 薛素燕, 等. 海带养殖在桑沟湾多营养层次综合养殖系统中的生态功能[J]. 生态学报, 2018, 38(9): 3230–3237. doi: 10.5846/stxb201703160444.
[13] DUARTE C M, WU J P, XIAO X, et al. Can seaweed farming play a role in climate change mitigation and adaptation? [J]. Front Mar Sci, 2017, 4: 100. doi: 10.3389/fmars.2017.00100.
[14] XU S N, WEN S S, WU W X, et al. Bioremediation of caged fish aqua- culture by the red algain an integrated multi- trophic aquaculture system [J]. Acta Ecol Sin, 2008, 28(4): 1466–1475. doi: 10.3321/j.issn:1000-0933.2008.04.013.
徐姗楠, 温珊珊, 吴望星, 等. 真江蓠()对网箱养殖海区的生态修复及生态养殖匹配模式[J]. 生态学报, 2008, 28(4): 1466–1475. doi: 10.3321/j.issn:1000-0933.2008.04.013.
[15] TALBOT P, DE LA NOÜE J. Tertiary treatment of wastewater with(Schmidle) under various light and temperature conditions [J]. Water Res, 1993, 27(1): 153–159. doi: 10.1016/0043- 1354(93)90206-W.
[16] ZHANG Z S, WANG X M, LIU F, et al. Analysis of physiology and regulation mechanism ofunder stress [J]. Mar Environ Res, 2020, 39(3): 473–479. doi: 10.13634/j.cnki.mcs.2020.03.023.
张忠山, 王晓梅, 刘峰, 等. 石莼属绿藻应答环境胁迫的生理特征与机制研究进展[J]. 海洋环境科学, 2020, 39(3): 473–479. doi: 10.13634/j.cnki.mcs.2020.03.023.
[17] WANG L L, LI Q, SONG X H, et al. Effects of environmental conditions on chlorophyll fluorescence parameters of plants [J]. J Shenyang Norm Univ (Nat Sci), 2019, 37(4): 362–367. doi: 10.3969/j. issn.1673-5862.2019.04.013.
王兰兰, 李琦, 宋晓卉, 等. 环境条件对植物叶绿素荧光参数影响研究进展[J]. 沈阳师范大学学报(自然科学版), 2019, 37(4): 362–367. doi: 10.3969/j.issn.1673-5862.2019.04.013.
[18] ZHANG S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance [J]. Chin Bull Bot, 1999, 16(4): 444– 448. doi: 10.3969/j.issn.1674-3466.1999.04.021.
张守仁. 叶绿素荧光动力学参数的意义及讨论 [J]. 植物学通报, 1999, 16(4): 444–448. doi: 10.3969/j.issn.1674-3466.1999.04.021.
[19] MAXWELL K, JOHNSON G N G. Chlorophyll fluorescence: A practical guide [J]. J Exp Bot, 2000, 51(345): 659–668. doi: 10.1093/jexbot/51. 345.659.
[20] SONG X D, CHEN B B, MA Z L, et al. Effects of salinity level on photosynthetic characteristics ofseedlings [J]. Acta Agric Zhejiang, 2020, 32(9): 1634–1644. doi: 10.3969/j.issn. 1004–1524.2020.09.12.
宋新丹, 陈斌斌, 马增岭, 等. 盐度对羊栖菜()幼体光合特性的影响 [J]. 浙江农业学报, 2020, 32(9): 1634–1644. doi: 10.3969/j.issn.1004–1524.2020.09.12.
[21] HAN W J, XU Y T, JIANG Y Y, et al. Effects of N/P ratio, salinity and pH on growth and photosynthesis of sea weed[J]. J Dalian Ocean Univ, 2019, 34(6): 776–784. doi: 10.16535/j.cnki. dlhyxb.2019–014.
韩汶均, 许彦婷, 蒋阳杨, 等. 氮磷比、盐度、pH对强壮硬毛藻生长和光合作用的影响[J]. 大连海洋大学学报, 2019, 34(6): 776–784. doi: 10.16535/j.cnki.dlhyxb.2019–014.
[22] YANG X Z, ZHENG X Q, LIN R C, et al. Photosynthetic capacity of three common species of macroalgae and the application in coral aquarium [J]. Chin J Ecol, 2014, 33(6): 1528–1533. doi: 10.13292/j. 1000-4890.20140327.006.
杨小舟, 郑新庆, 林荣澄, 等. 三种大型绿藻光合能力的差异及其在珊瑚养殖中的应用[J]. 生态学杂志, 2014, 33(6): 1528–1533. doi: 10.13292/j.1000-4890.20140327.006.
[23] HAN Z G, HE L J, GU J G, et al. Photosynthetic performance ofduring its dehydration and rehydration[J]. Chin J Ecol, 2005, 24(11): 1291–1294. doi: 10.13292/j.1000-4890.2006.0146.
韩志国, 贺立静, 顾继光, 等. 束生刚毛藻脱水和复水过程中光合作用的变化[J]. 生态学杂志, 2005, 24(11): 1291–1294. doi: 10. 13292/j.1000-4890.2006.0146.
[24] ZHANG S Y, XIANG C, ZHOU X J, et al. Photosynthetic fluorescence characteristics of six macroalgae species in seaweed beds of Gouqi Island, Zhejiang, China [J]. Chin J Appl Ecol, 2018, 29(10): 3441– 3448. doi: 10.13287/j.1001-9332.201810.031.
章守宇, 向晨, 周曦杰, 等. 枸杞岛海藻场6种大型海藻光合荧光特性比较[J]. 应用生态学报, 2018, 29(10): 3441–3448. doi: 10. 13287/j.1001-9332.201810.031.
[25] WANG Y Y, HUO Y Z, CAO J C, et al. Influence of low temperature and low light intensity on growth of[J]. J Fish Sci China, 2010, 17(3): 593–599.
王阳阳, 霍元子, 曹佳春, 等. 低温、低光照强度对扁浒苔生长的影响[J]. 中国水产科学, 2010, 17(3): 593–599.
[26] HARBINSON J, GENTY B, BAKER N R. Relationship between the quantum efficiencies of photosystems I and II in pea leaves [J]. Plant Physiol, 1989, 90(3): 1029–1034. doi: 10.1104/pp.90.3.1029.
[27] BEER S, ILAN M.measurements of photosynthetic irradianceresponses of two Red Sea sponges growing under dim light conditions [J]. Mar Biol, 1998, 131(4): 613–617. doi: 10.1007/s002270050353.
[28] SCHREIBER U, SCHLIWA U, BILGER W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer [J]. Photosynth Res, 1986, 10(1/2): 51–62. doi: 10.1007/BF00024185.
Effects of Salinity, Temperature and Light Intensity on Growth and Photo- synthetic Activity of
Zhong Yiyun1a,1b, Yang Yunqi1a, GAO Xiaofeng1a,1b, Xing Hao1a,1b, LIU Wei1a,1b, DUAN Yuanliang1a,1b,2, HE Wenhui1a,3, HE Peimin1a,1b,3
(1a. College of Marine Ecology and Environment; 1b. Institute of Marine Science, Shanghai Ocean University, Shanghai 201306, China; 2. Sichuan Fisheries Research Institute,Chengdu 611731, China; 3. National Demonstration Center for Experimental Fisheries Science Education (Shanghai Ocean University),Shanghai 201306, China)
In order to explore the effects of environment factors on growth of, the changes in growth and chlorophyll fluorescence parameters were studied under different salinity, temperature and light intensity. The results showed that the specific growth rate (SGR), maximum light quantum yield (Fv/Fm), actual photosynthetic efficiency (Yield), electron transfer rate (ETR) and photochemical quenching (qP) increased at first and then decrease with increasing salinity, while non-photochemical quenching (qN) was opposite. The photosynthetic activity and carbon fixation efficiency of the algae under 27.5‰ salinity were the highest, and there were significant difference with those under 25‰ and 30‰ salinity (<0.05,=3). The SGR, Fv/Fm, Yield,ETR and qP of the algae decreased with temperature rising, and qN was opposite. The photosynthetic activity and carbon fixation efficiency of algae under 26℃ were the highest, and there were significant difference with those under 28℃and 30℃(<0.05,=3). The SGR, Fv/Fm, Yield, ETR and qP of the algae increased at first and then decreased with increment of light intensity, while qN was opposite, and there was slight photoinhibition under 18.75mol/(m2·s) light intensity. The growth, photosynthetic activity and carbon fixation efficiency of algae were the highest under 25.00mol/(m2·s) light intensity, but no significant difference with those under 18.75 and 27.5mol/(m2·s) light intensity (>0.05,=3). Therefore, it was suggested thatcould grow fast with high photosynthesis ability under the conditions of 27.5‰ salinity, 26℃, and 25.00mol/(m2·s) light intensity.
; Chlorophyll fluorescence parameter; Specific growth rate; Salinity; Temperature; Light intensity
10.11926/jtsb.4378
2021-01-14
2021-03-15
上海市海洋局科研项目(沪海科2015-02)资助
This work was supported by the Project for Scientific Research of Shanghai Municipal Bureau of Oceanography (Grant No. 2015-02).
钟逸云(1995~ ),女,硕士研究生,主要研究方向为人工生态系统。E-mail: 13501619793@139.com
通信作者Corresponding author. E-mail: pmhe@shou.edu.cn
