饲粮精粗比对早期断奶藏羔羊小肠细菌多样性的影响
2021-12-14李蒋伟侯生珍王志有桂林生
李蒋伟,侯生珍,王志有,桂林生
(青海大学农牧学院,青海 西宁 810016)
【研究意义】反刍动物肠道微生物菌群对饲料营养的消化、吸收、代谢和免疫反应等生理活动均具有较强干预。肠道微生物多样性是促进营养物质吸收、维持机体免疫和新陈代谢的基础,其多样性变化极易对宿主免疫产生影响[1]。肠道微生物不仅阻止外界病菌的侵入, 从而维持肠道屏障的完整性并促进宿主免疫系统的正常发育[2],也能够诱导T淋巴细胞的分化和调节早期B淋巴细胞的发育。罗海霞等[3]研究滩寒杂交健康羔羊和腹泻羔羊肠道微生物群落表明,腹泻羔羊肠道中变形菌门显著高于健康羔羊;拟杆菌门、蓝细菌门、黏胶球形菌门和无壁细菌门在腹泻羔羊中的含量显著低于健康羔羊;且其微生物丰度及优势微生物都具有显著的差异;进一步佐证了肠道菌群结构对机体健康的重要影响。在藏羔羊断奶早期,其消化道微生物菌群处于不稳定且脆弱的状态,在此阶段调整饲粮精粗比可影响其生产性能和机体消化代谢。【前人研究进展】李冲等[4]研究表明:对新生湖羊羔羊进行21日龄断奶处理,相较于对照组(未断奶)空肠微生物α多样性指数(Ace指数和Chao1指数等)有升高的趋势,但对空肠回肠β多样性指数无显著性差异。一些研究表明,消化道微生物群落过早发育,高度多样化和丰富的菌群可能对幼龄反刍动物肠道健康和免疫功能产生负面影响[5];理论上,肠道微生物群落的高度多样性有利于抵御外界环境变化[6],且在幼龄反刍动物上肠道微生物群落有随着日龄增加的趋势[7],所以大部分研究证实肠道菌群多样性有益宿主健康,并认为菌群丰度的逐渐增加是肠道微生物群发育成熟的标志[8]。【本研究切入点】本试验通过采用不同精粗比饲粮对早期断奶藏羔羊小肠细菌群进行干预,筛选出适宜早期断奶藏羔羊小肠细菌群定植的饲粮结构。【拟解决的关键问题】此研究为探寻其健康高效的饲养条件提供理论依据。
1 材料与方法
1.1 试验时间与地点
动物饲养试验于2019年5月15日至2019年8月25日在青海省海南州共和县切吉乡哇合村青海香咔梅朵牧业有限公司进行;2019年8月20日食靡样品交由百迈克生物科技公司进行肠道微生物16S rDNA基因的测序工作。
1.2 设计及饲养管理
选择健康、体况相近且体重无显著差异(P<0.05)的90日龄早期断奶藏羊母羔共210只,随机分成7组,每组30只。7组羔羊分别饲喂精粗比为80∶20、70∶30、60∶40、50∶50、40∶60、30∶70和20∶80的饲粮;饲粮精粗比为干物质比,饲粮中精饲料完全一致,粗饲料由燕麦青干草与燕麦青贮按干物质比例1∶1混合而成。饲养试验预饲期为10 d,正试期为90 d。精饲料组成及营养水平如表1。
1.3 饲养管理
试验羔羊全舍饲分栏饲养,分别于8:30和16:30饲喂羔羊2次,饲粮自由采食,自由饮水,每天饲喂前清扫残留饲料并称重。每天中午12:30定期清扫羊舍,保持羊舍卫生、通风和干燥,每周对羊舍和运动场进行两次消毒杀菌。试验期对羔羊进行羊四联、小反刍兽、口蹄疫和羊痘等疫苗的免疫注射,分别用伊维菌素和溴氰菊酯淋浴进行内外寄生虫防治。
1.4 样品采集和处理
饲养试验结束后,每组中随机抽取3只羔羊于清晨空腹屠宰,在小肠段取食靡于5 mL冻存管中,混匀后投入液氮,于实验室-80 ℃冷冻保存。
1.5 小肠细菌微生物分析方法
本实验16SrDNA高通量测序部分交由百迈客生物科技有限公司测定,对采集到的21个小肠食靡样品基于Illumina HiSeq 测序平台,采用双末端测序(Paired-End)的方法,构建小片段文库进行测序,进一步对Reads拼接过滤,OTUs聚类分析,物种注释及丰度分析。提取羔羊瘤胃微生物基因组DNA,根据保守区设计得到引物,其中通用引物正向:5’-CCTACGGGNGGCWGCAG-3’,反向:3’-GGACTACHVGGGTATCTAAT-5’。在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库进行高通量测序,进而得到原始图像数据文件。PCR扩增步骤为:模板DNA经加热至98 ℃左右持续2 min,轮回30次循环,依次经过98 ℃×30 s、50 ℃×30 s、72 ℃×1 min,最后于72 ℃下延长7 min。

表1 精饲料组成及营养水平(干物质基础)
1.6 数据处理
采用Excel2019整理初始数据,用SPSS20.0中的one-way ANOVA进行单因素方差分析,检测结果用平均值±标准误(Mean±SE)的形式表示,差异显著的评断标准为P<0.05。
2 结果与分析
2.1 测序数据质量评估
21个样品测序共获得 1679 801 对Reads,双端 Reads拼接、过滤后共产生 1260 603条Clean tags,每个样品至少产生43 023 条Clean tags,平均产生 60 029 条Clean tags,被分配至944个分类操作单元(OTUs),有909个为共有OTUs(图1)。本试验覆盖率大于99%表明测序深度能够准确反映羔羊小肠细菌微生物组成。
2.2 Alpha多样性分析
由表2可以看出,Shannon指数各处理组间并无显著性差异(P>0.05);Simpson指数A、D组显著高于其余各处理组(P<0.05);Ace、Chao1指数变化趋势相似,E组显著高于其余各处理组(P<0.05)。
2.3 Beta多样性分析
Beta多样性组间差异分析的箱形图可以直观的反应组内样本相似性的中位数,离散程度,最大值,最小值,异常值等,从而分析组间物种Beta多样性差异是否显著。由图2可知,各处理组间和组内Beta多样性没有明显差异(P>0.05)。
2.4 不同精粗比小肠细菌群结构的影响
2.4.1 门水平下小肠细菌菌群结构差异分析 对门水平细菌分布前十菌群门类进行显著性分析,将丰度小于1%的菌门归为其他(Others)。如表3和图3所示:各处理组优势菌门均为变形菌门(Proteobacteria),其丰度均大于30.7%,且C组远高于其余各组(P<0.05),达到了49.53%;酸杆菌门(Acidobacteria)有随着精粗比降低而降低的趋势,但无显著性差异(P>0.05);F组厚壁菌门(Firmicutes)丰度显著高于其余各处理组(P<0.05);A、D组软壁菌门(Tenericutes)丰度显著高于其余各组(P<0.05);芽单胞菌门(Gemmatimonadetes)和绿弯菌门(Chloroflexi)分布趋势相似,均为C组显著高于其余各组(P<0.05),且随着精粗比变化有先升高后降低的趋势。

表2 阿尔法多样性指数
2.4.2 科水平下瘤胃细菌分布分析 如表4和图4所示:鞘脂单胞菌科(Sphingomonadaceae)为优势菌科,且C组丰度高于其余各处理组(P<0.05);支原体科(Mycoplasmataceae)各处理组无显著差异(P>0.05),但A、B组分别有个体支原体菌科占据小肠细菌90%以上;A组Pyrinomonadaceae最高(P<0.05),且有随精粗比降低而丰度下降的趋势;黄色杆菌科(Xanthobacteraceae)F组显著高于其余各处理组(P<0.05);毛螺旋菌科(Lachnospiraceae)E组高于其余各组(P<0.05),芽单胞菌科(Gemmatimonadaceae)和噬几丁质菌科(Chitinophagaceae)的丰度随着精粗比的增高,且在C组时达到最高值(P<0.05)。
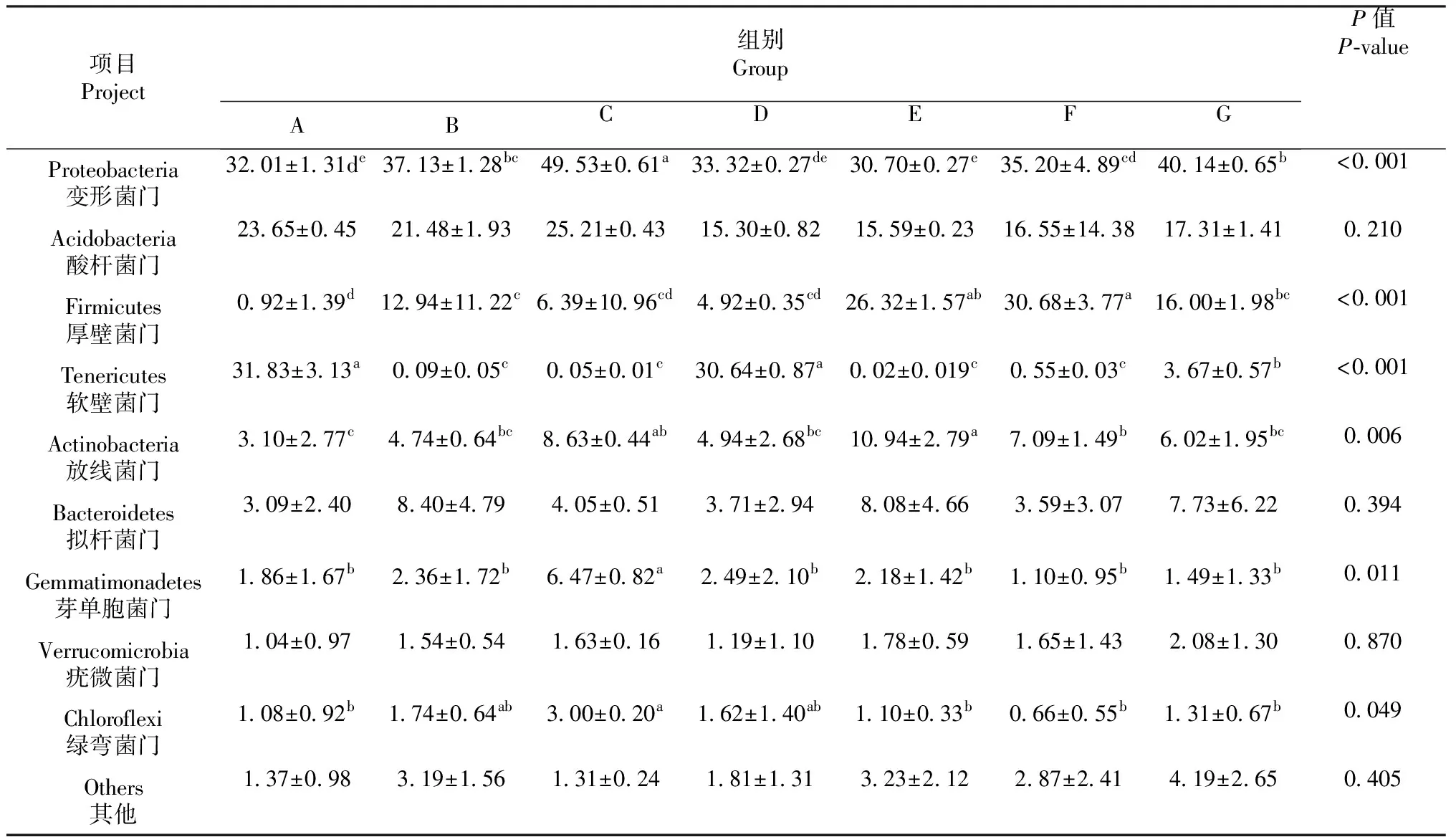
表3 门水平下细菌相对含量

表4 科水平下细菌相对含量
2.5 KEGG分析
由图5可知,小肠细菌功能基因集中于46个代谢途径,其中:在氨基酸代谢方面,C组相较其余处理组最高(8.12%);碳水化合物代谢方面,各处理组差别不大,但均大于9%;生物膜转运方面,有随着精粗比降低而升高的趋势;翻译方面,E组高于其余处理组50%;其余途径各处理组无较大差异。
3 讨 论
3.1 饲粮精粗比对小肠细菌多样性的影响
饲粮结构的变化导致其可消化程度产生差异,从而影响肠道微生物数量、群落结构及功能的变化[9]。消化道微生物是保证反刍动物正常消化功能的润滑剂,除品种、健康状况及生活环境和环境中共生微生物的群体效应外,饲粮结构是影响其健康的重要人为可控因素[10-11]。在藏羔羊断奶早期复胃发育不健全时,肠道担任养分消化的主要角色,失衡的肠道菌群则会因为对动物机体的调节发生紊乱,进而产生一系列的与肠道微生态失衡相关慢性或内分泌紊乱的并发症[12]。本研究发现,Ace指数和Chao1均为精粗比40∶60组显著高于其余处理组,证明在此饲粮结构下肠道菌群丰富度较高;但Beta多样性各处理组并无显著差异,与尹福泉[13]等研究结果一致。门水平上,各处理组的优势菌门均为变形菌门(大于30.7%),大量研究表明变形菌门能反应肠道微生态失调或不稳定的微生物群落结构;酸杆菌门在高精料条件下广泛存在(80∶20、70∶30、60∶40),厚壁菌门则随着精粗比降低丰度明显增加;二者共同构成了小肠的次优势菌门;这与胡丹丹[14]、吴兆海[15]等等对不同精粗比下奶牛瘤胃菌群结构变化研究结果相似。科水平上,鞘脂单胞菌科为各处理组优势菌群(大于3.72%),且精粗比60∶40组显著高于其余各组约100%;精粗比80∶20、70∶30组中有个体支原体科丰度占到90%以上,可能精粗比例过高导致小肠微生物菌群失调,还未在个体健康水平上表现出来,其致病机理还需进一步研究;芽单胞菌科和噬几丁质菌科的丰度随着精粗比的增高,且在精粗比60∶40时达到最高值。本实验结果与其他研究者在反刍动物肠道微生物菌群结构存在差异,可能是藏羊处于高海拔高寒地区,且舍饲育肥方式相对传统放牧模式在近几年才逐渐推广,在试验所用饲粮结构下表现出上述情况。
3.2 饲粮精粗比对小肠细菌功能的影响
肠道菌群结构对机体的生理功能、免疫功能、酶代谢等方面有一定影响[16]。阿日查等[17]对内蒙古锡林郭勒冬季放牧蒙古牛肠道微生物进行功能预测分析发现放牧蒙古牛肠微生物与分子、糖的生成和代谢等基础生命功能有关。说明各月份样品虽然都具有相同的功能,但是由于每个月份的样品中所含微生物的种类和数量有区别,所以各月份的效能存在差异。王柏辉等[18]研究不同饲养方式对苏尼特羊肠道菌群结构的影响发现肠道中细菌微生物代谢主要包括了10种代谢途径;其中代谢活跃度较高的有能量的产生和运输、氨基酸代谢和运输、碳水化合物代谢和运输、转采、核糖体合成和翻译、DNA复制和重组及修复和无机盐代谢和运输;其中氨基酸代谢、碳水化合物代谢、转录和DNA复制等代谢在舍饲羊中较活跃。本研究表明:在不同精粗比饲粮影响下,各处理组小肠微生物基因功能存在差异,尤其是在氨基酸和碳水化合物代谢方面,其变化趋势与理论一致;在此特定试验条件下,各处理组也出现了具有抗菌、抗肿瘤、耐药等功能的微生物基因,其有效提取和作用机理机制有待下一步工作探究。
4 结 论
利用基于ITS高通量测序技术对小肠微生物基因测序,探索了不同精粗比饲粮肠道微生物的组成和结构变化。本研究发现,随着饲粮精粗比,小肠微生物多样性和丰度均呈现不同程度变化,群落组成与结构也有相应的变化;强调了小肠微生物在早期断奶藏羔羊营养和肠道微生态学中的重要作用,为了解不同精粗比饲粮下早期断奶藏羔羊小肠微生物群的动态关系提供了重要的基础数据。
