肝片吸虫天冬酰胺内肽酶的分子特征、遗传进化及抗原特性研究
2021-12-14张国武孟庆玲王熙凤宁程程季春辉才学鹏
张国武,孟庆玲*,乔 军,王熙凤,张 凯,宁程程,季春辉,才学鹏
(1.石河子大学动物科技学院, 新疆 石河子 832003; 2.中国农业科学院兰州兽医研究所,甘肃 兰州 730046)
【研究意义】片形吸虫病(Fascioliasis)是由肝片吸虫(Fasciolahepatica,Fh)、大片吸虫(Fasciolagigantica,Fg)及“中间型”吸虫引起的一种重要的螺源性人兽共患寄生虫病,该病在全球具有广泛的流行性,多为散发流行,在我国呈地方性流行[1]。动物和人类常因生食带有囊蚴的水生植物或饮用被囊蚴污染的水而感染该病,成虫常寄生于牛、羊、鹿等反刍动物及其它多种草食性哺乳动物和人的肝脏胆管内,可引起急性、亚急性及慢性肝片吸虫病,给家畜生产和人类健康带来严重危害。近年来,随着气候的变化,全球牲畜吸虫病的流行率和疾病发生率不断加剧[2]。据WHO报告,全世界超过75个国家和地区报告了片吸虫病的感染病例[3],其中51个国家有人群感染了肝片吸虫[4]。据统计,全世界至少有260万~1700万人感染片形吸虫病,超过1.8亿人和2.5亿~7亿生产动物面临感染风险[5-7],该病可导致牛羊产奶量、肉类产量降低甚至造成其发病死亡,严重威胁全球粮食安全,每年给全球带来的经济损失超过30亿美元[8]。Fh中间宿主——淡水贝类在我国许多放牧地区广泛分布,导致人畜肝片吸虫病的流行,严重危害牧民健康,制约畜牧业的发展。【前人研究进展】目前对该病的防治主要依赖于三氯苯达唑等抗寄生虫药物[9],但由于三氯苯达唑等驱虫药物长期大剂量使用,Fh对驱虫药抗性不断增加[10],导致驱虫效率降低,肝片吸虫病的发病和流行呈上升趋势。此外,由于肝片吸虫生活史复杂,中间宿主和终末宿主广泛,且Fh被膜蛋白(Tegumental antigens,FhTeg)[11]、排泄分泌产物(Excretion/secretion products,ESP)[12]及细胞外囊泡(Extracellular vehicles,EVs)[13-14]等成分复杂多样,免疫调控机制尚不清楚,导致目前尚未研发出特异性高、敏感性强的诊断方法和高效的新型疫苗,给该病的诊断和防控带来了极大的困难。【本研究切入点】筛选出反应原性强、特异性强的抗原蛋白,研发特异敏感的诊断方法及安全高效的新型疫苗对该病的科学防控具有重要意义。【拟解决的关键问题】为了研发特异性强、敏感性高的肝片吸虫病免疫学诊断方法,本研究对肝片吸虫Legumain基因进行克隆和分子特征分析,利用原核表达系统表达Fh抗原蛋白,筛选并制备具有强反应原性Fh诊断抗原分子,为放牧动物肝片吸虫病的科学防控提供技术支撑。
1 材料与方法
1.1 菌株、质粒及试剂
表达载体pET-32a(+)和大肠杆菌(Escherichiacoli)DH5α由石河子大学动物科技学院寄生虫实验室保存。Transetta(DE3)购自北京全式金生物技术有限公司。反转录试剂盒(RR047A)、限制性核酸内切酶BamH I和XhoI、DNA Marker、pMD19-T(simple)克隆载体、T4DNA Ligase、IPTG、蛋白Marker均购自TaKaRa公司。琼脂糖凝胶回收试剂盒(D2500-2)购自Omega公司,质粒小量提取试剂盒购自南京诺唯赞生物科技有限公司。Gold View核酸染料购自北京博奥拓达科技有限公司。辣根过氧化物酶标记的兔抗羊IgG、NC膜均购自康为世纪生物公司,增强型DAB显色试剂盒购自北京索莱宝科技有限公司。
1.2 引物设计与合成
根据GenBank中已公布的肝片吸虫(登录号:LN628878.1)全基因组序列,利用 Primer 5.0 软件设计Legumain基因的上、下游特异性引物F1和R2,并参考pET-32a(+)表达载体的特性,分别在引物上、下游5′端引入BamH I和XhoI限制性内切酶位点,F1(上游):5′ CGCGGATCCATGTTATCCATGCAAATTTTA 3′(下划线部分为BamH I酶切位点);R2(下游):5′ CCGCTCGAGTCAAACACAAACATCATGAAT 3′(下划线部分为XhoⅠ 酶切位点),引物由华大基因生物公司合成。
1.3 Fh Legumain基因的扩增、克隆及测序
将采集的新鲜Fh虫体用 PBS 缓冲液清洗4~5遍,剪虫体的 1/5(约 10 mg),按照Trizol法提取Fh总RNA。用TaKaRa公司的反转录试剂盒将所提的RNA反转录为cDNA,于-80 ℃保存备用。以反转录的cDNA为模板,用设计的特异性引物F1-R2进行Legumain基因的扩增。PCR扩增体系为:H2O 9 μL,PCR Mixture 8 μL,cDNA模板2 μL,上、下游引物各0.5 μL。RT-PCR扩增条件为:95 ℃预变性5 min;94 ℃变性40 s,54 ℃退火40 s,72 ℃延伸1 min 30 s,35 个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增产物用1.5%琼脂糖凝胶电泳进行检测,切胶后用琼脂糖凝胶DNA回收试剂盒回收目的片段,将目的片段克隆入与pMD19-T载体中,将重组载体送至华大基因生物公司进行测序。
1.4 Fh Legumain基因及其编码蛋白的分子特征分析
将测序得到的序列与NCBI上GenBank中已公布的Legumain基因的序列进行BLAST同源比对分析,并利用ProtParam、TMHMM、Signal P、Motif Scan、DNA Star、IEDB、BepiPred-2.0和Expasy(Http://www.expasy.org)等软件分析预测Legumain蛋白质的理论分子质量、等电点、疏水性、跨膜区、信号肽、结构域、潜在的糖基化位点、优势抗原表位、结构域;通过SOMPA和Swiss-model预测目的蛋白的二级、三级结构。
1.5 Fh Legumain基因的遗传进化分析
应用DNAMAN、MEGA 6.0等软件对GenBank中已公布的大片吸虫、日本血吸虫、华支睾吸虫、马来丝虫、捻转血矛线虫等寄生虫Legumain基因的核苷酸序列进行比对分析,并采用NJ法(Neighbor-joining Method)构建系统进化树,自展值(bootstrap value)重复次数为1000。
1.6 Fh Legumain基因的表达与鉴定
将胶回收目的片段和原核表达载体pET-32a(+)连接,构建重组表达载体pET-Leg。将重组质粒pET-Leg转化入Transetta(DE3)感受态细胞,加入1.0 mmol/ L IPTG(终浓度)进行诱导表达,用SDS-PAGE检测重组蛋白是否表达。收集重组菌菌体,用超声波破碎,提取重组蛋白,并进行蛋白纯化。纯化后蛋白置-80 ℃冰箱保存备用。
1.7 Fh Legumain蛋白的抗原特性分析
将浓缩后的重组蛋白进行SDS-PAGE分析后,以感染Fh的绵羊阳性血清(1∶1000稀释)为一抗,用辣根过氧化物酶标记的兔抗羊IgG(1∶3000稀释)为二抗,进行Western blot检测,分析其反应原性。取10只雌性小鼠( 7只为实验组,3只为对照组。将纯化后的重组蛋白与等体积弗氏完全佐剂乳化混匀后,实验组的每只小鼠皮下注射200 μL,间隔14 d后进行第2次免疫。二免和三免时(间隔7 d),将纯化后重组蛋白与等体积弗氏不完全佐剂乳化混匀,实验组每只小鼠皮下注射200 μL,三免14 d后心脏采血,静置分离血清。用羊肝片吸虫IgG抗体ELISA检测试剂盒检测免疫小鼠血清是否产生抗体,分析其免疫原性。
2 结果与分析
2.1 Fh Legumain基因的RT-PCR扩增及双酶切鉴定
RT-PCR扩增产物为大小约1278 bp的目的条带,与预期目的条带大小一致,证明成功克隆到了Legumain基因(图1)。将克隆成功的Legumain基因转化入EscherichiacoliDH5α感受态细胞,筛选出阳性菌株,提质粒后经BamH I、XhoI 双酶切,得到1条约2693 bp的载体片段和1条约1278 bp的插入片段,表明pMD19-T克隆载体中成功插入目的片段(图2)。
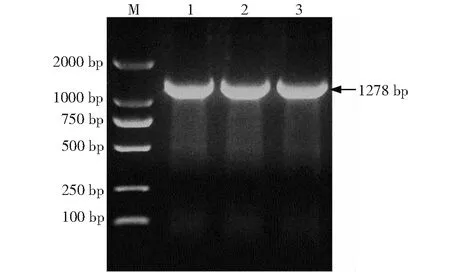
M:标准DNA(DL2000);1~3:Legumain基因RT-PCR产物 M:DNA marker (DL2000); 1-3: RT-PCR product of Legumain gene图1 Fh Legumain基因的RT-PCR扩增结果Fig.1 RT-PCR amplifications of Fh Legumain gene
2.2 Fh Legumain基因测序结果及分子特征分析
Legumain基因cDNA全长1278 bp,编码425个氨基酸。该序列与GenBank中公布的Fh(BN1106_s1861B000097)Legumain基因的核苷酸序列同源性为99.45%,氨基酸序列同源性为99.76%。该蛋白无跨膜区,在1~21位有信号肽。DNAStar分析发现,该蛋白抗原表位区集中在第19~28、73~103、205~216、254~308、319~337、360~375、394~413位。SMART和Motif Scan软件分析发现,该蛋白属于半胱氨酸蛋白酶C13家族,有1个保守的peptidase C13结构域(27~284)、1个凝血因子V LSPD重复区(LSPR,239~247);2个酰胺化位点(124~127、273~276);2个N-豆蔻酰化位点(155~160、314~319);3个N-糖基化位点(210~213、261~264、285~288);4个蛋白激酶C磷酸化位点(24~26、286~288、291~293、400~402);8个酪蛋白激酶Ⅱ磷酸化位点表明该蛋白的活性受到磷酸化的调控。SOMPA软件预测的二级结构中,α螺旋(h)占45.65%,β转角(t)占4.71%;无规则卷曲(c)占33.18%,表明Legumain蛋白二级结构主要以α螺旋和无规则卷曲为主。三级结构由无规卷曲连接9个α-螺旋和10个β转角构成“Z”字形的空间结构(图3)。
2.3 Fh Legumain基因的同源性与遗传进化分析
FhLegumain与GenBank中肝片吸虫(BN1106_s1861B000097)、(JXXN02000574.1)及大片吸虫(EF206822.1)氨基酸序列的同源性较高,分别为99.45%、99.30%、95.62%,位于同一进化分枝上,表明亲缘关系较近;但与华支睾吸虫、日本血吸虫、马来丝虫及其他寄生虫同源性在33.33%~53.44%,亲缘关系较远,表现出较大的种属差异(图4)。
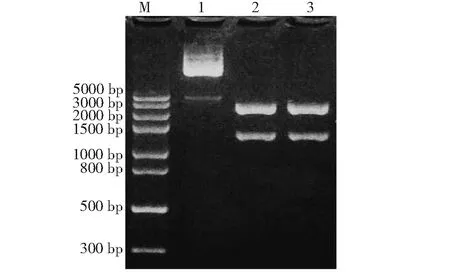
M:标准DNA(DL5000);1:重组质粒pMD-Leg4/5;2~3:重组质粒pMD-Leg4/5双酶切产物 M: DNA marker (DL5000); 1: pMD-Leg4/5 plasmid; 2-3: Products of pMD-Leg4/5 plasmid digested by double enzyme图2 重组质粒pMD-Leg4/5双酶切鉴定Fig.2 Identification of recombinant plasmid pMD-Leg4/5 by double enzyme digestion

Legumain基因引物序列(下划线);抗原表位集中区(阴影部分);1个Peptidase_C13结构域(虚线框);1个凝血因子V LSPD重复(LSPR)(斜体);2个酰胺化位点(虚下划线);2个N-豆蔻酰化位点(双下划线);3个N-糖基化位点(波浪线);4个蛋白激酶C磷酸化位点(方框);8个酪蛋白激酶Ⅱ磷酸化位点(斜体加粗) Primer sequence of Legumain gene (underlined);The antigen epitope clusters (shaded);One Peptidase_C13 structure domain (dotted box);one Coagulation Factor V LSPD Repeat (Italics);Two amidation sites (virtual underline);Two N-myristoylation sites (double underlined);Three N-glycosylation sites (wavy lines);Four protein kinase C phosphorylation sites (box);Eight Casein kinase II phosphorylation sites (Italic bold)图3 Legumain基因核苷酸序列及编码氨基酸序列Fig.3 Nucleotide sequence and amino acid sequence of Legumain
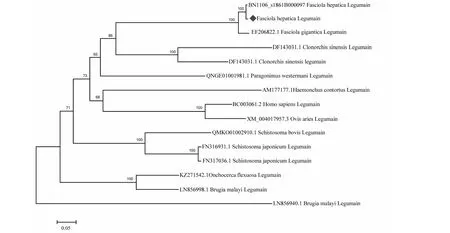
图4 基于Legumain基因核苷酸序列的遗传进化分析Fig.4 Phylogenetic analysis based on nucleotide sequence of Legumain gene
2.4 重组表达载体的鉴定
重组表达载体pET-Leg4/5经EcoRⅠ和XhoI 双酶切,得到5900 bp的载体片段和1278 bp的目的条带,与预期结果相符(图5)。测序结果进一步证明成功将目的基因插入到原核表达载体pET-32a(+)中。
2.5 Fh Legumain重组蛋白的诱导表达与纯化
SDS-PAGE检测到65 kDa处有单一目的条带,与预测大小一致;而在超声裂解上清中未见目的条带,表明重组蛋白以包涵体形式存在。纯化后的重组蛋白经SDS-PAGE检测可见单一的蛋白条带,透析后浓缩至终浓度为1 mg/mL,储存于-80 ℃冰箱以备后续实验(图6-A)。
2.6 重组蛋白的反应原性与免疫原性分析
以绵羊Fh阳性血清为一抗,以HRP标记的兔抗羊IgG为二抗,经western blot分析可见单一的蛋白条带(图6-B),证明表达产物具有良好的反应原性。重组蛋白免疫小鼠后获得的血清用羊Fh IgG抗体ELISA检测试剂盒检测,实验组10只小鼠血清均为阳性,对照组5只均为阴性,表明Fh 重组蛋白Legumain能够刺激机体产生相应的抗体,具有较强的免疫原性。
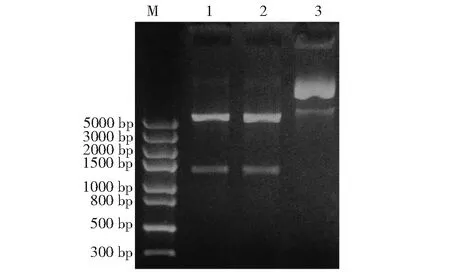
M:标准DNA(DL5000);1~2:重组质粒pET-Leg4/5双酶切产物;3:重组质粒pET-Leg4/5 M: DNA marker (DL5000); 1-2: Products of pET-Leg4/5 plasmid digested by double enzymes; 3: pET-Leg45 plasmid图5 重组质粒pET-Leg4/5双酶切鉴定Fig.5 Identification of recombinant plasmid pET-Leg4/5 by double enzyme digestion
3 讨 论
肝片吸虫病的早期准确诊断对于该病的科学防控至关重要。目前,肝片吸虫病的诊断主要依赖于病原学、免疫学及分子生物学诊断方法。然而,Fh在侵染终末宿主2~3个月后才能成熟排卵,排卵初期虫卵数量较少[15],且排卵数受感染阶段[16]、感染负荷和驱虫药物的影响,因此通过粪便中虫卵检查的可靠性低、敏感性差[17],难以了解其实际感染情况。因此,粪便中虫卵检测方法不适合该病早期、急性期及潜伏期的诊断。
近年来,国内外学者已从Fh的被膜蛋白、排泄分泌产物(ESP)及细胞外囊泡(EVs)等成分中筛选出组织蛋白酶(L1,L2,L5)、组织蛋白酶B、过氧化物酶(Prx)、谷胱甘肽S-转移酶(GST)、脂肪酸结合蛋白(FABP)、亮氨酸氨基肽酶(LAP)以及Fh防御分子(Fh HDM))等[18-19]多个Fh抗原蛋白并进行了免疫学特性研究。然而,由于Fh抗原成分非常复杂,国内外已建立的Fh诊断方法其特异性和敏感性不够理想,且与其他寄生虫存在一定的血清交叉反应,在一定程度上限制了其在Fh流行地区的推广使用。因此,开展Fh蛋白抗原特性研究对于研发肝片吸虫病敏感、特异的诊断抗原具有重要意义。
Legumain属于肽酶C13家族,又称天冬酰胺内肽酶(Asparaginyl endopeptidase,AEP),是半胱氨酸蛋白酶家族新成员。该蛋白是大片吸虫、肝片吸虫[20]、血吸虫、华支睾吸虫[21]和泰国肝吸虫[22]等寄生虫排泄分泌产物(ESP)的重要成分,可在其多个发育阶段特异性表达[23]。因此,Legumain在吸虫病的诊断中具有潜在的应用价值。Laha等[22]利用重组Ov-AEP-1抗原对后睾吸虫病的血清样品进行检测,发现其敏感性和特异性分别为85%和100%,显示出较好的诊断抗原潜力。在曼氏血吸虫中,基于天冬酰胺内肽酶(Sm32)建立的检测抗体的ELISA具有较高的敏感性和特异性[24],提示Sm32重组抗原是诊断埃及流行地区血吸虫病的重要候选抗原之一[25]。

图A: 重组蛋白Legumain 4/5的SDS-PAGE鉴定。M.蛋白marker;1.pET-32a载体菌株IPTG诱导6 h;2.重组菌诱导前;3~6.重组菌诱导2、4、6、8 h;7~8.纯化后的Legumain4/5重组蛋白。图B:重组蛋白Legumain 4/5的western blot分析。M.蛋白marker;1.重组蛋白上清液;2.重组蛋白 A: Identification of recombinant Legumain 4/5 by SDS-PAGE.M.Protein marker; 1.pET-32a carrier strains IPTG induction of 6 hours; 2.Before the recombinant strains induct; 3-6.Recombinant strains induced by 2, 4, 6, 8 hours; 7-8.Legumain 4/5 recombinant protein after purification.B:Western blotting analysis of recombinant Legumain 4/5.M. Protein marker; 1.Supernatant of recombinant protein; 2.Recombinant protein图6 重组蛋白Legumain 4/5的诱导表达及鉴定结果Fig.6 Induced expression and identification of recombinant protein Legumain 4/5
4 结 论
本研究对FhLegumain蛋白基因的分子特征及其免疫学特性进行了研究,通过RT-PCR方法扩增出绵羊FhLegumain基因,测序后对该基因进行了分子特征分析,并高效表达该重组蛋白。Western blot分析证实,该重组蛋白可被绵羊肝片吸虫阳性血清特异性识别;小鼠免疫试验证实该蛋白具有良好的免疫原性,提示该蛋白在肝片吸虫免疫学诊断方法研发中具有潜在的应用价值。
